清解扶正颗粒对体外淋巴管生成的抑制作用*
关建华 逯遥 朱晓勤,2 林久茂,2#
(1 福建中医药大学中西医结合研究院 福州350122;2 福建省中西医结合老年性疾病重点实验室 福州350122)
恶性肿瘤的浸润转移严重威胁着人类的健康[1],淋巴转移是肿瘤转移的最常见方式。近年来研究发现,淋巴管生成是促使肿瘤的生长及发生淋巴转移的前兆,也是预防癌症转移的治疗靶点[2],因此,通过抑制淋巴管生成从而达到抗肿瘤转移已成为研究热点[3]。有学者证实,人淋巴管内皮细胞(Human Lymphatic Endothelial Cell,HLEC)是肿瘤发生转移的主要作用界面[4],主要是通过诱导HLEC 增殖和管腔生成,为肿瘤淋巴转移提供直接通道,最终发生向远处扩散[5]。近年来,中医药在肿瘤治疗及预后中得到很大的运用。本课题组研究发现,清解扶正颗粒(Qingjiefuzheng Granules, QFG)可以抑制肝癌细胞[6~7]和大肠癌细胞[8~10]的增殖,还能够减轻 5-FU 化疗引起的肠道损伤作用[11~12],并且可体外抑制血管生成[13]。然而,QFG 是否可以通过抑制淋巴管生成从而发挥抑制肿瘤的作用尚不清楚,因此本研究对此进行了探索。现报道如下:
1 实验材料
1.1 实验细胞 HLEC 购于广州吉尼欧生物技术有限公司。
1.2 药物配置 QFG(由福建中医药大学药学院制剂室提供),磷酸盐缓冲液(PBS)配置成50 mg/ml的浓度,超声助溶后使用孔径0.45 μm 的过滤器进行过滤,放置于4℃冰箱内储存备用。
1.3 实验试剂耗材 ECM 培养基套装(购于美国ScienCell 公司);PBS(购于美国 Life technologies 公司);DAPI 染色试剂盒(购于江苏凯基生物技术股份有限公司);结晶紫、四唑盐[MTT(购于北京索莱宝科技有限公司)];迁移小室(购于美国Corning 公司);管腔试剂盒(购于美国Abcam 公司)。
1.4 实验仪器 二氧化碳培养箱、多功能酶标仪(美国Thermo 公司);超净工作台(苏州净化设备公司);全自动细胞计数仪(美国Life 公司);荧光显微镜、倒置显微镜系统(德国Leica 仪器有限公司)。
2 实验方法
2.1 细胞培养 HLEC 采用ECM 完全培养基 [胎牛血清(fetal calf serum,FBS)25 ml、内皮细胞生长补充物(Endothelial Cell Growth supplements,ECGS)5 ml 和 青 霉 素 - 链 霉 素 溶 液 双 抗(Penicillin-Streptomycin)5 ml],置于 37℃、含 5%二氧化碳、饱和湿度的细胞培养箱中培养。
2.2 细胞活力检测 运用MTT 法检测细胞活力。取对数生长期的HLEC 按照1×105/ml 的密度接种于96 孔培养板中,观察细胞汇合度达到50%~60%时,加入 100 μl/孔含不同浓度 QFG(0、0.5、1.0、2.0 mg/ml)的培养液干预24 h,吸弃培养液,添加100 μl/孔 MTT(0.5 mg/ml)溶液继续培养 4 h,吸弃后加入二甲基亚砜(DMSO)100 μl/ 孔,置于酶标仪(波长570 nm)中测定光密度(OD)值。细胞活力计算公式:细胞活力(%)=实验组OD 值/对照组OD 值×100%;
2.3 细胞形态观察 取对数生长期的HLEC 按2×105/孔的密度接种于6 孔培养板中,细胞汇合度达到50%~60%时,加入不同浓度 QFG(0、0.5、1.0、2.0 mg/ml)的培养液干预24 h,吸弃原培养基并用PBS 清洗,放置于倒置显微镜中观察细胞的形态变化并拍照(200×)。
2.4 细胞凋亡实验 取对数生长期的HLEC 按照1×105/ml 的密度接种到12 孔板中。当细胞汇合度达到 50%~60%时,添加不同浓度 QFG(0、0.5、1.0、2.0 mg/ml)的培养液干预细胞24 h,随后使用4%的多聚甲醛溶液固定10 min,DAPI 染色10 min,用PBS 清洗后用荧光显微镜(100×)拍摄。
2.5 细胞迁移实验 HLEC 经不同浓度QFG(0、0.5、1、2 mg/ml)的培养液干预 24 h 后,吸弃原培养基,消化离心并收集细胞,用空白ECM 培养基重悬以调整细胞密度为2.5×105/ml,小室内加入200 μl重悬液(5×104个细胞),室外加入 700 μl 完全ECM 培养基,放入恒温箱培育12 h 后进行处理,吸弃原培养基后使用4%多聚甲醛固定和结晶紫染色各10 min,晾置干燥后,放置于倒置显微镜镜下随机选取5 个视野拍照(100×)。
2.6 管腔形成实验 冰上操作配置基质胶,并铺置于48 孔板中,随后置于恒温培养箱中凝胶1 h;凝胶期间处理QFG 干预后的HLEC,按照4×104/孔接种于基质胶上,放置恒温箱中孵育3 h 后置于倒置显微镜观察并拍摄(100×)。
2.7 统计学处理 采用SPSS 22.0 统计学软件对数据进行处理,计量资料符合正态分布以()表示,多组数据比较实用单因素变量分析,P<0.05 表示数据有统计学差异。
3 结果
3.1 QFG 对HLEC 的增殖能力的影响 MMT 法检测细胞活力结果显示,与正常组比较,QFG 干预后各组细胞活力均有不同程度的下降,活力值依次为(75.69±4.23)%、(65.68±4.35)%和 (4.76.66±2.46)%,说明QFG 对HLEC 细胞活力有抑制作用,且呈现浓度依赖性,并具有统计学差异(*P<0.05,#P<0.01)。见图 1。
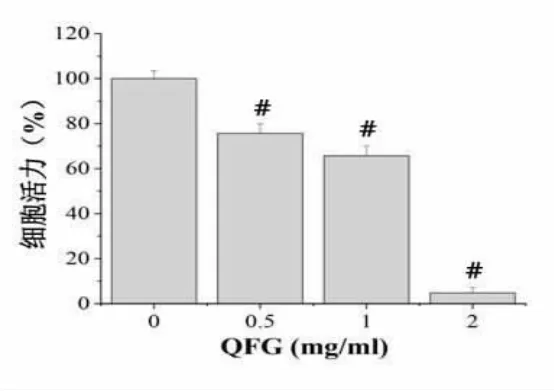
图1 QFG 对HLEC 的增殖能力的影响
3.2 QFG 对HLEC 细胞形态的影响 细胞形态观察结果显示,与正常组比较,不同浓度的QFG 干预后,HLEC 细胞密度逐渐减小,并出现细胞脱落。证实QFG 对HLEC 细胞形态有着改变作用,与对细胞活力的抑制正相关,呈现浓度依赖性。见图2。
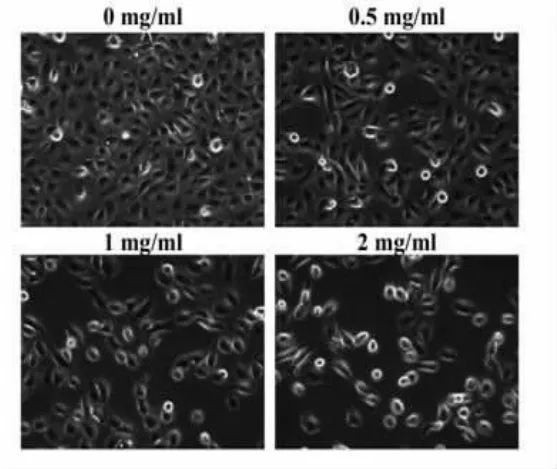
图2 QFG 对HLEC 细胞形态的影响
3.3 QFG 对HLEC 细胞凋亡的影响 DAPI 染色结果显示,正常组的细胞存在细胞凋亡现象,正常组的凋亡率为(10.82±3.00)%,经不同浓度QFG 干预24 h 后,各组细胞呈现不同程度的凋亡现象,且随着QFG 浓度增加,HLEC 细胞的凋亡率逐渐上升,其凋亡率分别为(24.26±2.41)%、(38.80±7.63)%和(69.51±9.72)%,说明 QFG 对 HLEC 细胞凋亡有促进作用,表现为浓度依赖性,且具有统计学差异(*P<0.05,#P<0.01)。见图 3。
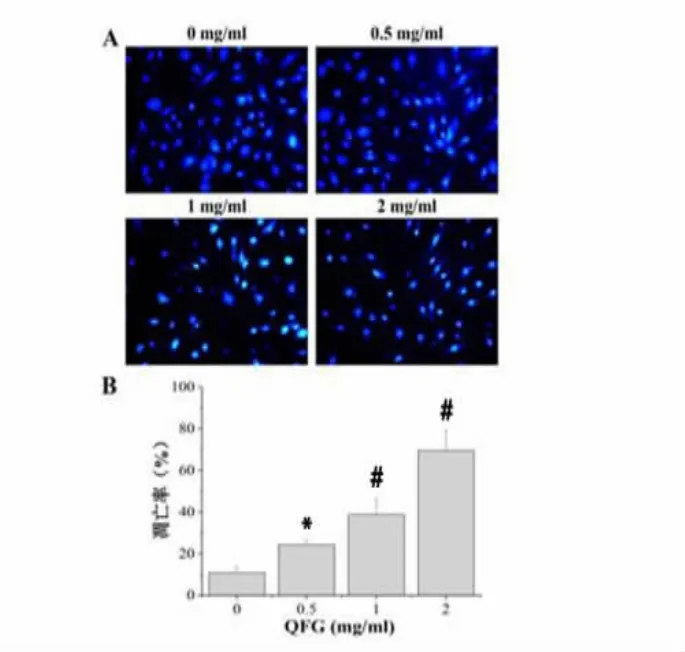
图3 QFG 对HLEC 细胞凋亡能力的影响
3.4 QFG 对HLEC 细胞损伤修复能力的影响 细胞划痕实验结果显示,正常组HLEC 划痕部位随着时间延长,可以出现逐渐修复愈合,提示我们HLEC细胞自身具有损伤修复能力;不同浓度的QFG 干预HLEC 后,随着QFG 药物浓度的逐渐增加,HLEC细胞损伤修复能力逐渐降低,表明QFG 对HLEC细胞损伤修复能力的具有抑制作用。见图4。
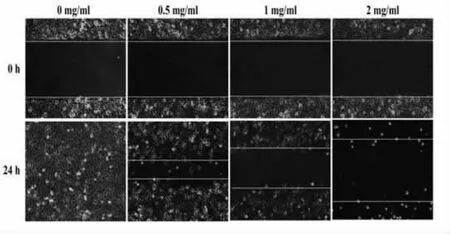
图4 QFG 对HLEC 细胞损伤修复能力的影响(100×)
3.5 QFG 对HLEC 细胞迁移能力的影响 迁移实验结果显示,正常组细胞可以迁移成功,证明HLEC细胞自身具有迁移能力;经过QFG 干预后,QFG 0.5 mg/ml 组与 1 mg/ml 组的细胞迁移率分别为(72.93±2.48)%与(10.32±0.69)%,QFG 2 mg/ml 组完全抑制HLEC 细胞的迁移能力。结果表明,QFG对HLEC 迁移能力有抑制作用,并呈现浓度依赖性,与正常照组比较具有统计学差异(*P<0.05,#P<0.01)。见图 5。

图5 QFG 对HLEC 细胞迁移能力的影响
3.6 QFG 对HLEC 细胞管腔生成能力的影响 管腔生成实验结果显示,正常组HLEC 细胞有较多的管腔生成,提示HLEC 细胞自身具有较好的管腔生成能力;不同浓度的QFG 干预后,各组管腔生成率均得到完全抑制,与正常对照组比较具有显著统计学差异(#P<0.01)。结果表明,QFG 能够对 HLEC 细胞管腔生成能力有抑制作用。见图6。
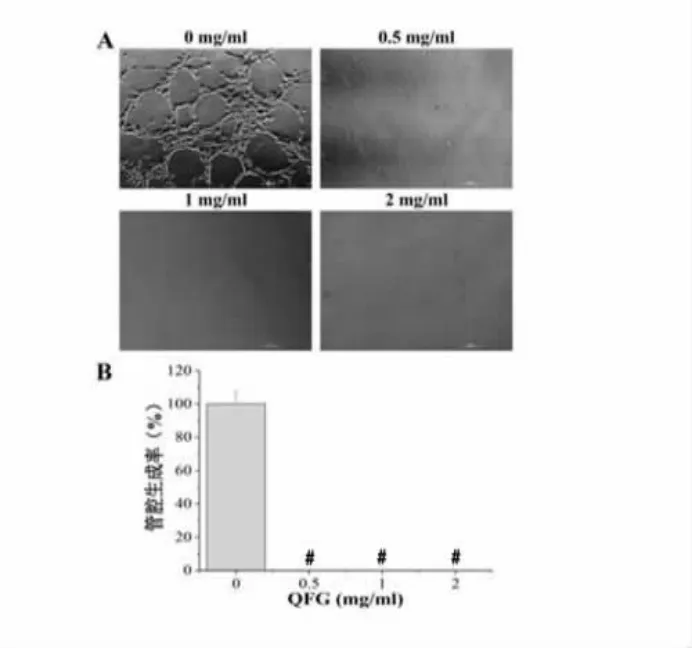
图6 QFG 对HLEC 细胞管腔生成能力的影响
4 讨论
肿瘤的转移扩散是癌症发展的早期事件,从肿瘤淋巴管的转移过程来看,主要是通过诱导肿瘤淋巴管生成,从而达到淋巴道转移的目的。肿瘤淋巴管生成是转移的重要环节,也就是淋巴道转移的“开关点”[14]。目前,通过抑制淋巴管生成从而抑制肿瘤转移是抗肿瘤转移的研究热点之一。然而,所谓淋巴管生成,是指在病理状态下,设计多种成分和生长因子等参与的复杂过程,包含有人淋巴内皮细胞的增殖、迁移及管腔生成等过程[15~16]。HLEC 细胞的增殖、迁移及管腔生成促进了淋巴管生成,在淋巴管生成过程中,发挥着重要作用。因此,研究抑制淋巴管生成主要就是研究药物干预对HLEC 细胞的增殖、迁移及管腔生成能力的影响情况。
清解扶正颗粒是由白花蛇舌草、半枝莲、炙黄芪、炒麦芽等组成,具有清热解毒、健脾补气和益气固表等功效,常用于治疗多种消化道恶性肿瘤,减轻患者不良反应等。前期研究中,体内外实验均证实QFG 能够抑制肿瘤增殖、转移及血管生成等,但抗肿瘤转移中的机制需进一步阐明,因此通过研究淋巴管生成可探索QFG 抑制肿瘤转移的作用机制。
本研究中,我们以HLEC 作为研究对象,采用不同浓度的QFG 进行干预,观察QFG 对淋巴管生成的影响。MTT 实验结果显示,QFG 能够抑制HLEC 细胞增殖,且具有浓度依赖性,同时可以改变HLEC 的细胞形态,二者呈现正相关;DAPI 染色实验结果显示,QFG 干预HLEC 细胞后,细胞凋亡水平逐渐增加,证实QFG 能够促进HLEC 细胞凋亡。此外,细胞划痕实验及迁移实验显示,QFG 干预HLEC 后,HLEC 的细胞损伤修复及迁移能力均得到抑制,且呈现出浓度依赖性。管腔生成是淋巴管生成最关键的过程,通过管腔生成实验我们发现,QFG干预后,HLEC 细胞管腔生成能力得到显著抑制,说明QFG 能够抑制HLEC 的管腔生成能力。
综上所述,QFG 能够促进HLEC 细胞凋亡,抑制HLEC 细胞增殖、迁移及管腔生成能力,从而来达到抑制淋巴管生成的作用。然而QFG 作为中药复方,所包含的成分十分复杂,同时淋巴管生成与淋巴结转移的过程也是比较复杂的,需要在后续的研究中,通过多条淋巴管生成信号通路进行深入研究,以更加完善系统地探讨QFG 抑制淋巴管生成的作用机制。

