sdLDL-C、IMA、25-OH-VD与急性缺血性脑卒中的相关性研究①
张 梅 张长庚 姜玉荣 刘 娜 王海志 王亚丽
(衡水市人民医院检验科,衡水 053000)
急性缺血性脑卒中(acute ischemic stroke,AIS)是全球第二大死亡原因,致残率、致死率较高[1]。探讨能准确评估AIS患者病情、预测预后的生物学指标有助于指导临床治疗,成为临床研究热点。脂代谢异常是心脑血管动脉硬化性疾病的危险因素,小而密低密度脂蛋白胆固醇(small and dense low density lipoprotein,sdLDL-C)是公认的动脉粥样硬化相关脂质测量指标,是预测冠心病稳定患者再次发生不良心血管事件的最有效指标,但其在AIS中的报道较为少见[2,3]。缺血修饰白蛋白(ischemia modified albumin,IMA)是新型心肌缺血标志物,敏感性高。近年研究发现ASI患者血清IMA水平显著升高,在AIS诊断、病情评估等方面具有应用前景[4]。25-羟基维生素D(25-hydroxyivita-minD3,25-OH-VD)是机体内维生素D存在的形式之一,25-OH-VD缺乏可增加AIS发病风险,与AIS颈动脉狭窄程度、短期预后、病情严重程度关系密切[5-7]。本研究通过前瞻性对照组实验探讨血清sdLDL-C、IMA、25-OH-VD水平与老年AIS患者分型、病情和预后的关系,为临床诊治提供参考。
1 资料与方法
1.1资料
1.1.1一般资料 选取2018年6月至2019年6月哈励逊国际和平医院神经内科收治的150例AIS患者(AIS组),另选择同期于我院门诊体检的150例老年志愿者为对照组,均经CT/MRI排除AIS。AIS组男性85例,女性65例,年龄62~75岁,平均年龄(65.62±7.59)岁,合并基础疾病:高血压患者52例、糖尿病患者36例、高血脂患者42例、冠心病患者15例;AIS家族史患者21例;对照组男性90例,女性60例,年龄63~79岁,平均年龄(66.36±9.56)岁,合并高血压患者43例、糖尿病患者25例、高血脂患者13例、冠心病患者7例;AIS家族史患者2例。两组性别、年龄差异无统计学意义(P>0.05)。本研究经哈励逊国际和平医院伦理会批准,所有患者及家属知情同意。纳入标准:①符合1995年第四届全国脑血管病学术会议颁布的各类脑血管病中AIS的诊断标准,并经颅脑CT或MRI证实一侧脑组织损伤,首次诊断为脑梗死[8];②发病<7 d;③年龄≥60岁;④参与者知情同意,愿意配合相关检查。排除标准:①合并严重肝肾功能不全、自身免疫性疾病、血液病、近期感染或甲状腺疾病;②发病前3个月内服用过钙剂等维生素D制剂及别嘌醇、苯溴马隆等降尿酸药物;③失访患者。
1.1.2试剂与仪器 sdLDL-C试剂盒购自北京九强生物技术有限公司,IMA试剂盒购自潍坊三维生物工程集团有限公司,7600全自动生化分析仪购自日立公司, I2000全自动化学发光免疫分析仪及配套试剂购自雅培公司。
1.1.3分型 脑卒中可为完全前循环梗死型(total anterior cerebral infarction,TACI)、部分前循环梗死型(partial anterior cerebral infarction,PACI)、腔隙性梗死型(lacunar cerebral infarction,LACI)及后循环梗死型(posterior cerebral infarction,POCI)。
1.2方法
1.2.1sdLDL-C、IMA、25-OH-VD检测 所有受试者禁食12 h后于次日晨6~8点采集前臂桡静脉血2~3 ml于红色真空管送检,3 500 r/min离心10 min,取血清置于-20℃冰箱保存,48 h内完成检测。全自动生化分析仪检测血清sdLDL-C、IMA水平。全自动化学发光免疫分析仪检测25-OH-VD水平,相应校正品和质控物进行定标和质量控制。血清 sdLDL-C检测采用过氧化物酶法,IMA检测采用间接法,25-OH-VD检测采用竞争法。
1.2.2ASI病情评估 采用美国国立卫生院神经功能缺损评分(national institutes of health stroke scale,NIHSS)评价AIS患者神经功能缺损情况。依据NIHSS评分根据将患者分为3组:轻度神经功能损伤组(轻度组),NIHSS评分<13分;中度神经功能损伤组(中度组),13分≤NIHSS<22分;重度神经功能损伤组(重度组),NIHSS评分≥22分[9]。
梗死面积分组:根据患者第一次CT/MRI扫描检查出病灶大小,以Adama分型法将患者分为3组:大梗死组(直径>3.0 cm并累及2个脑解剖部位);小梗死组(直径1.5~3.0 cm);腔隙性梗死组(直径<1.5 cm)[10]。
1.2.3AIS预后评估 根据发病4周NIHSS评分进行预后判读,痊愈:NIHSS评分降低90.00%~100.00%,残疾程度0级;显著进步:NIHSS评分降低46.00%~89.00%,病残程度1~3级;进步:NIHSS评分降低18.00%~45.00%;无效:NIHSS评分降低或升高<18.00%;恶化:NIHSS评分升高>18.00%或死亡。将痊愈、显著进步、进步患者作为好转组,将无效、恶化患者作为无好转组[8,11]。

2 结果
2.1血清sdLDL-C、IMA、25-OH-VD水平对比 与对照组相比,AIS组血清sdLDL-C、IMA水平升高(P<0.05),25-OH-VD水平降低(P<0.05),见表1。
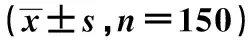
表1 两组血清sdLDL-C、IMA、25-OH-VD水平Tab.1 Serum sdLDL-C,IMA and 25-OH-VD levels between two
2.2不同AIS分型、神经损伤程度、梗死面积患者血清sdLDL-C、IMA、25-OH-VD水平 OCSP分型为TACI患者46例、PACI患者35例、LACI患者37例、POCI患者32例,神经损伤程度轻度68例,中度47例,重度35例,大梗死患者39例、小梗死患者61例、腔隙性梗死50例。血清sdLDL-C、IMA水平随神经损伤程度加重及梗死面积增加而升高(P<0.05),血清25-OH-VD水平降低(P<0.05)。TACI分型组血清sdLDL-C、IMA水平高于其他分型(P<0.05),血清25-OH-VD水平在OCSP分型差异无统计学意义(P>0.05),见表2。

表2 不同AIS分型、神经损伤程度、梗死面积患者血清sdLDL-C、IMA、25-OH-VD水平Tab.2 Serum levels of sdLDL-C,IMA and 25-OH-VD in patients with different AIS types,degree of nerve injury and infarct
2.3不同预后患者血清sdLDL-C、IMA、25-OH-VD水平 预后好转组95例,无好转组55例,好转组血清sdLDL-C、IMA水平低于无好转组(P<0.05),25-OH-VD高于无好转组(P<0.05),见表3。

表3 不同预后患者血清sdLDL-C、IMA、25-OH-VD水平Tab.3 Serum levels of sdLDL-C,IMA and 25-OH-VD in patients with different
2.4血清sdLDL-C、IMA、25-OH-VD水平与AIS预后的关系 逐步多元线性回归分析血清sdLDL-C、IMA、25-OH-VD水平与AIS预后的关系,并校正了年龄、性别、合并基础疾病等影响因素,血清sdLDL-C(OR=3.200,95%CI:1.025~13.251,P=0.000)、IMA(OR=2.588,95%CI:1.035~8.743,P=0.000)、25-OH-VD(OR=2.323,95%CI:1.135~7.594,P=0.000)、合并糖尿病(OR=1.861,95%CI:1.035~3.525,P=0.036)、合并高血脂(OR=1.659,95%CI:1.042~3.319,P<0.05)与AIS预后关。二元Logistic回归单因素模型分别引入血清sdLDL-C、IMA、25-OH-VD,血清sdLDL-C(OR=2.651,95%CI=1.235~6.591,P<0.05)、IMA(OR=1.685,95%CI=1.324~4.951,P<0.05)、25-OH-VD(OR=1.304,95%CI=1.009~4.527,P<0.05)水平与AIS预后相关,多因素模型引入年龄、性别、合并基础疾病等指标,校正后血清sdLDL-C(OR=2.041,95%CI=1.133~8.541,P<0.05)、IMA(OR=1.349,95%CI=1.075~5.241,P<0.05)、25-OH-VD(OR=1.138,95%CI=1.031~4.761,P<0.05)水平仍然与AIS预后相关。
2.5血清sdLDL-C、IMA、25-OH-VD水平对AIS患者预后的预测价值 血清sdLDL-C水平预测AIS患者预后的最佳截断值为1.30 mmol/L,AUC为0.834(95%CI:0.749~0.920),灵敏度、特异度分别为86.32%、83.64%;IMA水平预测AIS患者预后的最佳截断值为62.35 U/ml, AUC为0.776(95%CI:0.691~0.860),灵敏度、特异度分别为83.16%、78.18%;25-OH-VD水平预测AIS患者预后的最佳截断值为12.34 ng/ml, AUC为0.725(95%CI:0.635~0.816),灵敏度、特异度分别为78.95%、76.36%。sdLDL-C AUC与IMA、25-OH-VD相比差异无统计学意义(P>0.05),IMA、25-OH-VD AUC相比差异亦无统计学意义(P>0.05)。
3 讨论
动脉粥样硬化是AIS发病的主要机制,脂质代谢紊乱在动脉粥样硬化过程中发挥重要作用。sdLDL-C是LDL-C亚型,具有更强的致动脉硬化作用[12]。sdLDL-C分子中载脂蛋白B(ApoB)与LDL-C亲和力低,在血液中清除缓慢,不易被肝脏分解,更易进入动脉管壁,促进泡沫细胞形成。sdLDL-C颗粒小、数量多、比表面积大、易穿过血管内皮,且唾液酸含量少,更有利于与血管壁阴离子蛋白多糖结合进入血管内皮细胞,导致脂质沉积并转变为泡沫细胞。sdLDL-C可促进氧化LDL-C(OX-LDL)生成,OX-LDL具有内皮毒性,加剧氧化应激反应和血管内皮损伤,氧化应激状态下,趋化因子、黏附分子大量聚集,单核细胞黏附聚集移入血管内皮转化为巨噬细胞,巨噬细胞吞噬OX-LDL产生大量泡沫细胞,诱发动脉粥样硬化[13,14]。目前sdLDL-C与AIS的相关研究较少,Pokhared等[15]认为高水平sdLDL-C与动脉粥样硬化疾病风险及老年患者认知功能障碍相关。Manabe等[16]发现AIS患者血清sdLDL-C水平高于健康人群,且与AIS不良预后有关。Shen等[17]认为sdLDL-C水平与老年AIS患者颈动脉狭窄程度呈正相关,是老年AIS的独立危险因素。本研究AIS组患者血清sdLDL-C水平明显高于对照组,且随神经功能损伤程度加重及梗死面积增加而升高,提示sdLDL-C升高可能是导致AIS发生发展的关键机制。本研究进一步观察sdLDL-C与AIS患者的预后关系,结果表明无好转组患者血清sdLDL-C水平高于好转组,Logistic多元线性回归和二元回归分析均显示血清sdLDL-C水平与AIS患者预后相关,ROC曲线分析血清sdLDL-C=1.30 mmol/L是AIS预后不良的临界点,与徐竞等[18]研究结果一致。IMA是急性缺血性事件早期诊断中非常有价值的生物标志物,是被降解修饰的人血清白蛋白、在缺血/再灌注时,其氨基酸序列被自由基等破坏,与过渡金属结合而产生[19]。Menon等[20]研究显示AIS患者血清IMA水平高于健康志愿者,可作为AIS早期诊断的敏感指标。张春荣等[21]报道血清IMA水平在急性进展性脑梗死患者发病12、24、72 h逐渐增高,而急性非进展性脑梗塞患者血清IMA水平则无明显变化,提示IMA与ASI病情严重程度相关。长时间脑灌注无法恢复,导致缺血半暗带持续低灌注,发生不可逆缺血性坏死,不利于侧支循环建立,低灌注导致氧自由基和代谢产物不断增加,进而增加IMA。Jena等[22]认为血清IMA水平与过氧化产物丙二醛水平呈正相关,提示IMA水平受氧化应激影响。AIS发生时,脑缺血缺氧导致能量代谢障碍,兴奋性神经介质导致,增加钙离子内流,产生大量氧自由基,诱发神经细胞死亡,氧自由基通过血脑屏障进入血液循环,诱导IMA形成。本研究显示AIS患者血清IMA水平高于对照组,且IMA水平与OCSP分型、梗死面积和NHISS评分显著相关,与既往研究结果一致[23-25]。本研究通过Logistic回归和ROC曲线分析显示IMA与ASI患者预后有密切关系,可用于预测ASI患者预后。
维生素D缺乏作为全球公共卫生问题在医学界备受关注,与骨质疏松、糖尿病、癌症、自身免疫性疾病及心血管疾病等密切相关。25-OH-VD通过抑制血管平滑肌增殖和钙化对心脑血管疾病起保护作用,可下调炎症因子表达,上调抗炎因子表达,降低动脉炎症损伤,延缓动脉硬化进程。25-OH-VD可降低胰岛素抵抗和血脂水平,控制心脑血管疾病进展。Daubail等[6]发现25-OH-VD水平与NIHSS评分有关,25-OH-VD水平下降预示神经损伤程度加重。Turetsky等[7]报道显示25-OH-VD水平与AIS梗死面积相关,是AIS梗死面积独立预测因子。本研究AIS患者血清25-OH-VD水平低于对照组,且随NHISS评分和梗死面积的提高而降低,提示25-OH-VD水平可反映AIS患者病情严重程度,可作为评估AIS患者病情的生物学指标。但本研究尚未发现25-OH-VD水平与OCSP分型相关,提示25-OH-VD缺乏并不对OCSP分型产生影响。Logistic回归和ROC曲线分析25-OH-VD与AIS患者预后独立相关,AUC达0.725,与sdLDL-C和IMA相近,提示通过监测血清25-OH-VD水平可较为可靠的了解患者预后,为临床治疗方案拟定提供参考。
综上所述,血清sdLDL-C、IMA水平增高和25-OH-VD缺乏可能导致AIS患者病情进展和不良预后,sdLDL-C、IMA、25-OH-VD是评价AIS患者病情、梗死面积和预后的可靠指标,sdLDL-C≥1.30 mmol/L,IMA≥62.35 U/ml,25-OH-VD≤12.34 ng/ml时提示为较重的神经损伤和较大面积的脑梗塞以及不良预后的可能。监测血清sdLDL-C、IMA、25-OH-VD 水平有助于AIS病情评估和预后预测,为临床治疗提供指导。

