IL-2与IL-33佐剂增强铜绿假单胞菌外膜囊泡的免疫保护效果①
肖 非 曹二龙 卿 蕊 胡 智
(邵阳学院医学检验学院,邵阳 422000)
铜绿假单胞菌(Pseudomonasaeruginosa,Pa)是一种广泛存在于人体内的革兰氏阴性条件致病菌,可导致泌尿道、烧伤创面、下呼吸道等多种组织系统的严重感染[1]。研究表明,Pa是引起院内和社区获得性感染的主要原因之一,特别对于免疫系统较弱的人群,包括囊性纤维化以及手术治疗患者,其对Pa感染更为敏感[2]。而随着多重耐药菌株乃至泛耐药菌株的出现,Pa相关感染的治疗难度也越来越大,常规抗生素药物已无法满足目前的治疗需求[3]。因此,开发相关疫苗是预防Pa流行性暴发的有效手段[4]。
外膜囊泡(outer membrane vesicles,OMVs)是Pa在感染过程中分泌释放到外膜的重要成分,具有多种生物学功能,其对于Pa的定植以及生存至关重要[5]。既往研究表明,脑膜炎奈瑟菌、幽门螺杆菌、肺炎克雷伯菌等多种革兰氏阴性菌的OMVs均具有较强的免疫原性,能够在动物感染模型中提供保护性免疫[6-8]。最新研究证实Pa-OMVs也具有上述作用[9]。尽管如此,Pa-OMVs作为免疫抗原仍然存在效力较弱、持续时间较短等问题。因此,寻找合适的疫苗佐剂来增强OMVs的免疫效果十分必要。本研究通过明确IL-2、IL-33佐剂对Pa-OMVs抗感染免疫保护作用的影响,以期为Pa临床疫苗的开发提供新的思路。
1 材料与方法
1.1材料 铜绿假单胞菌标准株(ATCC-27853)购自美国ATCC公司;IL-2、IL-33佐剂购自BD Pharmingen公司;6~8周雌性BALB/c小鼠购自湖南斯莱克景达有限公司(SCXK湘2016-0002);Goat anti-mouse IgG、IgG1、IgG2a、IgA二抗购自Proteintech公司;Mouse IFN-γ、IL-2、IL-4、IL-6、IL-12 ELISA试剂盒购自Invitrogen公司;Mouse CD4、CD8 蛋白ELISA试剂盒购自武汉塞培生物科技有限公司;CCK-8试剂盒购自北京碧云天生物技术有限公司;细胞培养试剂、耗材均购自上海生物工程股份有限公司。
1.2方法
1.2.1OMVs提取与纯化 Pa中加入LB培养基并于37℃振荡培养。依据参考文献[9]提取OMVs。具体操作如下:收取Pa进行超声破碎,破碎后10 000 r/min离心20 min,用0.22 μm滤网过滤上清,超滤收集OMVs。BCA法测定OMVs浓度后于-80℃保存。
1.2.2小鼠分组与免疫接种 90只6~8周雌性BALB/c小鼠随机分为5组:OMVs-IL-2组、OMVs-IL-33组、OMVs组及IL-2、IL-33对照组。将提取的OMVs(1 mg/ml)与IL-2、IL-33佐剂等量混合后皮下注射免疫小鼠3次(50 μl/只),阴性对照组分别通过皮下注射给予50 μl IL-2以及IL-33,间隔2周。末次免疫2周后取小鼠血清,无菌条件下取小鼠脾细胞制成细胞悬液待用。
1.2.3血清抗体检测 采用ELISA法检测血清抗体水平。将OMVs用包被液稀释后加入96孔板中,0.4 μg/孔,4℃包被过夜。收集上述小鼠血清按1∶1 000稀释后作为一抗加入96孔板中室温孵育2 h。随后将HRP连接的羊抗鼠IgG、IgG1、IgG2a、IgA稀释后加入96孔板,37℃孵育1 h。酶标仪于450 nm处测定各孔OD值,每次实验重复3次。
1.2.4CCK-8法检测细胞增殖水平 将上述收集的小鼠脾细胞制成细胞悬液后以2×103个/孔接种于96孔板中,每只小鼠设置3个复孔。用10 μg OMVs刺激细胞同时以10 μg ConA刺激细胞作为阳性对照,继续培养48 h后每孔加入CCK-8溶液10 μl。继续培养2 h后于酶标仪450 nm处测定各组OD值。刺激指数(SI)=(刺激组OD值-空白组OD值)/(未刺激组OD值-空白组OD值)。
1.2.5ELISA检测细胞因子及CD4、CD8蛋白水平 将上述收集的小鼠脾细胞制成细胞悬液后以1×106个/ml加入24孔板,1 ml/孔。并在每孔细胞中加入20 μg OMVs进行刺激。继续培养48 h后收集细胞上清,并按照Mouse IFN-γ、IL-2、IL-4、IL-6、CD4、CD8 ELISA试剂盒说明书要求检测各细胞因子以及CD4、CD8蛋白水平。
1.2.6菌体载量以及组织学分析 末次免疫2周后,Pa菌标准株滴鼻感染小鼠(4×106CFU/只),并记录各组小鼠感染后10 d内的死亡情况并计算死亡率。随后于感染后10 d处死小鼠,并取小鼠肺组织进行细菌培养:加入无菌PBS将肺组织研磨成匀浆,1∶10稀释后涂于LB平板中,37℃恒温培养24 h后菌落计数。同时取肺组织进行HE染色:将收集的肺组织用10%福尔马林固定,石蜡包埋,切片后进行HE染色分析。

2 结果
2.1小鼠血清IgA与IgG及其亚类水平 ELISA结果显示,末次免疫2周后OMVs组血清IgG、IgA水平显著高于对照组(P<0.05),且OMVs-IL-33与OMVs-IL-2组明显高于单独OMVs组(P<0.05),但单独的分子佐剂并不能促进机体产生特异性抗体(图1A)。此外,IL-33与IL-2佐剂(OMVs-IL-33、OMVs-IL-2组)同样能够有效提升OMVs产生的血清IgG1、IgG2a水平,且各实验组中IgG2a/IgG1均>1(图1B)。

图1 免疫小鼠血清IgG、IgA以及IgG亚类水平Fig.1 Levels of serum IgG,IgA and IgG subclass in immunized mice
2.2淋巴细胞增殖水平 CCK-8结果显示,末次免疫2周后,加入IL-33与IL-2佐剂的OMVs组脾细胞SI明显高于单独OMVs组及对照组(P<0.05),且与ConA阳性对照组差异无统计学意义。见图2。
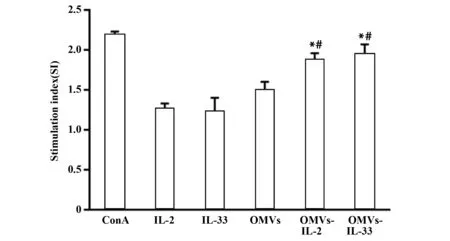
图2 免疫小鼠脾淋巴细胞增殖水平Fig.2 Level of lymphocyte proliferation in immunized mice
2.3细胞因子检测 如图3A所示,OMVs-IL-2、OMVs-IL-33组小鼠脾细胞中IFN-γ以及IL-2水平均显著高于OMVs组与对照组(P<0.05),但脾细胞上清中Th2型细胞因子IL-4、IL-6在各组中差异无统计学意义(图3B)。此外,添加IL-33与IL-2佐剂同样能够提高细胞上清中IL-12水平(图3C)。

图3 ELISA检测免疫小鼠脾细胞上清细胞因子水平Fig.3 Levels of cytokines in spleen cell supernatant of immunized mice detottod by ELISA
2.4CD4、CD8 蛋白水平检测 进一步检测免疫小鼠脾细胞上清中CD4、CD8蛋白水平,结果如图4所示,加入IL-33与IL-2佐剂的免疫小鼠脾细胞上清中CD4 蛋白水平显著高于对照组(P<0.05,图4A)。此外,OMVs-IL-2 以及 OMVs-IL-33组小鼠CD8蛋白水平显著高于对照组(P<0.05,图4B)。
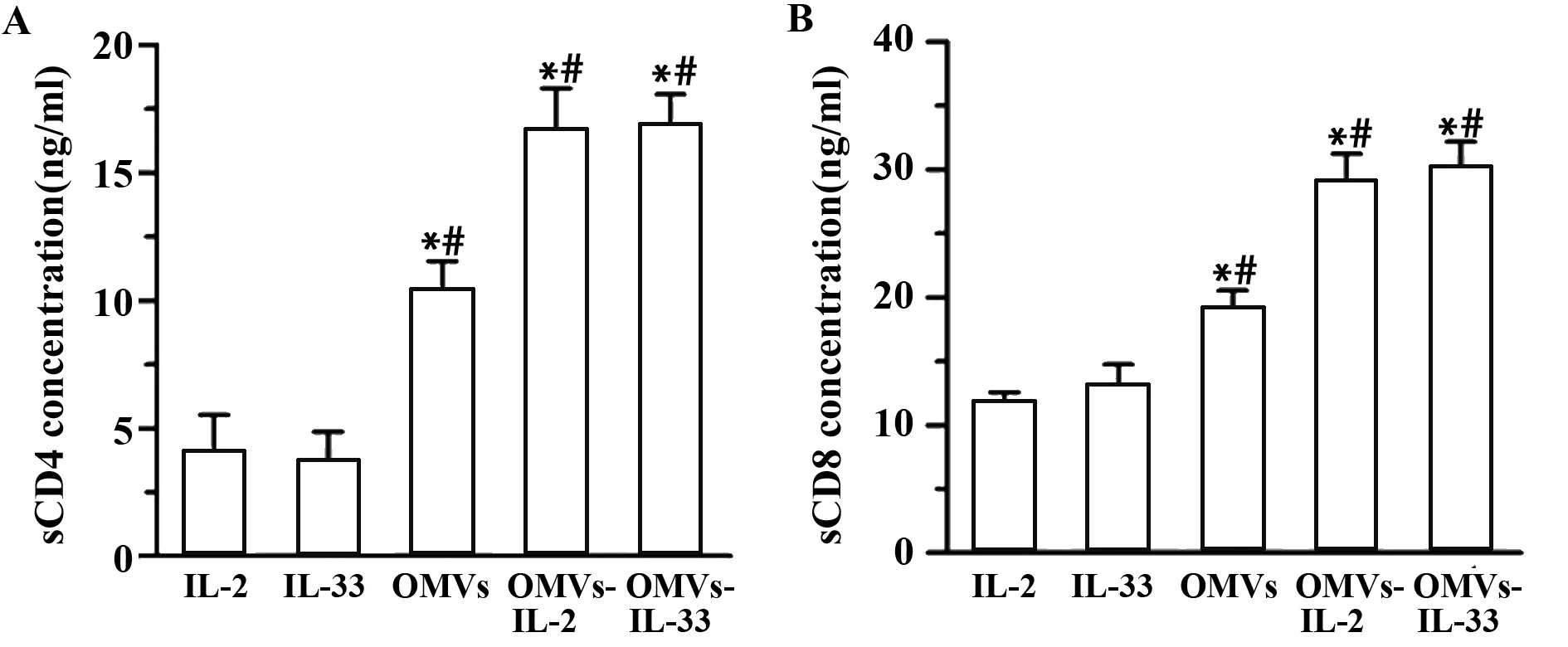
图4 ELISA检测免疫小鼠脾细胞上清CD4、CD8蛋白水平Fig.4 Levels of CD4 and CD8 proteins in supernatant of immunized mice detected by ELISA
2.5抗感染保护作用 检测Pa感染后小鼠的死亡率以及肺组织菌体载量,结果显示,应用IL-33与IL-2佐剂的实验组小鼠死亡率以及肺组织菌体载量(图5A、表1)均显著低于单纯OMVs组与对照组(P<0.05)。此外,OMVs-IL-33与OMVs-IL-2组的小鼠肺组织病理侵润程度也显著轻于对照组(图5B)。表明分子佐剂能够显著增强OMVs的抗感染保护作用。

表1 各免疫组小鼠Pa攻击后死亡率Tab.1 Mortality of immunized mice after Pa attack

图5 Pa感染小鼠肺组织菌体载量及病理侵润情况Fig.5 Bacterial load and pathological invasion of lung tissues in Pa infected mice
3 讨论
目前临床Pa感染治疗以抗生素为主,但由于Pa存在天然耐药性,且耐药机制较为复杂,使得有效的抗生素越来越少,治疗难度也越来越大[3,10]。因此,迫切需要新的替代治疗策略,而抗感染疫苗就是预防控制Pa感染的有效手段[11]。OMVs是Pa在感染宿主过程分泌的毒力因子,参与调节Pa的应激反应,并促进宿主免疫应答,是一种重要的生物成分。而最新研究表明,Pa-OMVs能够在小鼠体内诱导产生较强的体液以及细胞免疫反应,进而有效减轻Pa感染引起的损伤[9]。因此,以Pa自身成分OMVs为免疫抗原设计相关疫苗将更具优势[12]。本研究通过应用IL-2、IL-33佐剂增强Pa-OMVs的抗感染保护效果,以期为加速Pa临床疫苗的研制提供理论依据。
IL-2、IL-33是目前应用较为广泛的分子佐剂,其可通过促进T细胞分化发挥免疫增强作用[13]。细胞因子在调节先天性免疫和获得性免疫中均能够发挥重要作用,同时还能够增强疫苗的特异性免疫应答。研究表明,应用IL-2的Pa外膜蛋白OprI能够增加免疫小鼠的血清抗体滴度,并减少感染后的病毒载量[14]。此外,其同样能够增强不可分型流感嗜血杆菌P6蛋白的免疫保护作用[15]。IL-33作为一种新的分子佐剂,能够有效促进抗原诱导的CD8+T细胞免疫应答,并对高剂量致死的脑膜炎病毒产生显著的保护作用[16]。而本研究发现IL-33与IL-2佐剂均能够促进脾细胞上清中可溶性CD4、CD8蛋白的产生,这从某种程度上也间接反映了T细胞介导的免疫应答水平。
细胞因子作为影响细胞免疫应答的重要因素,近年来备受关注。研究表明,不同细胞因子均可促进B细胞分化为浆细胞进而分泌抗体来发挥免疫作用[9]。然而由于不同细胞因子可能会对不同免疫细胞的分化产生不同影响,包括Th1、Th2以及Treg细胞等,因此作为疫苗佐剂可能也会发挥不同的免疫增强作用。这也就可以解释为什么本研究中IL-2、IL-33佐剂只对Th1型应答有增强作用,而不影响Th2型免疫应答。此外,有研究报道Th细胞在一定程度上能够促进B细胞成熟进而增强体液免疫应答,其主要通过信号转导发挥作用。而本研究也证实IL-2、IL-33佐剂在增强Th1型免疫应答的同时,对体液免疫也有一定的增强作用。
呼吸系统作为Pa感染的主要部位,有效减轻感染后呼吸系统的病理损伤是评估疫苗效果重要指标[17,18]。细胞因子作为一种非特异性免疫佐剂,当与抗原一起进入机体时,能够有效增强抗原的免疫效应,进而通过细胞以及体液免疫发挥抗感染保护作用。本研究在检测IL-2、IL-33佐剂对OMVs的免疫增强作用后,进一步明确了其抗感染保护效果。结果表明IL-2与IL-33佐剂均能够更好地发挥OMVs的抗感染作用,并有效减轻感染引起的病理损伤,是潜在的Pa疫苗佐剂。
综上所述,通过检测IL-2与IL-33佐剂对Pa-OMVs免疫效果以及抗感染保护作用的影响,发现IL-2与IL-33佐剂均能够有效增强Pa-OMVs疫苗诱导产生的体液与细胞免疫应答,并显著提高其抗感染保护作用。但因细胞因子佐剂存在稳定性较差等问题,Pa-OMVs疫苗仍需进一步优化。

