Ⅱ型猪细环病毒及Ⅱ型猪圆环病毒双重荧光定量PCR检测方法的建立
刘东旭,闫 满,尹柏双,苗丽娟,李国江
(1.吉林农业科技学院动物科技学院动物医学系,吉林 吉林 132101;2.预防兽医学吉林省重点实验室,吉林 吉林 132101)
细环病毒(Transfusion transmitted virus或Torque teno virus,TTV)是一种无囊膜的闭合环状DNA病毒,属于指环病毒科细项环病毒属。猪细环病毒(Torque teno sus virus,TTSuVs)广泛的流行于多个国家。现已证明,该病毒与仔猪断奶后多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)的发生有关[1]。这使得关于TTSuVs在猪群中的感染情况及潜在的致病性成为研究的热点。而目前对TTSuVs的了解还非常有限,ELISA法和PCR法是目前检测该病毒的主要方法[2]。但由于TTSuVs的基因变异性高,且不同亚型之间存在交叉的抗体,使得这些方法敏感性低、精确定量差及假阳性率高[3]。国内外学者也建立了TTSuV2和PCV2单项荧光定量 PCR 检测方法,可以判定初始模板量,具有敏感度高、特异性强、重复性好,而且用时短,也可自动定量分析的优点[4]。但目前针对TTSuV2和PCV2感染的双重TaqMan荧光定量PCR检测的方法尚未见报道。
为此,本试验建立一种能快速检测TTSuV2,且可同时分析TTSuV2和PCV2的载量与相关疾病关系的检测方法,为进一步探究TTSuV2在猪群中的感染情况及其潜在致病性提供科学依据。
1 材料与方法
1.1 材料
1.1.1 毒株 猪瘟病毒(Swine fever virus,SFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、伪狂犬病病毒(Pseudorabies virus,PRV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、I型猪细环病毒(Torque teno sus viru 1,TTSuV1)、I型猪圆环病毒(Porcine circovirus 1,PCV1)病料及鉴定病料由吉林农业科技学院猪生态养殖及疫病防控中心保存。
1.1.2 主要试剂 质粒DNA提取试剂盒、DNA凝胶回收试剂盒,均购自杭州爱思进生物技术有限公司;病毒基因组提取试剂盒、PCR酶、TaqMan酶、DNA Marker、pMD18-T Simple Vector,均购自TaKaRa公司。
1.1.3 引物和探针 根据GenBank中公布的PCV2(PCV2a:AY754017;PCV2b:HQ202978;PCV2c:AF109398;PCV2d:AY484407)和TTSuV2(TTSuV2a:MG799366;TTSuV2b:GU188046;TTSuV2c:JF694118)序列保守区,分别设计引物及探针(见表1),并由生工生物工程(上海)股份有限公司合成,序列见表1。

表1 扩增引物及探针Table 1 Primers and probes
1.2 方法
1.2.1 标准品的制备 按照病毒基因组提取试剂盒说明书提取PCV2和TTSuV2 基因组,应用所设计的引物分别进行普通PCR扩增。其中PCV2扩增程序为:95 ℃预变性4 min;95 ℃变性2 min,57 ℃退火55 s,72 ℃延伸3 min,共31个循环;最后72 ℃延伸3 min。TTSuV2扩增程序为:95 ℃预变性4 min;95 ℃变性2 min,56 ℃退火55 s,72 ℃延伸3 min,共31个循环;最后72 ℃延伸3 min。回收PCR产物与载体连接进行蓝白斑筛选,挑取白色菌落进行鉴定及测序。并用分光光度计测量DNA浓度和纯度。
1.2.2 双重荧光定量PCR反应体系及反应条件优化 按照矩阵法对双重荧光定量PCR的退火温度和引物及探针浓度进行优化,确定最佳反应体系及条件。双重荧光定量PCR最佳反应体系为:PremixExTaq(2×) 12.5 μL,P1 1.0 μmol/L,P2 1.0 μmol/L,T1 1.0 μmol/L,T2 1.0 μmol/L,P 1.0 μmol/L,T 1.0 μmol/L,DNA 模板3 μL,水补至20 μL。优化后反应条件为:95 ℃预变性30 s;95 ℃变性10 s,55.8 ℃退火30 s,35个循环。
1.2.3 双重荧光定量PCR不交叉反应 将反应分为2组,第1组以PCV2为模板;第2组以TTSuV2为模板,两组体系中同时含有扩增PCV2、TTSuV2的引物和探针。在已优化好的双重荧光定量PCR反应条件下进行扩增。
1.2.4 双重荧光定量PCR特异性试验 使用本试验所优化好的双重荧光定量PCR反应条件及体系,对PEDV、PRRSV、PRV、SFV、PCV1、TTSuV1进行检测,并以2种病毒标准质粒为阳性对照,以确定该方法的特异性。
1.2.5 双重荧光定量PCR敏感性试验 将2种病毒标准质粒分别调整浓度至1×106拷贝/μL,进行连续的10倍梯度稀释,确定所建立检测方法的灵敏性。
1.2.6 双重荧光定量PCR重复性试验 对不同浓度的标准质粒进行批内和批间实时荧光定量PCR的重复性试验,每个样本进行3次重复,对所得的Ct值的平均值、标准差和变异系数进行分析。
1.2.7 双重荧光定量PCR标准曲线的建立 将标准质粒进行连续5个梯度的100倍倍比稀释,分别用优化后的反应体系及反应条件绘制标准曲线。
1.2.8 临床样品的检测 以本试验建立的双重荧光定量PCR检测方法与普通PCR检测方法同步对收集的300份临床样品进行检测。
2 结果
2.1 标准品的制备 以PCV2、TTSuV2特异性引物分别进行PCR扩增,并将扩增结果与克隆载体连接,进行蓝白斑筛选及序列测定(见图1)。测序结果显示,本试验建立的PCV2重组质粒与PCV2(PCV2a:AY754017;PCV2b:HQ202978;PCV2c:AF109398;PCV2d:AY484407)同源性为95%~100%,探针P与各亚型的PCV2同源性为100%。PCV2重组质粒与TTSuV2(TTSuV2a:MG799366;TTSuV2b:GU188046;TTSuV2c:JF694118)同源性为95.9%~7.3%,探针T与各亚型的TTSuV2同源性为100%。

图1 PCV2 与 TTSuV2重组质粒PCR结果Fig.1 PCR results of PCV2 and TTSuV2 recombinant plasmidsM:Marker DL-2 000;1:TTSuV2;2:PCV2
2.2 双重荧光定量PCR不交叉反应 分别以PCV2和TTSuV2重组质粒为模板,进行双重荧光定量PCR。结果显示,PCV2重组质粒在含有TTSuV2引物探针的体系中反应,没有任何扩增曲线;TTSuV2重组质粒在含有PCV2引物探针的体系中反应,没有任何扩增曲线。说明这2套引物探针特异性较好,没有交叉反应。
2.3 双重荧光定量PCR特异性试验 分别以PEDV、PRRSV、PRV、SFV、PCV1、TTSuV1基因组为模板,对双重荧光定量PCR进行特异性鉴定,结果如图2、3所示。结果表明,本试验所建立的双重荧光定量PCR对PCV2及TTSuV2有很好的特异性,与其他猪病毒无交叉反应。

图2 PCV2的特异性扩增曲线Fig.2 Specific amplification curve of PCV2
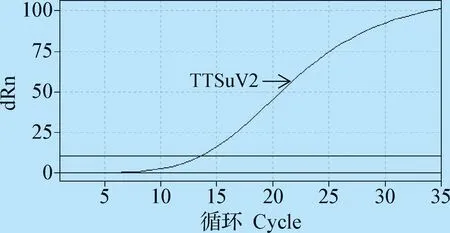
图3 TTSuV2的特异性扩增曲线Fig.3 Specific amplification curve of TTSuV2
2.4 双重荧光定量PCR敏感性试验 以连续稀释的2种病毒标准质粒为模板(1×106~1×101拷贝/μL),进行敏感性试验,结果如图4、5所示。结果表明,建立的双重荧光定量PCR对2种病毒的最低检测拷贝数均为1×102拷贝/μL。

图4 PCV2的敏感度扩增曲线Fig.4 Sensitivity amplification curve of PCV21:1×106拷贝/μL;2:1×105拷贝/μL;3:1×104拷贝/μL;4:1×103拷贝/μL;5:1×102拷贝/μL1:1×106copies/μL;2:1×105 copies/μL3:1×104 copies/μL;4:1×103 copies/μL5:1×102 copies/μL

图5 TTSuV2的敏感度扩增曲线Fig.5 Sensitivity amplification curve of TTSuV21:1×106拷贝/μL;2:1×105拷贝/μL;3:1×104拷贝/μL;4:1×103拷贝/μL;5:1×102拷贝/μL1:1×106 copies/μL;2:1×105 copies/μL;3:1×104 copies/μL;4:1×103 copies/μL;5:1×102 copies/μL
2.5 双重荧光定量PCR重复性试验 对不同浓度的标准质粒进行批内和批间的重复性试验,结果如表2所示。本试验所建立的双重荧光定量PCR批内和批间变异系数均小于2%,具有良好的重复性。
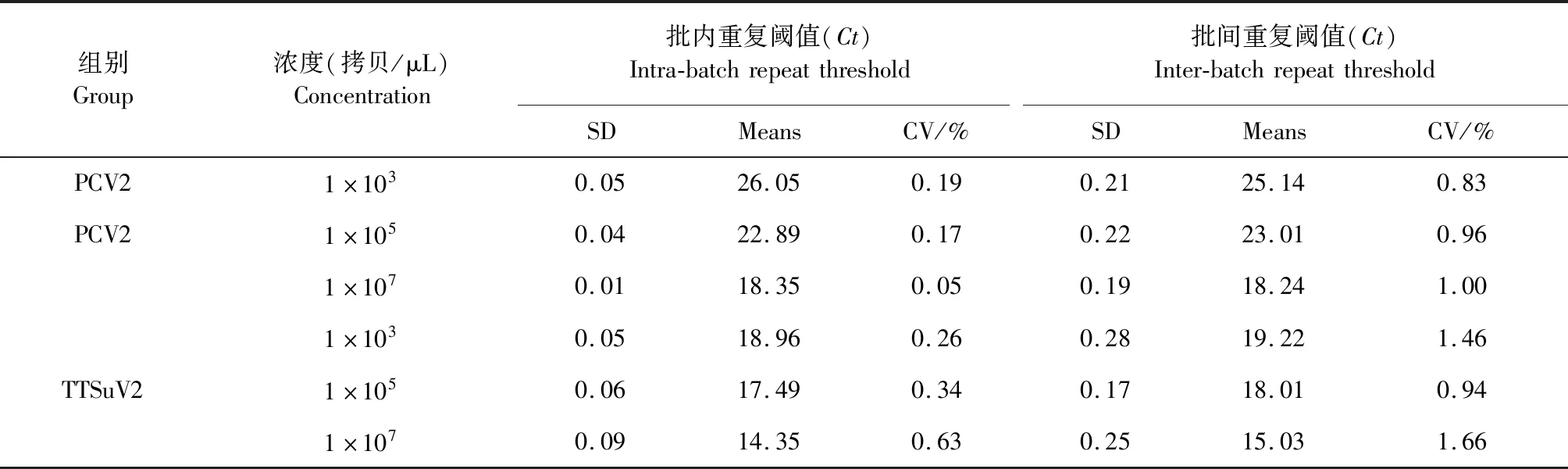
表2 双重荧光定量PCR重复性试验Table 2 Repetitive and stability verification of duplex real-time PCR
2.6 双重荧光定量PCR标准曲线的建立 以1×1011~1×103拷贝/μL标准质粒为模板,绘制双重荧光定量PCR标准曲线。结果如图6所示,PCV2和TTSuV2标准曲线相关系数R2分别为0.999 6、0.998 5,表明所建立的双重荧光定量PCR检测方法具有良好的线性关系。

图6 双重荧光定量PCR标准曲线Fig.6 Standard curve of duplex real-time PCR
2.7 PCV2、TTSuV2双重实时荧光定量PCR检测方法的初步应用 以本试验建立的TTSuV2与PCV2双重荧光定量PCR检测方法与普通PCR检测方法,同时对收集的300份临床样品进行检测。结果如表3所示,在双重荧光定量PCR中,PCV2单独感染检出率为36.0%,TTSuV2单独感染检出率为60.0%,2种病毒混合感染检出率为14.8%。而普通PCR对PCV2单独感染检出率仅为11.3%,TTSuV2单独感染检出率仅为37.3%,2种病毒混合感染检出率仅为3.7%。
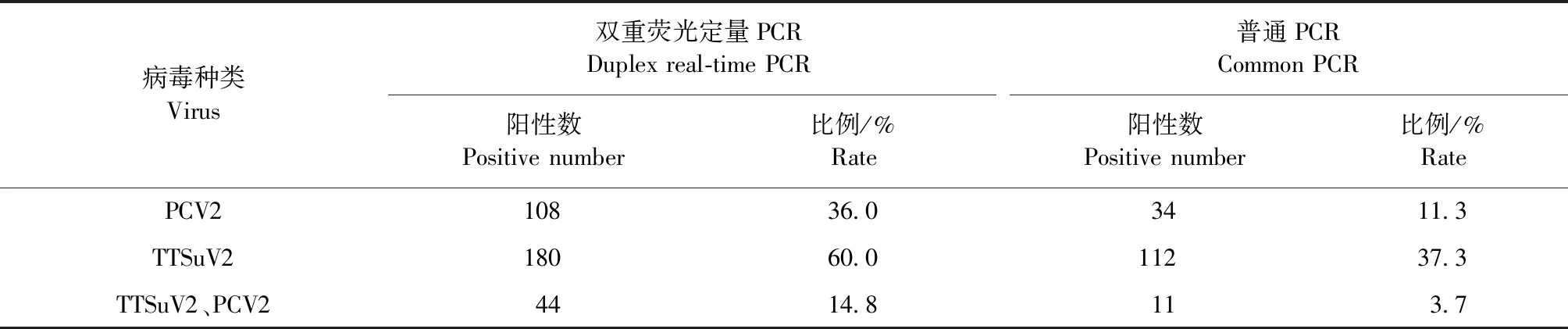
表3 双重荧光定量PCR和普通PCR检测临床样品的结果Table 3 Results of clinical samples detected by duplex real-time PCR and common PCR
3 讨论
临床研究表明,猪群单一感染TTSuV2或PCV2均不会引起明显的临床症状,但猪群混合感染2种病原体时,会促进PMWS的发生。这使得关于TTSuVs在猪群中的感染情况及潜在的致病性成为研究的热点[5]。且TTSuV2的载量与疾病严重程度存在相关性,故对TTSuV2和PCV2进行定量检测具有较高的临床价值。
郑敏等建立的PCV2和PRV双重TaqMan荧光定量PCR方法,对PCV2的检测灵敏度是4.5×102拷贝/μL;Lester J.Pérez 等建立的PCV2、PPV、PRV、TTSuV1、TTSuV2多重SYBR Green I 荧光定量PCR方法,对PCV2和TTSuV2的检测灵敏度是每个反应体系3.65×103~5.05×103拷贝[6]。而本试验建立的方法能检测到的PCV2和TTSuV2基因组最低浓度均为1×102拷贝/μL,比常规PCR和基于SYBR Green I的多重荧光定量PCR更加灵敏。影响实时荧光定量PCR方法的灵敏度涉及许多因素,如样品来源的复杂程度,引物和探针特异性,体系及扩增条件等,其中引物和探针的设计是最重要的关键点。引物的长度,GC含量,退火温度等应尽量一致且避免交叉互补,避免探针和引物间的相互消耗和非特异性扩增[7]。为此本试验分别设计的PCV2、TTSuV2双重荧光定量PCR引物和探针,通过DNASTAR软件分析,确定2个探针,4个引物相互之间不会形成引物二聚体,且探针的退火温度比引物高出10 ℃左右,为构建此方法的准确性在理论上奠定了基础。且在引物和探针设计上,本试验同时分析病毒的多种亚型序列,确保能够检测PCV2及TTSuV2的所有亚型,为临床诊断提供了可靠的检测工具。
目前国内未见有关于运用TaqMan双重探针技术同时检测PCV2及TTSuV2的报道,而本试验建立的TTSuV2与PCV2双重荧光定量PCR检测方法,具有良好的特异性和敏感性,在多种病原体的干扰下,可准确的检测出2种病毒的存在。且在同一体系中,该方法对2种病毒的荧光信号检测不存在相互干扰的现象。应用本试验建立的方法对300份临床样品进行检测,其检出率明显的高于普通PCR方法。但由于实验室仍在进行PMWS病料的收集,不能对TTSuV2与PCV2的载量与相关疾病的关系进行完整的分析,在后续试验中,将加大特定病料的收集,为进一步认识TTSuV2在猪群中的感染情况及其潜在致病性提供科学依据。

