禽腺病毒血清4型TaqMan 荧光定量PCR检测方法的建立与应用
罗洋洋,李群辉,林丽苗,周庆丰
(温氏食品集团股份有限公司 温氏集团研究院,广东 新兴 527400)
禽腺病毒(Fowl aviadenovirus,FAdV)属于腺病毒科、禽腺病毒属的一种无囊膜的双链DNA病毒,核衣核呈20面体对称,病毒颗粒直径为70~90 nm,根据其特异性抗原的不同可分为Ⅰ、Ⅱ群和Ⅲ群[1]。Ⅰ群禽腺病毒根据交叉中和试验分为12个血清型(FAdV1~12),其代表株为鸡胚致死孤儿病毒(Chicken embryo lethal orphan virus,CELOV)[2-3]。I亚群腺病毒呈全球性分布,严重的主要表现为包涵体肝炎(Inclusion body hepatitis,IBH)、心包积水综合征(Hydropericardium syndrome,HPS)、肌胃糜烂和溃疡(Gizzard erosion and lceration,GEU)[4-5]。
近年来,由I亚群血清4型感染导致的心包积水-包涵体肝炎综合征发病较为广泛[6-9],由于其发病迅速、且发病和死亡率均较高,对我国家禽养殖造成了较大影响,因此,快速、准确的诊断能够最大限度的降低养殖场的损失。
本试验利用荧光定量PCR技术,根据FAdV-4的Hexon基因保守序列设计了1对特异性引物和探针,建立了禽血清4型腺病毒的TaqMan实时荧光定量PCR方法,为禽血清4型腺病毒的早期诊断、临床样品的大量检测以及定量分析提供了重要的技术手段。
1 材料与方法
1.1 毒株及临床样品 FAdV-4毒株由本实验室分离鉴定所得。鸡新城疫病毒(Newcastal disease virus,NDV)、禽流感病毒(Avian influenza virus,AIV)、鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)、鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)、鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)、鸡痘病毒(Fowlpox virus,FPV)、血清8a型禽腺病毒(Fowl aviadenovirus 8a,FAdV-8a)、血清8b型禽腺病毒(Fowl aviadenovirus 8b,FAdV-8b),均由广东温氏食品集团股份有限公司养禽事业部生产管理室分离保存。临床样品均采自广东区域及周边疑似发病鸡场。
1.2 主要试剂 RaPure Viral RNA/DNA Kits、HiPure Gel Pure Micro Kit,均购自美基生物公司;Plasmid Mini Kit,购自美国Omega Bio-Tek公司;PrimeSTAR Premix、ExTaqPremix、Loading Buffer、RNA-free water、DNA DL-2 000 Marker、T-Vetor pMD19(Simple)、DH-5α competent cell,均购自宝生物工程(大连)有限公司;TaqManTMFast Advanced Master Mix、Applied Biosystems 7500 Fast Real-Time PCR Systems,均购自Life公司。
1.3 引物和探针的设计 根据NCBI中公布的FAdV-4 的Hexon基因序列的保守区域,设计了1对普通PCR引物和TaqMan荧光定量PCR引物和探针,引物序列及扩增位置见表1。
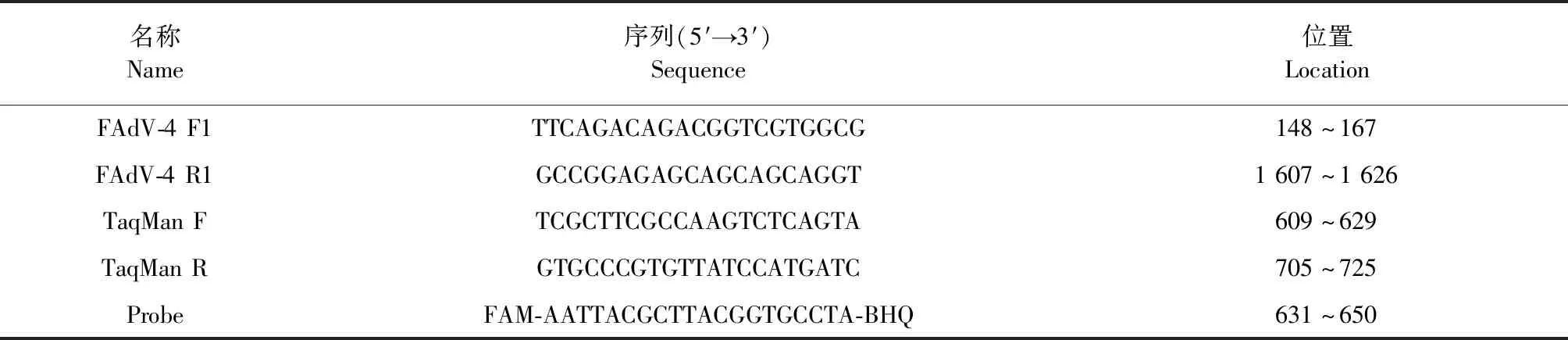
表1 普通PCR和荧光定量PCR引物
1.4 荧光定量标准品的制备 按照美基生物的RaPure Viral RNA/DNA Kits提取病毒的总核酸,用普通PCR引物扩增Hexon基因的保守区目的片段。扩增体系(50 μL):PrimeSTAR Premix 25 μL,Primer F/R 2 μL+2 μL,ddH2O 19 μL,DNA 2 μL;反应条件:98 ℃ 1 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 25 s,30个循环;72 ℃ 5 min,4 ℃保存。将扩增产物克隆至T-Vetor pMD19(Simple)载体上,产物转化到DH-5α 感受态细胞内,涂于LB/Amp/X-Gal/IPTG平板上进行蓝白斑筛选,提取重组质粒,用微量紫外分光光度计测定其浓度,根据拷贝数换算公式:拷贝数/μL=(质粒浓度×10-9×稀释倍数×6.02×1023)/(660道尔顿×碱基数),计算拷贝数。
1.5 FAdV-4 TaqMan 荧光定量PCR反应条件的优化 用构建的标准品质粒作为模板进行反应条件的优化,体系20 μL。分别选择0.1、0.2、0.3、0.4 μmol/L和0.5 μmol/L的引物终浓度,0.1、0.2、0.4、0.6、0.8μmol/L和1.0 μmol/L的探针浓度和56 ℃、57 ℃、58 ℃、59 ℃和60 ℃的退火温度进行TaqMan荧光定量PCR反应,获得最低的Ct值和最高的荧光强度增加量(△Rn)时的反应条件为最佳反应条件。
1.6 标准曲线的建立 将制备的重组质粒标准品进行10倍梯度稀释,选取7.3×108、7.3×107、7.3×106、7.3×105、7.3×104拷贝/μL和7.3×103拷贝/μL 的标准品作为模板,设立阴性对照,重复3次,按照优化的最佳条件进行TaqMan荧光定量PCR反应,获得其标准曲线。
1.7 特异性试验 利用构建的定量PCR方法,对NDV、AIV、IBV、ILT、IBDV、FPV、FAdV-8a、FAdV-8b和FAdV-4进行检测,检验该方法的特异性。
1.8 敏感性试验 以各稀释梯度(7.3×108~7.3×101拷贝/μL)的标准品质粒作为模板进行TaqMan荧光定量PCR和普通PCR检测,确定能检出的最低浓度,比较2种方法的敏感性差异。
1.9 重复性试验 选取标准品中7.3×108、7.3×107、7.3×106、7.3×105、7.3×104拷贝/μL和7.3×103拷贝/μL共6个梯度的样品作为模板,每个样品做3个重复检测,并分别以上述6个稀释梯度的标准品为模板,分3次进行荧光定量PCR检测,根据Ct值计算批内和批间的变异系数,评价该方法的重复性。
1.10 临床样品的检测 从广东省10个养鸡场采取50份FAdV-4疑似发病鸡只的肝脏,提取其核酸,分别进行普通PCR和TaqMan荧光定量PCR检测,计算2种检测方法的阳性率并进行比较。
2 结果
2.1 重组质粒标准品的制备 利用引物FAdV-4 F1/R1对Hexon基因的目的片段进行扩增,将其克隆至T-Vetor pMD19(Simple)载体上,成功构建重组质粒。提取的重组质粒DNA浓度为335 ng/μL,经公式计算其拷贝数为7.3×1010拷贝/μL。
2.2 TaqMan 荧光定量PCR反应条件的优化及标准曲线的建立 经条件优化表明:采用0.2 μmol/L的引物终浓度和0.2 μmol/L的探针终浓度,退火温度选择60 ℃,可使反应获得最低的Ct值和最高的荧光强度增加量(△Rn)。标准品浓度从7.3×103~7.3×108拷贝/μL共6个梯度为扩增模板,得到良好的线性关系。标准曲线方程式为:Ct=-3.681 lgX+42.984,相关系数R2=0.997。
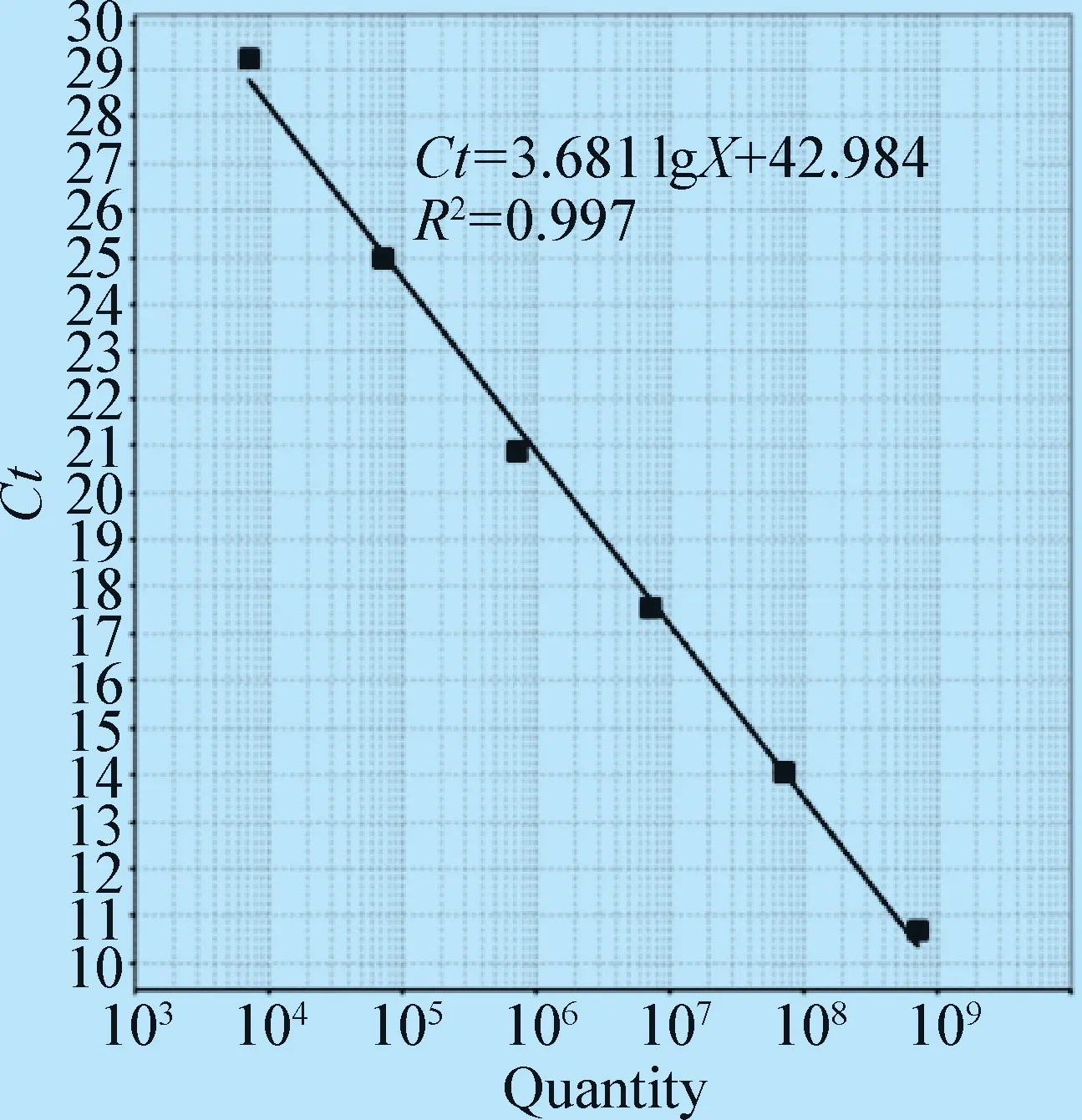
图1 FAdV-4荧光定量PCR标准曲线Fig.1 Standard curve of TaqMan real-time fluorescence quantitative PCR assay for the detection of FAdV-4
2.3 特异性试验 利用构建的荧光定量PCR方法对FAdV-4、NDV、AIV、IBV、IBDV、ILTV、FPV、FAdV-8a和FAdV-8b 进行荧光定量PCR检测。结果显示:只有FAdV-4有明显的扩增曲线,其他8种病毒无明显的荧光信号(图2)。表明该方法特异性良好,同上述病毒无交叉反应。

图2 FAdV-4荧光定量特异性试验Fig.2 Specificity test of TaqMan real-time fluorescence quantitative PCR assayA:FAdV-4;B:AIV、NDV、IBV、IBDV、ILTV、FPV、FAdV-8a、FAdV-8b和阴性对照A:FAdV-4;B:AIV,NDV,IBV,IBDV,ILTV,FPV,FAdV-8a,FAdV-8b and negative control
2.4 敏感性试验 分别以各梯度的标准品为模板进行荧光定量检测,结果显示,最小检出的梯度为7.3×101拷贝/μL(中插彩版图3);再以相同梯度的标准品进行普通PCR检测,结果显示,可检出的最小梯度为7.3×103拷贝/μL(图4)。表明本试验构建的荧光定量PCR方法比普通PCR敏感性提高了100倍。
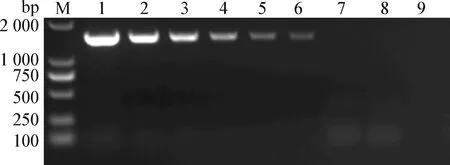
图4 FAdV-4普通PCR敏感性试验Fig.4 Sensitivity test of conventional PCR assayM:DNA Marker;1~8:重组质粒浓度为7.3×108~ 7.3×101拷贝/μL;9:阴性对照M:DNA Marker;1~8:Recombinant plasmid diluted from 7.3×108~ 7.3×101copies/μL;9:Negative control
2.5 重复性试验 对同一批次稀释的5个标准品分别进行批内和批间重复性试验。结果显示,批内和批间试验的标准差均小于0.5,变异系数均小于2%,表明本试验构建的TaqMan荧光定量PCR方法的重复性良好。
2.6 临床样品的检测 对采集的50份疑似发病样品用荧光定量和普通PCR进行检测,结果显示,用本试验构建的TaqMan荧光定量方法检出16份阳性样品,而普通PCR仅检出11份阳性样品,且普通PCR方法同荧光定量的符合率达到100%。由此可见,本试验建立的TaqMan荧光定量PCR具有更高的灵敏度。
3 讨论
2015以来,我国各地陆续暴发了心包积水-包涵体肝炎综合征,该病主要发生于3周龄以上的肉鸡,包括 817、肉杂等品种,自然发病日龄最小的为 7 日龄,发病后4~8 d为死亡高峰,病程为 8~15 d,死亡率20%~80%不等。发病日龄越小,死亡率越高。同时 20~70日龄以及 200~300 日龄的蛋鸡也有发生该病,但死亡率低于肉鸡,后被证实为I亚群血清4型禽腺病毒感染[10-11]。在此之后,多个品种的鸭也分离到了FAdV-4[12-13],给国内的养禽业带来巨大的经济损失。因此,早期快速、准确的诊断成为防控该病的重要环节,在很大程度上能够降低经济损失,所以建立快速、准确、灵敏、稳定的检测方法显得尤为迫切。
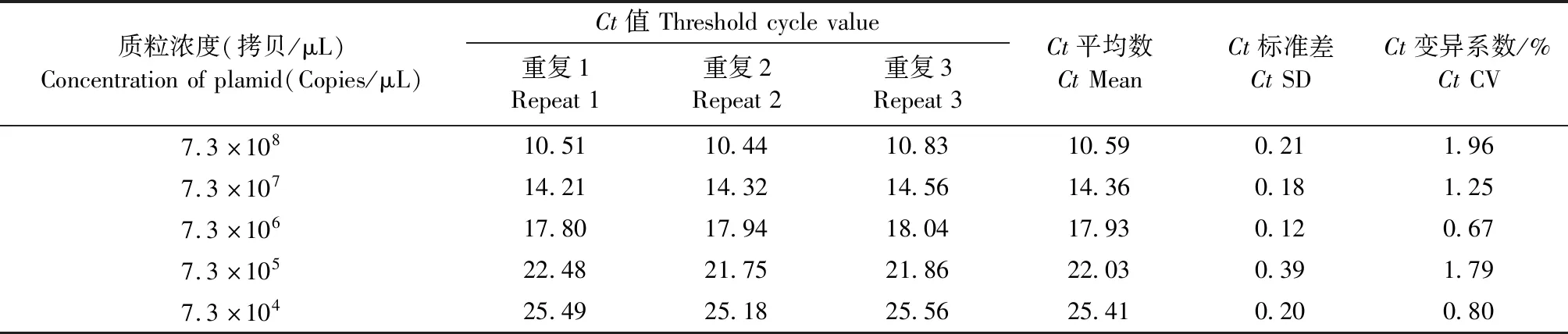
表2 FAdV-4荧光定量批内重复试验

表3 FAdV-4荧光定量批间重复试验
目前对于FAdV-4的检测主要靠传统的PCR方法。众所周知,传统的PCR方法需要经过核酸提取、PCR扩增、琼脂糖凝胶电泳、基因测序等相对繁琐的步骤,且灵敏度相比实时荧光定量PCR方法要低[14]。荧光定量PCR技术发明以来,由于其快速、敏感、特异、实时等一系列优点已被广泛应用于疾病诊断和检测。六邻体(Hexon)是禽腺病毒目前研究最广泛的蛋白,是主要的衣壳蛋白,含有型、群、亚群特异性抗原决定簇[15]。本试验利用荧光定量PCR技术,根据FAdV-4六邻体基因的保守区域设计特异性引物和探针,建立了FAdV-4的TaqMan荧光定量PCR方法。
用建立的TaqMan荧光定量PCR方法对其他家禽常见病原进行特异性验证,结果显示,无其他非特异性扩增曲线;灵敏性试验显示,该方法可检出的最小病毒浓度为7.3×101拷贝/μL,是普通PCR灵敏度的100倍;批内和批间重复性试验的变异系数均小于2%,表明该方法具有良好的特异性、灵敏性和重复性。除此之外,TaqMan荧光定量PCR方法无需通过电泳即可得出结果,既能缩短临床样品检测的时间,也可避免操作繁琐而造成的样品污染,同时降低了操作人员接触有毒物质的风险。

