电针对APP/PS1小鼠皮质区磷脂酰肌醇-3激酶/糖原合成酶激酶-3α通路相关蛋白表达和老年斑沉积的影响
伍艳君 ,邬开会,刘茜,王依滢,邱国平,徐进,盛华均,朱淑娟
1.重庆医科大学神经科学研究中心,重庆医科大学人体解剖学教研室,重庆市 400016;2.重庆市南川区人民医院,重庆市408400
阿尔茨海默病(Alzheimer's disease,AD)是最常见的与年龄相关的神经退行性疾病,慢性进行性加重,主要病理特点包括由β 淀粉样蛋白肽(Amyloid beta peptide,Aβ)沉积形成的细胞外老年斑、过度磷酸化的Tau 蛋白形成的神经原纤维缠结,以及大量神经元丢失[1]。淀粉样蛋白级联假说认为,Aβ 沉积是多因素发病机制中的初始事件,可引发一系列导致痴呆的事件[2‑3]。AD 的发生发展也与大脑葡萄糖利用和能量代谢损伤有关[4‑6]。因AD 有胰岛素生成减少和胰岛素受体抵抗现象,也被称为“3 型糖尿病”[7‑9]。在胰岛素抵抗机制中,磷脂酰肌醇‑3 激酶(phosphatidylinositol‑3 kinase,PI3K)、糖原合成酶激酶‑3α(glycogen synthe‑sis kinase‑3α,GSK3α)作为PI3K/GSK3α 信号转导途径中的重要蛋白,与Aβ的代谢关系密切[10‑11]。
本研究以AD 模型APP/PS1双转基因小鼠为对象,观察电针对APP/PS1 小鼠皮质内老年斑和PI3K/GSK3α相关蛋白表达的影响,探讨电针对小鼠皮质内胰岛素信号通路的调节。
1 材料与方法
1.1 实验动物与分组
健康同窝3 月龄等体质量雄性野生型C57 小鼠6只为对照组;同月龄等体质量健康雄性APP/PS1 双转基因小鼠随机数字表法分为模型组和电针组,每组各6 只,体质量24~28 g。小鼠购于北京华阜康生物科技股份有限公司,动物合格证号SCXK(京)2014‑004。
小鼠饲养于重庆医科大学动物实验中心SPF 级动物房,饲养温度(22±2)℃,相对湿度40%~60%,光照和黑暗周期各12 h,自由饮食。适应性喂养2周左右,剪取鼠尾3~5 mm,碱裂解法提取小鼠DNA,聚合酶链反应(polymerase chain reaction,PCR)扩增,检测APPswe和PSΔE9基因表达。琼脂糖凝胶电泳,拍照并分析结果,具有APP、PS1 双阳性条带的样本来源于APP/PS1 双转基因小鼠,两条带均为阴性的样本来自野生型C57小鼠。
本实验所有操作均符合重庆医科大学动物实验伦理标准。
1.2 主要试剂
4G8一抗(SIG‑39220‑200):美国COVANCE公司。GSK3α 一 抗(ab131344):美国ABCAM公司。pS21‑GSK3α 一 抗(9316S):美国CELL SIGNALING 公司。P85α 一抗(AF5112)、P110α 一抗(AF5112):美国AFFINITY 公司。GAPDH 一抗(10494‑1‑AP):重庆鼎国生物科技有限责任公司。HRP 标记羊抗兔IgG 抗体(L153A):重庆莱博斯生物科技有限公司。电针仪:汕头市医用设备有限公司。电泳仪、电转仪和凝胶成像仪:美国伯乐公司。石蜡切片机:德国莱卡公司。PCR 仪:美国赛默飞公司。无菌针灸针:北京中研太和医疗器械有限公司。
1.3 方法
鉴定后,电针组0.3%戊巴比妥钠30 mg/kg 腹腔注射麻醉,一次性针灸针(直径0.18 mm、长25 mm)针刺小鼠百会(向前斜刺2 mm)和两侧肾俞(向内斜刺4 mm),穴位定位参照《实验针灸学》动物穴位图谱。电针仪一对正负极分别接百会和一侧肾俞,另一对正负极接另一侧肾俞和同侧用纱布浸湿的皮肤,电针频率2 Hz,电流2 mA,每次15 min,每天1 次,7 d 为1个疗程,共计2个疗程,疗程期间休息1 d。电针时间和操作人员固定。
对照组和模型组在相同的时间抓取和麻醉,不针刺。
1.4 标本采集
干预结束后,小鼠0.3%戊巴比妥钠30 mg/kg 腹腔注射麻醉,0.9%氯化钠溶液心尖快速灌注约40 ml。断头,完整取出鼠脑,剥离脑组织。一侧皮质-80 ℃冰箱冻存,用于Western blotting 检测;另一侧4%多聚甲醛固定,石蜡切片,用于免疫组化染色。
1.5 免疫组化染色
镜下选取组织切片,二甲苯Ⅰ中65 ℃烤箱内脱蜡1 h,二甲苯Ⅱ中常温脱蜡3 min。100%、95%、80%和75%梯度酒精水化各5 min;0.01 mol/L PBS 水洗3次,每次5 min。滴加3%过氧化物酶,37 ℃水浴孵育15 min。0.01 mol/L PBS 水洗3 次,每次5 min;95 ℃水浴修复,自然冷却到室温。0.01 mol/L PBS 水洗3次,每次5 min,滴加88%甲酸常温孵育10 min(仅染老年斑需要)。0.01 mol/L PBS 水洗3 次,每次5 min,滴加5% BSA,37 ℃水浴封闭。滴加老年斑(4G8,1∶250)、P85α(1∶200)、P110α(1∶50)、GSK3α(1∶50)和pS21‑GSK3α (1∶100)一抗,4 ℃冰箱中过夜。37 ℃水浴复温40 min。0.01 mol/L PBS 水洗4 次,每次5 min;滴加二抗,37 ℃水浴孵育30 min。0.01 mol/L PBS 水洗4 次,每次5 min;滴加SABC 信号放大剂,37 ℃水浴孵育。0.01 mol/L PBS 水洗4 次,每次5 min。DAB 染色,苏木素染核(仅染老年斑需要),镜下观察结果。70%~100%梯度酒精脱水,二甲苯I、Ⅱ透明,各5 min。中性树脂封片,常温晾干,光学显微镜下观察皮质内老年斑、P85α、P110α、GSK3α 和pS21‑GSK3α 的分布,并拍照,保持光照强度及放大倍数一致。随机取6 个区域,Image J 8.0 图像分析系统测量平均积分光密度。
1.6 Western blotting
提取蛋白,加入蛋白裂解液研磨,4 ℃、12 000 r/min离心10 min,共2次,吸取上清,BCA 法测蛋白浓度。取总蛋白50 µg 上样,8% SDS‑聚丙烯酰胺凝胶电泳分离,250 mA 恒流电转至PVDF 膜;5%脱脂奶粉常温封闭2 h,加入P85α (1∶1000)、P110α (1∶1000)、GSK3α (1∶1000)和pS21‑GSK3α (1∶1000)一抗,4 ℃冰箱敷育过夜。PBST 洗膜3 次,每次10 min;滴加相应二抗(1∶10000),37 ℃恒温摇床孵育1 h,PBST 洗膜4 次,每次15 min;ECL 显色,凝胶成像系统观察。以GAPDH 为内参,计算分析蛋白条带相对光密度值。
1.7 统计学分析
采用Image J 8.0、Graphpad Prism 5软件对数据进行分析,各实验独立重复6 次。计量资料以()表示,多组间比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 免疫组化染色
对照组皮质区无4G8 阳性斑块,模型组和电针组小鼠皮质区均可见4G8 阳性斑块。与模型组相比,电针组4G8 阳性斑块显著减少(P<0.001)。见图1、表1。

图1 各组皮质区老年斑(免疫组化染色,×200)
GSK3α和pS21‑GSK3α主要在神经元胞质表达。模型组GSK3α 蛋白水平较对照组和电针组均显著升高(P<0.001);pS21‑GSK3α 蛋白水平较对照组和电针组降低(P<0.001)。见图2、图3、表1。
P85α 和P110α 均存在于神经元胞质内。模型组P85α 和P110α较对照组和电针组均明显降低(P<0.01)。见图4、图5、表1。
2.2 Western blotting
模型组pS21‑GSK3α 蛋白表达明显低于对照组和电针组(P<0.01),GSK3α蛋白表达高于对照组和电针组(P<0.05);P85α 和P110α 蛋白表达明显低于对照组和电针组(P<0.01)。见图6、表2。

图2 各组皮质区GSK3α表达(免疫组化染色,×200)
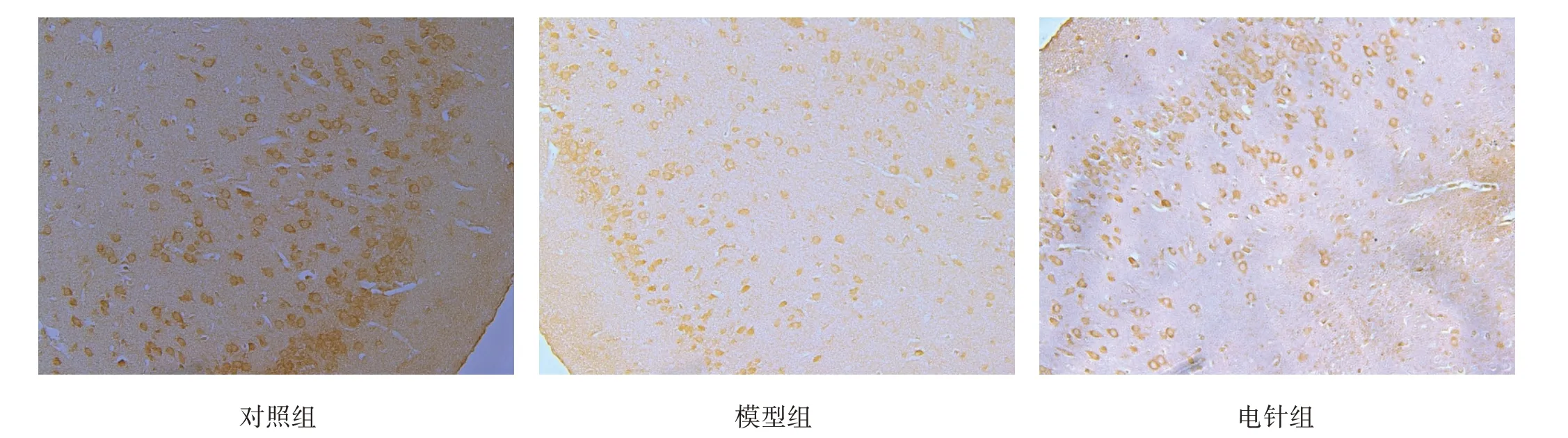
图3 各组皮质区pS21-GSK3α表达(免疫组化染色,×200)

图4 各组皮质区P85α表达(免疫组化染色,×200)
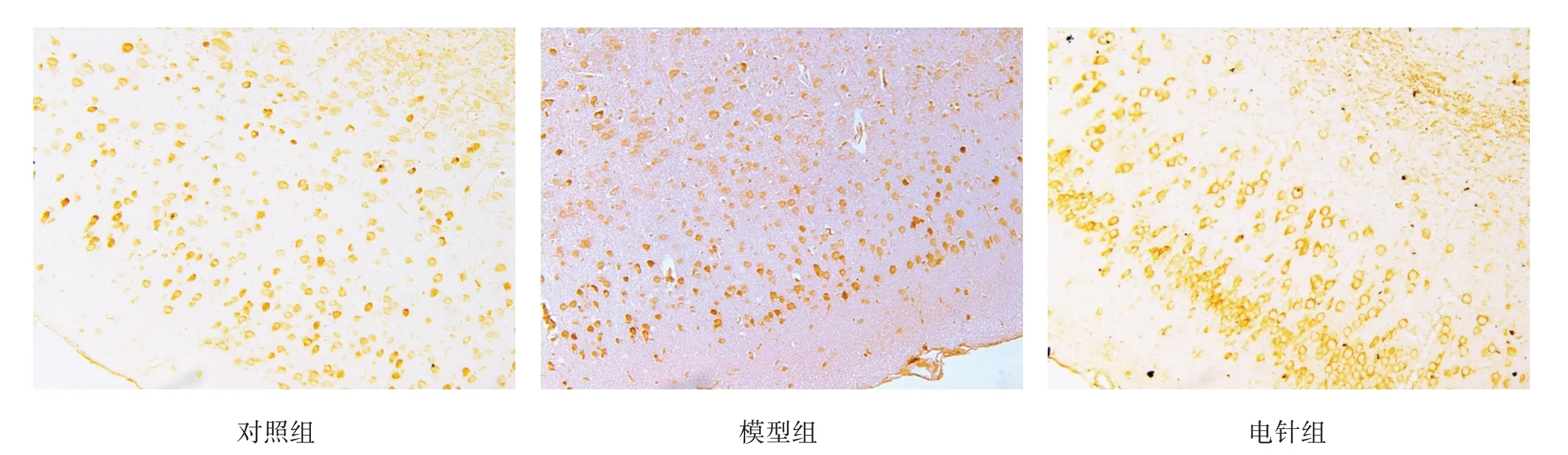
图5 各组皮质区P110α表达(免疫组化染色,×200)

表1 免疫组化染色各组皮质区老年斑、GSK3α、pS21-GSK3α、P110α和P85α蛋白水平(IOD/AREA)

表2 Western blotting检测各组GSK3α、pS21-GSK3α、P110α、P85α蛋白表达水平(/GAPDH)
3 讨论
脑内胰岛素既可由外周胰岛β 细胞、胃抑制多肽细胞等分泌,穿过血脑屏障进入中枢神经系统,也可由脑内胶质细胞和神经元合成。胰岛素与胰岛素受体结合后,激活胰岛素信号转导通路,在神经调节、神经内分泌和代谢,以及学习记忆等方面发挥重要调节作用。胰岛素受体在大脑皮层、海马、嗅球、下丘脑等部位广泛分布,特别是在神经元和突触后[12]。胰岛素信号通路破坏会使神经元出现代谢损伤,与认知功能下降关联,逐渐发展为AD[13]。胰岛素信号通路对胰岛素不敏感时,出现代偿性的高胰岛素血症,即胰岛素抵抗。胰岛素缺乏或胰岛素抵抗与异常的能量代谢密切相关[4,14‑15]。研究表明[16],脑内出现胰岛素抵抗是AD 发生的前兆,胰岛素信号通路紊乱可能参与其发生机制,并最终与Aβ 相互影响,形成恶性循环。APP/PS1 双转基因小鼠在2 月龄时即可表现出葡萄糖耐量降低,早于AD病理学和认知下降[17‑18]。推测胰岛素信号通路受损可能加速AD病理进程[19‑20]。

图6 各组pS21-GSK3α、GSK3α、P110α和P85α蛋白表达(Western blotting)
PI3K‑Akt 信号通路是胰岛素信号的经典通路。PI3K 有4 种亚型,即1A、1B、2 和3。对胰岛素跨膜转导起作用的是1A,它由P85(调节亚基)和P110 (催化亚基)两个亚基组成。P85 主要与胰岛素受体底物结合,P110通过磷酸化细胞膜上的磷脂酰肌醇(phospha‑tidylinositol,PI),使胞内合成PIP、PIP2或PIP3,扮演胰岛素跨膜信号传导第二信使的角色,募集丝氨酸/苏氨酸蛋白激酶(serine‑threonine kinase,Akt,又称PKB)到细胞膜并磷酸化,激活并调节下游分子。P85 对P110 的稳定、聚集以及对1A 型PI3K 的激活尤为必需。P85α 作为1A 型PI3K 表达最多的亚基,是PI3K‑Akt 通路激活的始动环节。AD 患者尸检发现,脑内P85α 和P110α 水平降低,阻断胰岛素信号通路,与胰岛素抵抗一致[21]。
受损的PI3K‑Akt信号通路失去正常调节能力,导致下游激酶分子GSK3 活性失调。GSK3 有GSK3α 和GSK3β 两个亚型,其中GSK3α 与Aβ 的关系更为密切[22]。在Tg2576 小鼠中,GSK3α 活性增强,上调γ 分泌酶活性,促进Aβ生成,加速老年斑沉积[23]。
针灸是中医治疗“痴呆”的重要手段,能有效改善AD 发生发展过程中的一些病理生理机制,如抑制氧化应激、调节神经递质和兴奋性氨基酸的释放、提高神经营养因子含量等[24‑26]。
研究发现[27],针刺治疗可有效改善胰岛素抵抗,但作用机制未明。本研究显示,电针可升高APP/PS1双转基因小鼠皮质内P85α、P110α 和pS21‑GSK3α 等蛋白的表达水平,降低过度增加的GSK3α蛋白表达,并减少皮质内老年斑。我们先前的研究发现[28],相同的电针刺激能够提高APP/PS1 双转基因小鼠的学习、记忆和空间探索能力,并调节皮质区β‑分泌酶1 (β‑se‑creting enzyme,BACE1)、胰岛素降解酶(insulin‑de‑grading enzyme,IDE)等的表达。综合分析认为,电针可通过调节P85α、P110α及下游pS21‑GSK3α、GSK3α、BACE1 和IDE 等蛋白的表达水平,影响Aβ形成,从而改善脑内胰岛素抵抗、老年斑沉积和认知减退。
另外,本研究显示,GSK3α和pS21‑GSK3α蛋白主要表达于神经元胞质内,模型组GSK3α 表达增多而pS21‑GSK3α 表达减少。有研究显示[29],激活GSK3 能增强Tau 蛋白磷酸化,而胰岛素能通过PI3K‑Akt 信号通路抑制GSK3,降低Tau 蛋白磷酸化。本研究未涉及电针对Tau 蛋白磷酸化水平的影响,有待进一步研究。
综上所述,电针能针对AD 病理生理机制,发挥多方位调节作用。研究电针多方位调节作用的扳机点,将是以后的重要研究方向之一。
利益冲突声明:所有作者声明不存在利益冲突。

