人内皮型一氧化氮合酶结构和功能的生物信息学分析▲
郑 洋 王佳慧 汪 磊 梁天坚 赵铁建,2 李成林
(广西中医药大学1 赛恩斯新医药学院医学系,2 基础医学院生理教研室,南宁市 530222,电子邮箱:1793853705@qq.com)
内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)可以调控体内一氧化氮(nitric oxide,NO)的生成,而NO是调控血管舒张功能最重要的因素[1]。NO是在一氧化氮合酶催化下,L-精氨酸转化为L-瓜氨酸时产生。血管内皮细胞合成NO后扩散至血管平滑肌细胞,激活该细胞上的鸟苷酸环化酶,催化三磷酸鸟苷产生环磷酸鸟苷(cyclic guanosine monophosphate,cGMP),介导平滑肌舒张,从而导致血管舒张,这一分子信号传导路径被称为eNOS-NO-cGMP通路[2]。有研究表明,eNOS-NO-cGMP通路在肝窦内皮细胞窗口的形成过程中发挥十分重要的作用,而核因子κB信号通路可以通过调控eNOS基因的转录来控制NO的生成,说明eNOS基因在eNOS-NO-cGMP通路上具有关键作用[3-6]。本课题组一直致力于研究广西道地药材莪术抗肝纤维化的作用机制,已经发现莪术主要活性成分莪术醇对肝窦内皮细胞的窗口和基底膜有影响[7],但是具体的作用机制仍不清楚。本研究利用生物信息学方法深入分析eNOS基因及其所编码的蛋白质,为研究莪术与肝窦内皮细胞作用关系提供生物信息学方面的理论支持。
1 资料和方法
1.1 数据来源 在NCBI数据库的GenBank(https://www.ncbi.nlm.nih.gov/)中获取eNOS基因的核酸序列,在UniProt蛋白质数据库(https://www.uniprot.org/)中获取eNOS蛋白的氨基酸序列。
1.2 分析方法 (1)用BDGP(http://www.fruitfly.org/)和TFDB在线数据库(http://bioinfo.life.hust.edu.cn/AnimalTFDB/)进行启动子和转录因子的预测,前者是基于神经网络和遗传算法的在线数据库,用于模拟转录因子与启动子区域序列的相互作用。(2)用ProtParam在线工具(https://web.expasy.org/protparam/)分析eNOS基因所编码蛋白的理化性质;用ProtScale在线软件(https://web.expasy.org/protscale/) 分析蛋白质的亲水性和疏水性。(3)用SignalP 4.1软件来预测蛋白质的信号肽,通过对目的肽链前70个氨基酸间潜在酶切位点的预测来判断是否存在信号肽。设置临界值为0.450,预测C分值、Y分值、S分值,其中S的平均值可以用来判断是否为分泌蛋白(S>0.5则判断为分泌蛋白并且有信号肽),Y的最大值用来判断信号肽的剪切位点[8]。(4)用TMHMM软件[9]来分析蛋白质的跨膜结构,只有位于膜外区域的氨基酸序列才有可能作为抗原的表位,而其他两个区域的氨基酸序列一般不会作为抗原表位[10]。(5)用SOPMA数据库(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质二级结构;用SWISS-MODEL数据库(https://swissmodel.expasy.org/)来预测蛋白质的三级结构。(6)在真核细胞中,蛋白质被基因翻译后还要进行加工才能发挥其功能,比较常见的加工方式有磷酸化和糖基化等,这种加工对于蛋白质发挥功能具有十分重要的意义,因此应用NetNGlyc1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)和NetOGlyc4.0 Server在线软件(http://www.cbs.dtu.dk/services/NetOGlyc/)分别对蛋白质N-糖基化和O-糖基化位点进行分析;由于蛋白质的磷酸化修饰对于信号传导具有十分重要的意义,因此应用NetPhos2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)对蛋白质磷酸化位点进行分析。(7)用STRING数据库(https://string-db.org/cgi/input.pl)预测蛋白质的相互作用。(8)用BLAST数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对eNOS基因进行同源性分析。
2 结 果
2.1 eNOS基因的启动子和转录因子预测结果 在NCBI数据库中检索eNOS基因,发现其位于7q36.1区,含有28个外显子。用BDGP在线数据库来预测启动子区域,设置Score为0.9,预测得到的启动子见表1。选取评分最高的一段启动子用TFDB数据库进行转录因子预测,评分较高的前10位转录因子见表2。

表1 eNOS基因启动子预测结果

表2 评分最高启动子结合的转录因子
2.2 eNOS基因编码蛋白质的理化性质 通过UniProt数据库获得eNOS基因编码蛋白质的氨基酸序列,然后将其输入到ProtParam数据库中,对其理化性质进行预测。eNOS蛋白质分子量为133 274.78,蛋白质的总分子式为C5930H9269N1677O1734S46,总原子数为18 656,含有1 203个氨基酸残基。其中,带正电荷的氨基酸残基精氨酸(Arg)和赖氨酸(Lys)占10.47%(126/1 203);带负电荷的氨基酸残基天冬氨酸(Asp)和谷氨酸(Glu)占10.64%(128/1 203)。理论上等电点=6.94,说明eNOS蛋白偏中性。氨基酸组成中亮氨酸(Leu)含量最高,达到10.6%。eNOS蛋白的不稳定指标达到了53.49,属于不稳定的蛋白质。eNOS蛋白的脂肪指标为79.48。再依托ProtScale软件检测该蛋白质的亲水和疏水性,采用Hphob./Kyte&Doolittle算法,结果显示eNOS蛋白最大的疏水性分值为2.311,亲水性最小的分值为-3.444,eNOS蛋白疏水性的氨基酸分值小于亲水性的氨基酸(见图1),因此eNOS蛋白总体上属于亲水性蛋白。
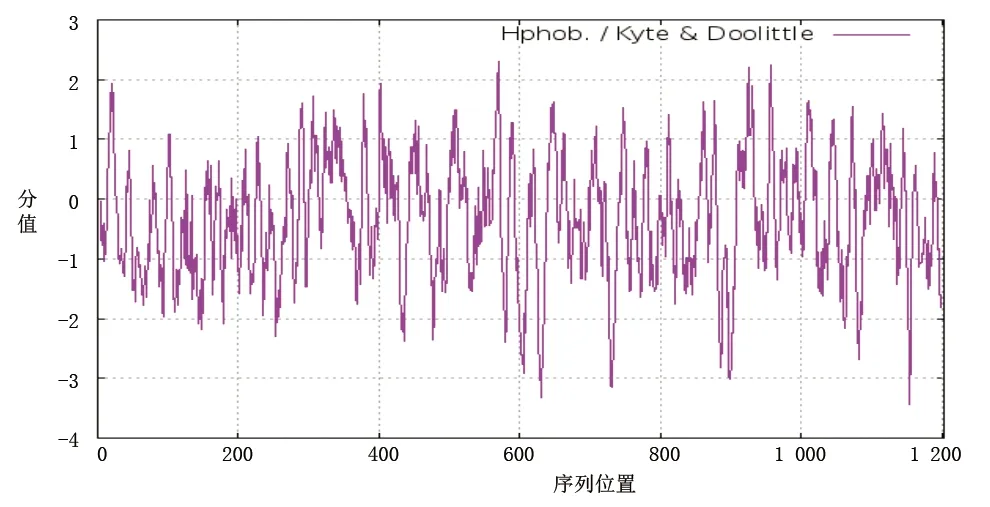
图1 eNOS蛋白亲水性和疏水性分析结果
2.3 eNOS蛋白信号肽的分析 运用SignalP 4.1软件进行分析,结果显示,C的最大值为0.076,Y最大值为0.073,S最大值为0.216,其预测的剪切点在33位氨基酸。S平均值为0.088,说明eNOS蛋白不是分泌蛋白并且也没有信号肽。见图2。

图2 eNOS蛋白信号肽分析结果
2.4 eNOS蛋白跨膜结构的分析 将eNOS蛋白的氨基酸序列输入到TMHMM软件进行跨膜结构的预测。由图3可见,eNOS蛋白全部在膜外,没有在跨膜区和细胞内。

图3 eNOS蛋白跨膜区的预测结果
2.5 eNOS蛋白二级结构的预测结果 用SMOPA数据库来预测蛋白质的二级结构,将构象数设置为3(Helix、Sheet、Coil),其他的参数默认为原始数据。结果显示,α螺旋、β折叠和无规则卷曲各占37.52%、15.39%、47.09%,见图4。其中α螺旋所占比重较高,这有利于维持蛋白质的稳定构象,而无规则卷曲常在蛋白质分子的表面,有利于抗原和抗体的相互作用。

图4 eNOS蛋白二级结构的预测结果
2.6 eNOS蛋白的三级结构预测结果 用SWISS-MODEL数据库来预测蛋白质的三级结构,运用同源建模的方法来预测结构,与数据库中已有的蛋白质进行序列的对比,选择相似度高的模型建模,预测的结果见图5,该蛋白质存在较多的扭曲和折叠,结构较为丰富,而这些结构对其生物学功能的发挥有重要作用。

图5 eNOS蛋白三级结构和同源性蛋白质相似性波形图
2.7 eNOS蛋白翻译后的加工 分别运用NetNGlyc1.0 Server和NetOGlyc4.0 Server在线软件对N-糖基化和O-糖基化位点进行分析,结果显示在该段序列上没有N-糖基化位点(见图6),O-糖基化位点位于第6、33、39、44、53、56、57、60、102、114、424、483、488、491、495、599、600、624、625、633、634、636、725、729、738、824、836、920、1171位。用NetPhos2.0 Server进行蛋白质磷酸化位点的预测,预测结果为有Ser:35,Thr:14,Tyr:4可以成为磷酸化的位点,见图7。
图6 eNOS蛋白N-糖基化分析

图7 eNOS蛋白磷酸化的分析结果
2.8 eNOS蛋白的相互作用 借助STRING数据库预测蛋白质的相互作用,预测eNOS蛋白可以与10个蛋白发生相互作用。其中,eNOS蛋白可以与α-丝氨酸/苏氨酸蛋白激酶1(alpha serine/threonine-protein kinase 1,AKT1)和血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)发生作用(见图8),前者在血管生成过程中发挥重要的调控作用,后者对血管内皮细胞的各种生理活动都有调节作用,说明eNOS蛋白与血管的各种生理活动关系密切。其他相互作用蛋白都可以协同eNOS蛋白的功能。
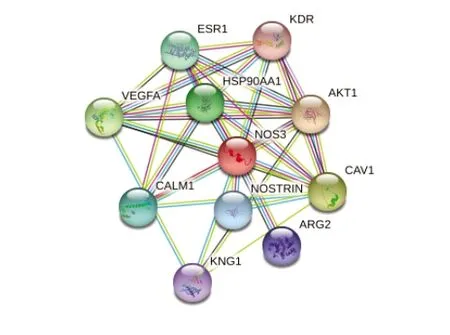
图8 eNOS蛋白相互作用的预测结果
2.9 人eNOS基因同源性分析 将人、小鼠、猪、大鼠、羊、马、牛、兔子、狗的eNOS基因序列导入Blast数据库进行基因序列分析,9个物种的eNOS基因序列相似度较高,处于75.95%~90.04%之间。其中人与猪的eNOS基因序列相似度最高(为86.22%),与马的基因序列相似度最低(为75.95%),其他各物种之间相似度比较结果见表3。
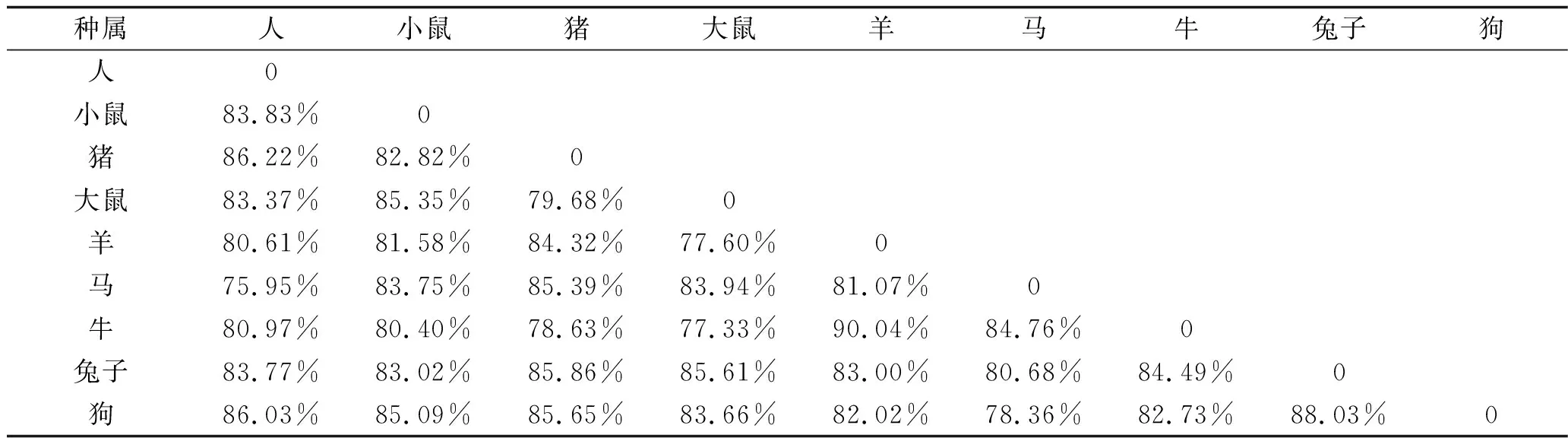
表3 不同物种eNOS基因序列相似度比较
3 讨 论
本研究运用生物信息学的各种软件,对eNOS基因及其编码的蛋白质进行了详细的分析,发现其具有以下特点:eNOS基因高得分的启动子有14个,SPl1是得分最高的转录因子;eNOS基因编码的蛋白质是不稳定亲水性偏中性的蛋白质,其不是分泌蛋白,也没有信号肽,全部分布在膜外,说明其可以作为受体参与信号传导的过程;eNOS蛋白的二级结构中α螺旋所占比重较高,这有利于维持蛋白质的稳定,且其三级结构较为复杂,说明其功能具有多样性;O-糖基化位点有29位,Ser:35、Thr:14、Tyr:4可以成为磷酸化的位点,这些修饰位点可以对蛋白质的功能进行调节;同源性分析结果雌雄激素受体1提示eNOS基因的进化上具有一定的保守型,并且人与猪的eNOS基因序列相似度最高,为86.22%,与马的基因序列相似度最低,为75.95%。
进一步行蛋白质的相互作用分析,结果显示,eNOS蛋白可以与10个蛋白质发生相互作用,说明这些蛋白与eNOS蛋白在功能上有联系。其中雌激素受体1参与调控真核细胞基因的表达,影响靶细胞的增殖和分化,雌激素受体1可以抑制核因子κB信号通路的活化,从而减少白细胞介素6等的表达[11-12]。血管内皮生长因子在血管生成、血管发育、血管通透性、胚胎造血等方面起着重要的调节作用,其可促进内皮细胞的增殖、存活、迁移和分化,以及肌动蛋白细胞骨架的重组,并可介导丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)1/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)2、MAPK3/ERK1和MAPK信号通路以及AKT1信号通路的激活,以及磷酸肌醇-3-激酶调节亚单位1的磷酸化、磷脂酰肌醇3-激酶的调节亚基、肌动蛋白骨架的重组和蛋白酪氨酸激酶2/局部黏着斑激酶的激活[13-15]。VEGFA在血管生成内皮细胞生长中起积极作用,其可诱导内皮细胞增殖,促进细胞迁移,抑制凋亡,调控血管通透性[16]。90 kDa热休克蛋白αA1可以在3个水平上调节转录:首先,它们改变某些转录因子的稳态水平,以应对各种生理刺激;其次,它们调节某些表观遗传修饰物(如组蛋白脱乙酰酶或DNA甲基转移酶)的活性,从而对环境的变化做出反应;再次,它们参与将组蛋白从某些基因的启动子区域逐出,从而启动基因表达[17]。此外,90 kDa热休克蛋白αA1还可以与细菌脂多糖结合,介导脂多糖诱导的炎症反应[18]。AKT1为AKT激酶的3种紧密相关的丝氨酸/苏氨酸蛋白激酶(AKT1、AKT2和AKT3)之一,它调控着细胞的代谢、增殖、细胞存活、生长和血管生成等多种过程,而这是通过丝氨酸和(或)苏氨酸磷酸化一系列下游底物来介导的[19]。小窝蛋白1可以充当支架蛋白的作用,参与T细胞受体介导的T细胞活化所必需的共刺激信号;它与二肽基肽酶4的结合以T细胞受体/CD3依赖的方式诱导T细胞增殖和核因子κB的活化[20]。一氧化氮合酶运输因子是一种多价适配蛋白,可通过使蛋白其远离质膜而降低目标蛋白的活性[21]。精氨酸酶Ⅱ可能在调节尿素外循环、精氨酸代谢和降低NO合成方面发挥作用,肝外的精氨酸酶对一氧化氮合酶的生物利用度有调节作用,精氨酸代谢是天然免疫和适应性免疫反应的关键调节因子,可以通过调节核糖体蛋白S6激酶B1信号传导,促进内皮细胞衰老,并导致一氧化氮合酶3/eNOS功能障碍[22-23]。钙调蛋白1通过钙结合介导大量酶、离子通道、水通道蛋白和其他蛋白质的调控,而钙调素-钙复合物刺激的酶包括许多蛋白激酶和磷酸酶[24]。激肽原1在凝血过程中以及对血管通透性和炎症因子产生等方面发挥重要的调节作用[25]。
eNOS是NO合成的关键酶,而NO又是调控血管功能的关键因子,因此eNOS是所有与血管相关疾病研究的重要靶点。通过对人基因eNOS及其所编码蛋白质的深入分析,我们对其有了更加深入的了解, eNOS具有利于蛋白间相互作用的结构特点和在细胞膜定位的特点,表明其具有传递信息的功能,这或可为后期的基础研究提供一个科学导向。

