常温和冰冻保存条件下单采血小板制品凝血功能的差异▲
钟周琳 周 燕 卢 芳 李丽兰 李恒聪 蒋丽红 陈洁润 吴国光
(广西南宁输血医学研究所,南宁市 530007,电子邮箱:zhzhl2000@126.com)
血小板制品在创伤、血液系统疾病、肿瘤等患者中的应用越来越广泛,而通常血小板于(22±2)℃(常温)振荡条件下仅能保存5 d,因此临床常面临血小板制品短缺的问题。此外,与其他血液制品相比,常温保存的血小板制品的细菌污染风险更高,而病原体灭活技术可降低此风险[1-3]。血小板保存损伤成为解决血小板保存问题的瓶颈,随着保存时间的延长,血小板发生一系列代谢活动,影响血小板质量及功能[4]。-80℃冰冻保存可减少血小板的代谢活动,延长血小板保存时间,但是冻融过程可能会改变血小板构象。目前用于检测血小板制品质量的常规指标仅有血小板计数、pH值等。血栓弹力图(thromboelastogram,TEG)通过检测血栓粘弹力,分析血小板、纤维蛋白、凝血因子等在凝血、纤溶等过程的相互作用,检测原理更接近血小板在人体内的生理学功能。本研究应用TEG、流式细胞术分析常温和冰冻保存条件下的单采血小板活化、凋亡以及凝血功能的差异,现报告如下。
1 资料和方法
1.1 样本来源 选取2017年6月至2019年4月南宁中心血站单采血小板16份,献血者男女比例为1 ∶1,年龄18~55岁,符合《献血者健康检查要求》,献血前5 d内未服用抑制或损害血小板功能的药物(如含阿司匹林或阿司匹林类药物)。应用无菌接管技术将每份单采血小板样本分成8份,其中4份于(22±2)℃下振荡保存在一次性使用血小板常温保存袋中,分别于采集当日、第3天、第5天及第8天进行检测;另外4份置于冻存管中,加入100 μL终浓度为5%的二甲基亚砜(dimethyl sulfoxide,DMSO)后于-80℃保存,分别于保存第3天、第5天、第8天及1年将样本置于37℃水浴溶解后进行检测。献血者对本研究知情同意,本研究经南宁中心血站伦理委员会审查同意。
1.2 试剂与仪器 TEG Hemostasis System Kaolin试剂盒(美国Haemoscope公司,批号:HMO400、HMO4134),藻红蛋白标记的CD62P抗体(美国BD公司,批号:7135680),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-膜联蛋白V(Annexin V)(美国BD公司,批号:7298795),一次性使用血小板常温保存袋(四川南格尔生物医学股份有限公司,批号:170608),DMSO(美国Sigma公司,批号:SHBG6226V),多聚甲醛(天津市博迪化工有限公司,批号20150415),TEG5000血栓弹力图仪(美国Haemoscope公司),FACSCalibur流式细胞仪(美国BD公司), Sysmex XT-2000i五分类血细胞分析仪(日本Sysmex公司)。
1.3 血小板计数及平均血小板体积的检测 将样本颠倒混匀后,采用五分类血细胞分析仪检测获得血小板计数及平均血小板体积(mean platelet volume,MPV),操作按说明书执行。
1.4 TEG检测 将样本及含高岭土、混合磷脂等成分的TEG Hemostasis System Kaolin试剂盒分别置于室温平衡15 min后,取1 000 μL样本加入试剂盒中,轻轻颠倒混匀5次,吸取330 μL样本加入含30 μL 0.2 mol/L氯化钙的TEG上样杯中,在37 ℃、CK模式下检测60 min,记录凝血时间、最大振幅、 α角、凝血指数等数据。
1.5 流式细胞术检测血小板CD62P表达水平 采用流式细胞术检测血小板CD62P表达水平以评价血小板的活化程度。将血小板(106个细胞)与10 μL藻红蛋白标记的CD62P抗体混匀后室温避光孵育15 min,加入1 mL 1%多聚甲醛固定液,充分混匀,2℃~8℃避光放置30 min。24 h内用流式细胞仪获取10 000个血小板以分析CD62P表达水平。
1.6 流式细胞术检测血小板磷脂酰丝氨酸暴露水平 血小板凋亡早期磷脂酰丝氨酸(phosphatidylserine,PS)外翻至细胞膜表面,而Annexin V是钙离子依赖性磷脂结合蛋白,能与PS高亲和力特异性结合,因此采用荧光标记的Annexin V通过流式细胞术可检测PS的暴露水平,从而评价血小板的凋亡情况[5]。将血小板(106个细胞)、5 μL FITC-Annexin V、100 μL 1×结合缓冲液混匀,室温避光孵育15 min,加入400 μL 1×结合缓冲液后立即用流式细胞仪获取10 000个血小板以分析Annexin V结合率。
1.7 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,重复测量计量资料的比较采用重复测量方差分析,两两比较采用t检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 常温和冰冻保存对血小板计数和MPV的影响 在采集后第3天、第5天、第8天,两组的血小板计数比较,差异无统计学意义(F组间=0.024,P组间=0.879);两组的血小板计数均无随时间变化的趋势(F时间=2.419,P时间=0.115);分组与时间无交互效应(F交互=0.445,P交互=0.582)。两组的MPV比较,差异无统计学意义(F组间=3.445,P组间=0.073);在采集后第3天、第5天、第8天,两组的MPV均有随时间变化的趋势(F时间=23.895,P时间<0.001);分组与时间有交互效应(F交互=7.770,P交互=0.002)。见表1。
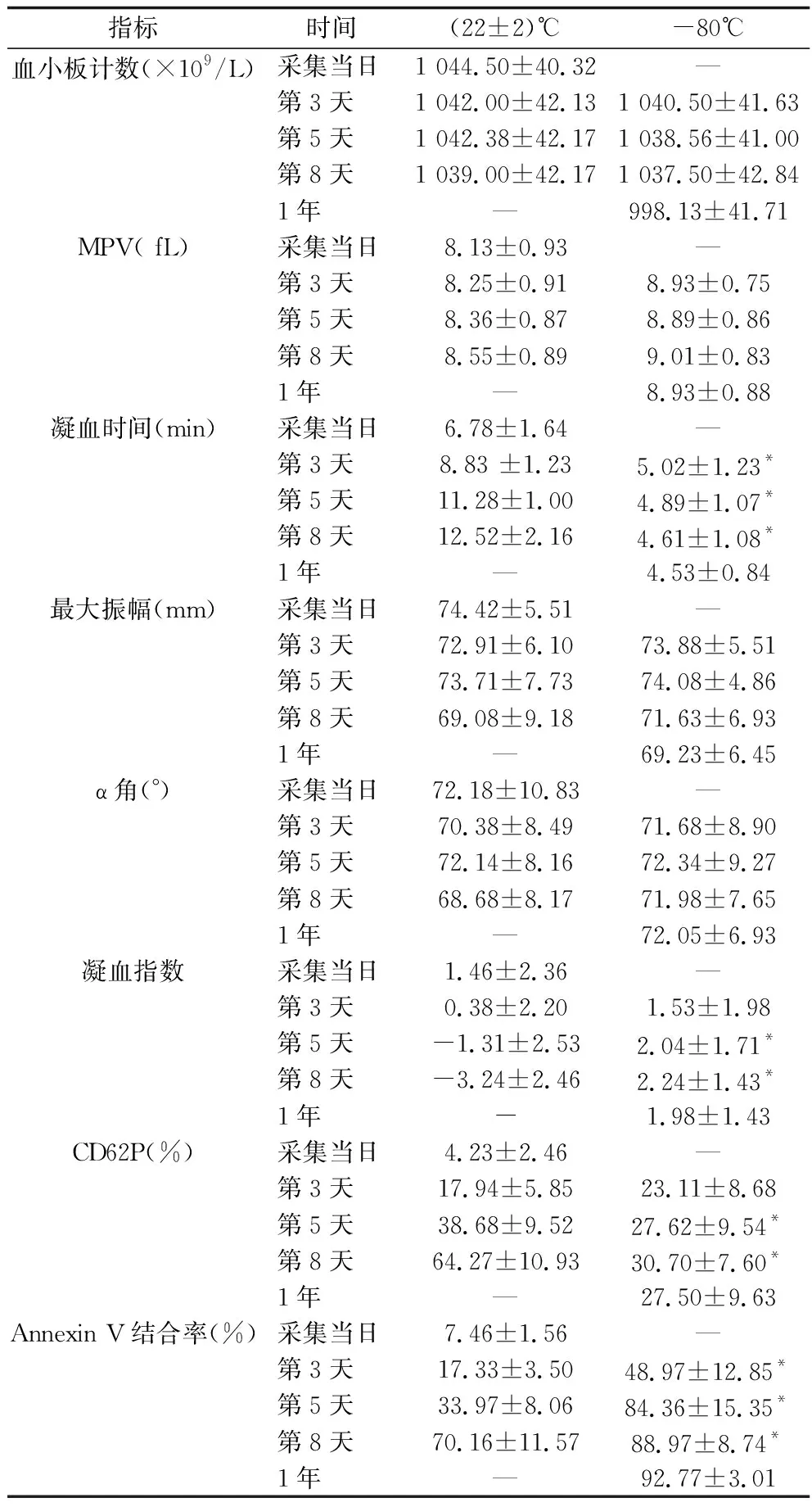
表1 常温和冰冻保存下血小板制品各指标的差异(n=16,x±s )
2.2 常温和冰冻保存对TEG相关指标的影响 在采集后第3天、第5天、第8天,两组的凝血时间、凝血指数比较,差异有统计学意义(F组间=251.094、31.763,均P组间<0.001),各时点冰冻保存的血小板制品凝血时间低于常温保存的血小板制品凝血时间(P<0.05),在采集后第5天、第8天时,冰冻保存的血小板制品凝血指数高于常温保存的血小板制品凝血指数(P<0.05);两组的凝血时间、凝血指数均有随时间变化的趋势(F时间=22.458,P时间<0.001;P时间=7.153,P时间=0.002);分组与时间均有交互效应(F交互=34.039、15.805,P交互<0.001)。在采集后第3天、第5天、第8天,两组的最大振幅、 α角比较,差异均无统计学意义(F组间=0.355,P组间=0.556;F组间=0.402,P组间=0.531);两组的最大振幅有随时间变化的趋势(F时间=8.561,P时间=0.001),α角无随时间变化的趋势(F时间=0.974,P时间=0.383);最大振幅和α角分组与时间均无交互效应(F交互=0.743,P交互=0.457;F交互=0.642,P交互=0.530)。见表1。
2.3 常温和冰冻保存对血小板CD62P表达水平的影响 在采集后第3天、第5天、第8天,两组的血小板CD62P表达水平比较,差异有统计学意义(F组间=24.877,P组间<0.001),其中在采集后第5天、第8天时,冰冻保存的血小板CD62P表达水平低于常温保存的血小板CD62P表达水平(P<0.05);两组的血小板CD62P表达水平均有随时间变化的趋势(F时间=172.437,P时间<0.001);分组与时间有交互效应(F交互=89.653,P交互<0.001)。见表1。
2.4 常温和冰冻保存对血小板PS暴露水平的影响两组的血小板Annexin V结合率比较,差异有统计学意义(F组间=144.471,P组间<0.001),其中在采集后第3天、第5天、第8天时冰冻保存的血小板Annexin V结合率高于常温保存的血小板Annexin V结合率(P<0.05);两组的血小板Annexin V结合率均有随时间变化的趋势(F时间=221.275,P时间<0.001);分组与时间有交互效应(F交互=25.781,P交互<0.001)。见表1。
3 讨 论
常温[(22±2)℃]振荡保存的血小板可吸收血液保存液中的葡萄糖,通过透气性血袋与外界交换气体,完成有限的能量代谢。然而,随着保存时间的延长,血小板发生不同程度的活化、凋亡,导致血小板出现损伤。另外,常温保存增加了细菌污染的风险,可导致严重的输血不良反应[6-7]。尽管低温保存的血小板发生分子结构和形态上的改变,但是其保存期长,可缓解血小板制品供应紧张的问题[8-11]。血小板的低温保存可分为冷藏保存(2℃~6℃)和冰冻保存(-80℃),其中冰冻保存血小板的应用更为广泛。美国食品药品监督管理局已认可DMSO作为冰冻血小板的保护剂,荷兰也在军队中应用冰冻血小板进行输血治疗[8,12]。
本研究结果显示,两组的血小板计数比较,差异无统计学意义(P>0.05),两组的血小板计数均无随时间变化的趋势(P>0.05),分组与时间无交互效应(P>0.05);两组的MPV比较,差异无统计学意义(P>0.05),两组的MPV均有随时间变化的趋势(P<0.05),分组与时间有交互效应(P<0.05),提示两种保存方法对血小板体积都有影响,但差异不大。在采集后第3天、第5天、第8天,冰冻保存的血小板制品凝血时间低于常温保存的血小板制品(P<0.05);同时两组的凝血时间均有随时间变化的趋势(P<0.05),其中常温保存的血小板制品的凝血时间随保存时间的推移而升高,即血小板制品中的凝血因子逐渐失活,然而冰冻保存的血小板制品的凝血时间随保存时间延长而缩短,凝血活性增强,这与常温保存的血小板的变化趋势相反。此外,采集后第3天、第5天、第8天时,两组血小板Annexin V结合率均随保存时间延长而升高,其中在各时点冰冻保存的血小板Annexin V结合率均高于常温保存的血小板(P<0.05),提示冰冻保存过程中血小板PS高度暴露。而PS是一种促凝因子,可与凝血因子Xa结合使凝血酶生成增加,促进血液凝块的形成[13],这可能是冰冻血小板凝血时间缩短的原因。此外,冰冻保存过程中血小板PS的高度暴露可能会导致血小板输入人体后很快被清除出循环系统,而如何延长冰冻血小板在体内存活时间,避免被快速清除,仍需进一步的动物实验和临床应用研究以探讨[14-15]。
最大振幅、α角是反映血小板功能的主要TEG指标,本研究中两组的最大振幅、 α角比较,差异均无统计学意义(P>0.05);两组的最大振幅有随时间变化的趋势(P<0.05),α角无随时间变化的趋势(P>0.05);分组与时间均无交互效应(P>0.05),提示随着时间的推移,最大振幅均发生变化,但两种保存方法差异不大。凝血指数可反映血液总体凝血情况,本研究中在采集后第5天、第8天,冰冻保存的血小板凝血指数均高于常温保存的血小板(P<0.05),其中在采集后第8天时常温保存的血小板凝血指数<-3.0,提示处于低凝状态,而冰冻保存1年后凝血指数仍在正常水平(正常值范围:-3~3),显示了冰冻保存保存时间长的优越性。此外,采集后各时点,两组血小板CD62P表达水平均随保存时间延长而升高,其中在保存第5天、第8天时冰冻保存的血小板CD62P表达水平低于常温保存的血小板CD62P表达水平(P<0.05),提示血小板制品随保存时间的延长发生明显活化,而冰冻保存的血小板活化程度低于常温保存,因此冰冻保存对血小板制品的长期保存更具有优势。
综上所述,与常温保存的单采血小板相比,冰冻保存的单采血小板制品PS暴露水平更高、凝血活性更强,具有更稳定的凝血功能,可用于治疗因创伤等需要即刻止血的患者;且保存期更长,可作为常温保存血小板制品的补充,以缓解血小板保存期短的难题。

