低温对离体大鼠心室肌复极时程的影响及其机制*
符校魁,刘艳秋,高 鸿,王贵龙,李华宇,代东君
(1. 贵州医科大学麻醉学院 贵阳 550001; 2. 贵阳市第四人民医院麻醉科 贵阳 550002; 3. 贵州医科大学第三附属医院 都匀 558000)
体温是重要的生命体征之一,麻醉手术期间由于多种因素破坏机体产热与散热之间的平衡,导致患者体温降低,临床上以亚低温(32-35℃)最为常见[1-2]。而低体温可引起QT间期延长、室内传导阻滞、严重窦性心动过缓、房颤、室颤等心律失常[3-4]。心律失常的发生与心肌细胞膜上离子通道表达或功能异常有关。我们前期研究发现[5],随着温度下降,离体大鼠心室肌单相动作电位时程(monophasic action potential duration, MAPD)延长、跨室壁复极离散度(transmural dispersion of repdarization, TDR)增大等电生理改变均与心室复极异常密切相关。内向整流钾电流(inward rectifier potassium current, Ik1)通道存在于心室肌和心房肌细胞, 主要生理作用是维持静息膜电位的稳定和可兴奋细胞的兴奋。Ik1的主要组成成份是Kir2.1, 是构成心肌细胞动作电位复极末期(3期)的主要电流之一[6]。目前认为Kir2.1与心房颤动、Anderson综合征、多形性室速、短QT间期综合征等心律失常疾病有关[6]。内向整流钾通道(the inward rectifying potassium channel,Kir)由其电压-电流关系得名,其中Kir2.1蛋白可控制细胞的兴奋性,调节心肌细胞晚期复极化和动作电位时程。本实验拟通过观察不同低温处理对离体大鼠心室肌复极时程及Kir2.1蛋白表达、分布的影响,为低温诱发心律失常的电生理机制提供理论依据。
1 材料与方法
1.1 实验动物及分组
健康成年雄性SD大鼠(SPF级),体重280~360 g,由贵州医科大学实验动物中心提供,食水不限,采用随机数字表法将其分为3组(n=6):37℃组(C组)、35℃低温组(H1组)、32℃低温组(H2组)。
1.2 Langendorff离体心脏灌注模型的制备及处理
经腹腔注射肝素3125 U/kg、戊巴比妥钠60 mg/kg后迅速开胸取心脏,参照文献[7]连接Langendorff装置(上海奥尔科特),用95%O2—5%CO2混合气体平衡的K-H液于37℃下进行非循环式逆行灌注,灌注压为3.6 kPa。各组均用37℃ K-H液平衡灌注15 min后,通过恒温槽及热交换器分别控制三组K-H液温度为37℃、35℃及32℃。C组继续灌注37℃ K-H液30 min;H1组继续灌注35℃ K-H液30 min,H2组继续灌注32℃ K-H液30 min。
1.3 电生理数据采集
参照文献[7-8]于平衡灌注15 min后,从左心室前壁分别插入电极至外膜层、中膜层、内膜层,参考电极置于主动脉根部。采用BL-420F系统(成都泰盟)记录单相动作电位(monophasic action potential, MAP)及平衡灌注15 min (T0)、继续灌注30 min(T1)的HR,计算左心室前壁三层心肌单相动作电位复极50%、90%的时程(MAPD50、MAPD90)、跨室壁复极离散度(TDR),观察心脏灌注过程中心律失常的发生情况。
1.4 Western blot法测定Kir2.1蛋白表达
灌注结束后,取电生理指标测定位置的心室肌,每100 g左心室心肌组织加入适当细胞裂解液及蛋白酶抑制剂(PMSF),冰上匀浆,运用BCA蛋白浓度测定试剂盒(索宝)进行蛋白定量。根据分子量大小,制备12%的分离胶注入制胶板的下层,30 min后,制备5%的浓缩胶注入制胶板的上层,上层胶电压80 V,下层胶电压120 V进行电泳,200 mA恒电流转膜2 h,用封闭液封闭2 h,分别孵育兔抗大鼠Kir2.1 抗体(1∶8 000)4℃孵育过夜,加用辣根过氧化物酶标记的羊抗兔二抗(1∶8 000)室温孵育1 h。ECL显色后曝光,显影。采用Image LAB(Bio—Rad)分析,通过Kir2.1蛋白条带积分光密度值与内参GAPDH蛋白条带积分光密度值的比值反映Kir2.1蛋白表达。
1.5 免疫组织化学法检测心肌Kir2.1蛋白的分布
采用PV6001Two-Step IHC Detection Reagent二步法检测心室肌组织抗原表达。石蜡包埋组织连续切片3 μm厚,脱蜡、水化;3%过氧化氢室温孵育10 min,采用高压热修复法进行抗原修复,以兔抗大鼠(Kir2.1抗体)作为一抗过夜,每张切片加 50 μl羊抗兔 IgG 抗体-HRP多聚体37℃孵育30 min,每张切片 100 μl DAB染色液显色,显微镜下观察,出现棕黄色后即可将切片放入自来水中终止反应。自来水冲洗苏木素复染,脱水透明、中性树胶封片。以细胞膜或细胞质中出现棕黄色物质者定为Kir2.1阳性细胞。利用IMAGEJ图像分析系统测定阳性细胞的平均光密度值(average optical density, AOD)。
1.6 统计学处理
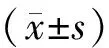
2 结果
2.1 各组心率的比较
T0时各组间心率无统计学意义,与T0时比较,T1时H1组、H2组心率均减慢(P<0.05)。组间比较显示:与C组比较,T1时H1组、H2组心率均有减慢(P<0.05);与H1组比较,H2组心率减慢(表1)。
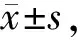
Tab. 1 Comparison of heart rates in each group(beats/min, n=6)
2.2 各组心肌MAPD50的比较
T0时各组间MAPD50无统计学意义,与T0时比较,T1时H2组MAPD50延长。组间比较显示:与C组比较,T1时H2组MAPD50延长(P<0.05);与H1组比较,T1时H2组MAPD50延长(P<0.05,表2)。
2.3 各组心肌MAPD90的比较
T0时各组间MAPD90之间无显著差异;与T0时比较,T1时H1组、H2组MAPD90均延长(P<0.05)。组间比较显示:与C组比较,T1时H1组、H2组MAPD90均延长(P<0.05);与H1组比较,T1时H2组MAPD90延长(P<0.05,表3)。
2.4 各组心肌TDR的比较
T0时点各组间TDR无显著差异。与T0时比较:T1时H1组、H2组TDR增大(P<0.05)。组间比较显示:与C组比较,T1时H1组、H2组TDR增大(P>0.05),与H1组比较,H2组TDR增大(P< 0.05,表4)。
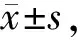
Tab. 2 Comparison of myocardial MAPD50 in each group(ms, n=6)
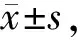
Tab. 3 Comparison of myocardial MAPD50 in each group(ms, n=6)
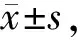
Tab. 4 Comparison of TDR in each group(ms, n=6)
2.5 各组心律失常发生情况的比较
灌注过程中H1组发生1例心律失常;H2组发生3例心律失常。组间比较显示:灌注过程中,与C组比较,H2组心率失常发生率增加(P<0.05);与H1组比较,H2组心率失常发生率增加(P<0.05)。
2.6 各组间Kir2.1蛋白表达的比较
Western blot法结果表明:C组Kir2.1蛋白呈强阳性表达。与C组比较,H1组、H2组心室肌Kir2.1蛋白表达降低(P<0.05),而H1组、H2组间Kir2.1蛋白表达无明显差异(P>0.05,表5、图1)。
免疫组织化学法结果表明:C组Kir2.1均匀分布,形态规整,未见明显异常;而H1组及H2组表达减少且分布不均,着色大小不一,多分布于心肌细胞测-测连接处。与C组比较,H1组和H2组心室肌Kir2.1蛋白AOD降低(P<0.05),而H1组、H2组间AOD值无明显差异(P>0.05,表5、图2)。
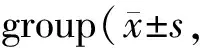
Tab. 5 Comparison of Kir2.1/GAPDH and AOD in each n=6)
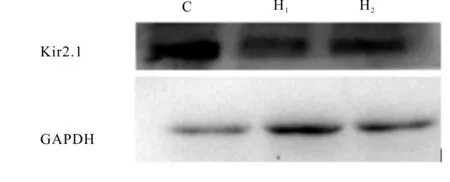
Fig. 1 Expression of Kir2.1 protein in left ventricular muscle in each group
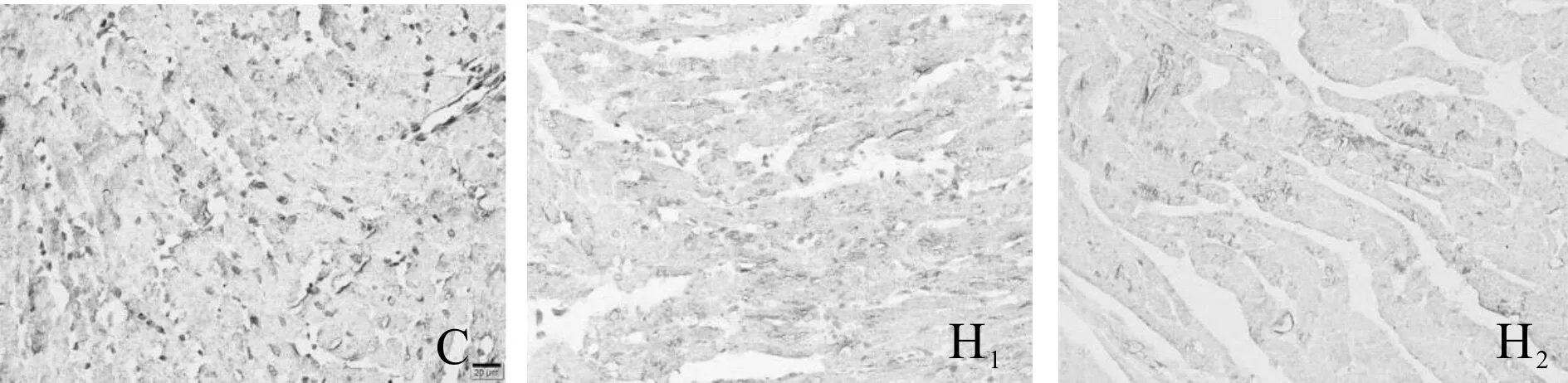
Fig. 2 Kir2.1 immunohistochemical staining of myocardial tissue(×400)
3 讨论
心肌单相动作电位MAP能反映心肌细胞的除极和复极化过程,MAPD50、MAPD90分别为复极化达到50%、90%的心肌动作电位时程,对应复极2相和3相,与QT间期的长短有密切关系[8]。因此本实验观察不同低温对离体鼠心室肌MAP的影响及Kir2.1蛋白在其中的作用,探讨低温所致心律失常的电生理机制。
参与心律失常发生的离子通道有ICa、INa、Iks、Ikr、Ito、IkATP等[9-10]。其中快激活延迟整流钾电流Ikr、慢激活延迟整流钾电流Iks和内向整流钾电流Ik1均参与心肌细胞的3相复极过程[10-11]。而内向整流钾通道(the inward rectifierpotassium channel,Kir)占总Ik1电流的80%以上,是复极3相的主要电流。Kir2.1是组成Ik1的主要通道蛋白,其整流特性有利于维持细胞的静息电位,并使之接近钾离子的平衡电位,是维持正常动作电位的主要成分[12-13]。研究发现,随着Kir2.1蛋白水平表达的上升或下降,Ik1的升高或降低能导致心房/心室肌静息膜电位发生改变,使复极化时程加快或减慢,产生电生理重构,室性心律失常的易感性增加,最终诱发心律失常[13-14]。
在本研究中,诱发心律失常的原因可能是低温减少心室肌细胞复极储备,抑制K+外流,延长MAPD,造成不同部位心肌复极不同步所致[15]。动作电位中复极的2相与3相涉及多种离子通道的共同参与,跨膜复极电位正常时,本身就存在一个低幅的震荡电位,在离子通道功能出现变化时可使震荡电位的振幅升高,达到除极的阈电位就将形成一次新的除极活动,即早后除极(early after depolarization, EAD),从而启动折返性心律失常的发生[15]。
另外,低温诱发的Kir2.1蛋白表达水平下调会导致心肌细胞动作电位复极末期(3期)和静息电位期(4期)的主要电流通道Ik1大量关闭,Ik1离子通道区域密度下降,以致动作电位3期快速复极化的电流强度减小,复极时程延长,最终诱发心室折返及心律失常。同时在低温下心肌细胞Kir2.1的分布紊乱会导致Kir2.1离子通道密度的区域性不同,导致出现不同的Ik1电流强度,在不同强度电流影响下动作电位时程出现不均一性,致使复极不均一下增加,进一步导致折返性心律失常发生[16]。抑制KCNJ2基因可下调Kir2.1的表达继而影响心室复极,低温引起的Kir2. 1蛋白下调及分布紊乱原因可能涉及KCNJ2/Kir2.1/Ik1通路[17]。有研究表明通过调控细胞内钙调蛋白构象改变以及Ca2+浓度也可能诱导心肌动作电位复极化改变,这也有可能低温诱发心律失常的发生机制之一,有待进一步试验进行验证[18]。
本研究提出低温可能诱发心率失常的机制,为进一步探讨其发生原因、研究治疗方案提供一定线索。目前有研究提示Ik1激动剂zacopride具有激活Kir2.1通道、逆转心肌复极时程的延长、减轻心室肌电生理重构从而治疗和预防心律失常的作用,针对本研究对低温诱发心律失常发生机制的探讨,Ik1激动剂可能有预防及治疗低温诱发的心律失常的作用,但需要进一步实验证实[19]。
综上所述,低温会延长大鼠心室肌动作电位时程并增加复极离散度,增加心率失常的发生风险,其机制与低温下调Kir2.1蛋白表达、诱发Kir2.1分布紊乱、影响Ik1电流有关。
——从一道浙江选考生物学试题谈起

