丝素纤维人工韧带材料的表面改性及细胞相容性
王一婷,刘明洁,王璐,关国平
东华大学纺织学院,纺织面料技术教育部重点实验室(上海, 201620)
【关健词】 丝素纤维; 人工韧带; 表面改性; 细胞相容性; 可降解
0 引言
前交叉韧带(AnteriorCruciateLigament,ACL)是膝关节的重要组成部分[1],ACL本质上是由滑膜包裹的致密结缔组织,主要成分是胶原蛋白(I、Ⅱ和V型)。其中,I型胶原蛋白约占90%[2],Ⅱ型和V型胶原约占10%。胶原纤维沿韧带的长轴平行排列,致密的结构赋予韧带足够的强力以维持膝关节的稳定性。然而,由于各种原因导致的ACL断裂是临床外科的常见病例[3]。人工韧带移植是临床治疗韧带断裂的有效手段之一[4-6]。临床上曾经使用较多的人工韧带是LARS(LigamentAdvancedReinforcementSystem)人工韧带[7-11],由聚对苯二甲酸乙二醇酯(PolyethyleneTerephthalate,PET)复丝编织而成,具有良好的力学性能和生物学稳定性。尽管如此,由于PET材料的不可降解性[12-15],LARS人工韧带植入体内一段时间后会发生疲劳松弛,导致膝关节不稳。而且,长期磨损后容易产生碎屑,甚至引发滑膜炎、骨关节炎等并发症。因此,开发一种生物相容性良好、可降解的人工韧带材料就成为该领域重要的研究方向。
丝素纤维[16-19]具有良好的力学性能、可降解性和生物相容性,应用于外科缝合线已有很长的历史。故用丝素纤维尝试开发一种高强、可降解的人工韧带材料,具有很好的前景。本研究结合编织及机织的方法,以天然丝素纤维为原材料,首先,设计制备了一种结构仿生的人工韧带材料。换言之,内部是平行排列的丝素纤维编织纱,外部包裹了一层丝素纤维机织材料。其次,采用具有促进细胞粘附和增殖作用的生物活性分子对该材料进行表面接枝改性[20-21],包括I型胶原蛋白(ColI)、纤维蛋白原(Fg)和TGF-β1结合肽(Pep)。最后,对这些材料的细胞相容性进行了表征。期望本研究为开发高强、可降解、细胞相容性良好的人工韧带提供参考。
1 材料与方法
1.1 材料与仪器
天然蚕丝; 无水碳酸钠; 1-(3-二甲基氨基丙基)-3-乙基羰二亚胺; N-羟基琥珀酰亚胺; 2-吗啉乙磺酸。CCK-8试剂盒; 人真皮成纤维细胞。精密电子天平; HD-300低温等离子处理仪; HYG-B全温摇瓶柜; OCA15EC接触角测试仪; 傅里叶红外光谱仪扫描电子显微镜。常温震荡染色试验机; 环境扫描电子显微镜; 电热鼓风干燥箱酶标仪。
1.2 丝素纤维人工韧带材料的设计与制备[22-23]
通过参考天然韧带结构、钢缆式结构和带芯纱编织结构,本研究以一束平行排列的丝素编织纱作为“芯”,一层丝素纤维机织材料作为“壳”包裹在“芯”的外面,获得仿生结构的人工韧带材料。
1.3 表面改性
对丝素纤维人工韧带材料表面进行低温氧气等离子体处理,设定参数: 真空度为50 Pa,放电功率为10 W,处理 10 min。将氧等离子体处理后的丝素纤维人工韧带材料浸泡在pH为6.0的2-吗啉乙磺酸(MES)缓冲液中,浴比为1:30, 室温下反应2 h。再往MES缓冲液中加入浓度为0.1 mmoL/L的EDC溶液30 mL,反应2 h。再加入浓度为0.1 mmoL/L的NHS溶液30 mL继续反应1 h。反应结束后将材料转移入0.1 g/mL的Col I溶液中,4℃下反应24 h。反应完成后,将丝素纤维人工韧带材料取出,用去离子水清洗3次,每次5 min。最后,把材料放入37 ℃烘箱中干燥后得到Col I接枝的丝素纤维人工韧带材料(SF-O2-Col I)。同法制备Fg接枝的丝素纤维人工韧带材料(SF-O2-Fg)和Pep接枝的丝素纤维人工韧带材料(SF-O2-Pep)。
1.4 扫描电子显微镜(SEM)
采用TM 3000扫描电子显微镜对SF-O2-Col I、SF-O2-Fg和SF-O2-Pep进行表面形貌观察,实验前按要求使用导电胶将样品固定于电镜台上并喷金,观察时加速电压为5 kV。
1.5 力学性能
利用万能材料试验机测试材料的力学性能。力学性能测试前,先将样品置于恒温恒湿 ( 温度为20 ℃±2 ℃ ,相对湿度为65%±2% ) 环境中平衡 24 h,隔距40 mm,拉伸速率为20 mm/min,预张力为0.2 N,样品重复数为3,结果取平均值。
1.6 材料表面水接触角
测量仪器为OCA15EC接触角测试仪(德国 Dataphysics),测试方法采用气泡法,测试液体为去离子水。试样尺寸为 50 mm×10 mm,每个试样取3个测试点,每组试样测试 3个样品,结果取平均值(n=9)。
1.7 傅里叶红外光谱
采用Nicolet 6700傅里叶变换红外光谱仪,通过衰减全反射法(Attenuated total reflection,ATR),对SF-O2-Col I、SF-O2-Fg以及SF-O2-Pep进行分子结构表征,扫描范围为500~4 000 cm-1。
1.8 细胞相容性
本研究采用人真皮成纤维细胞(HFF)对丝素纤维人工韧带材料进行细胞相容性表征。先将丝素纤维人工韧带材料(SF)、SF-O2-Col I、SF-O2-Fg以及SF-O2-Pep制作成直径为14 mm的圆形试样。分别放入24孔细胞培养板中,每孔一个试样。将24孔板放入无菌操作台,用紫外光照射24 h,用75%酒精浸泡材料30 min,再吸干酒精,用PBS清洗3次,每次10 min。每孔种植HFF的数量为8 000个,在培养箱中分别培养1 d、4 d、7 d、10 d,每两天更换一次培养基。培养结束后,每孔中加入50 μL的CCK-8试剂,在避光条件下继续培养4 h。结束后,将24孔板中的溶液转移至96孔板,用MuLTISKAN MK3酶标仪测其吸光度,测试波长为450 nm。从24孔板的一个孔中取100 μL溶液加入到96孔板的一个孔中,共取3次。
1.9 数据统计分析
本研究的所有数据以“平均数 ± 标准差”表示,应用SPSS 23.0软件进行统计学分析,组间数据的差异性检验采用方差分析法,P<0.05为显著差异(*) ,P<0.01为极显著差异(**)。
2 结果与讨论
2.1 丝素纤维人工韧带材料形态结构
制备的丝素纤维人工韧带材料照片如图3所示。该丝素纤维人工韧带材料呈象牙白色,表面平整、结构规整、纹理规则清晰。该人工韧带的直径约为6 mm(图3A)。体视显微镜下可见,该丝素纤维人工韧带材料表面结构规则、致密,观察不到内部纱线,说明包覆效果良好(图3B)。由于机织“壳”的管径可以根据需要任意调节,因此采用编织和机织相结合的方法可以获得尺寸和力学性能精确控制的人工韧带材料。

图3 丝素纤维人工韧带材料照片Fig.3 Silk fibroin fiber artificial ligament prototype
2.2 SEM
电子显微镜扫描(SEM) 结果如图 4 所示。改性前,SF材料表面的丝素纤维光滑平整,纤维边界清晰(图4A)。通过胶原蛋白进行表面改性后,材料表面出现了一层膜状物(图4B)。人纤维蛋白原处理后,纤维表面出现大量微小的点状沉积物,亦可见较大的聚集体成团块状或条状,但没有形成膜(图4C)。TGF-β1结合肽处理后,纤维表面可见分布均匀的颗粒状沉积物,但未见集聚团块和膜,纤维之间边界仍然清晰可见(图4D)。

图4 韧带材料SEM图像 Fig.4 SEM micrographs of SF
2.3 力学性能
对丝素纤维人工韧带材料SF、SF-O2-Col I、SF-O2-Fg及SF-O2-Pep的拉伸断裂强度分别为(46.6±3.6) MPa、(45.5±2.6) MPa、(41.4±1.0) MPa和(43.1±0.7) MPa。如图5所示。而“芯”的拉伸断裂强度仅为(10.5±0.5) MPa。说明机织套管在提高人工韧带材料结构紧密度和拉伸断裂强度方面具有显著作用。而且,四种丝素纤维人工韧带材料的拉伸断裂强度之间无显著性差异(P>0.05),均接近真实ACL的拉伸断裂强度。值得一提的是,本研究设计制备的这种人工韧带材料的明显优势是,可对其尺寸和力学性能进行可控调节。

图5 丝素纤维人工韧带材料的拉伸断裂强度Fig.5 Tensile strengths at break of four artificial ligament materials
2.4 水接触角
对改性前后的试样进行水接触角测试,结果如表1所示。丝素纤维人工韧带材料SF的表面水接触角是64.6°±0.2°,而SF-O2-Col I、SF-O2-Fg和SF-O2-Pep的水接触角分别是59.2°±0.1°、62.5°±0.2°和63.4°±0.2°。改性前后丝素纤维人工韧带材料表面的水接触角没有明显变化。这可能由于丝素纤维材料本身的亲水性本质有关,故改性后的材料表面水接触角与改性前接近。

表1 丝素纤维人工韧带材料的水接触角(°)Tab.1 Water contact angles of four artificial ligament materials
2.5 红外光谱
表面改性前后的丝素纤维人工韧带材料的FTIR红外光谱如图6所示。丝素蛋白(SF)中的酰胺Ⅰ和酰胺 Ⅱ特征峰分别出现在1 620 cm-1和1 513 cm-1的位置,酰胺Ⅲ吸收峰出现在1 228 cm-1位置。如图所示,改性后各人工韧带材料的分子结构保持稳定,未见破坏。说明低温等离子体处理联合分子接枝的方法十分温和,不会对丝素纤维材料造成结构上的损伤。该结果也与力学性能测试结果相符,经过改性后的材料的力学性能未有显著变化。

图6 丝素纤维人工韧带材料的红外光谱测试结果Fig.6 FTIR spectra of four artificial ligament materials
2.6 细胞相容性
丝素纤维人工韧带材料细胞活性试验结果,如图7所示。图中的CONTROL为阴性对照(培养板),SF、SF-O2-Col I、SF-O2-Fg及SF-O2-Pep为实验组。随着培养时间的延长,所有材料表面的细胞数量均逐渐增加。培养4 d后,SF-O2-Fg表面细胞活性已经显著高于阴性对照组,说明经Fg接枝后的材料表面非常有利于HFF的粘附和增殖。这与周晓梅等的研究一致。而其他三个样品的OD值仍然低于阴性对照组。培养7 d后的试验结果与4 d的结果相似,SF-O2-Fg材料的细胞相容性仍然表现出明显的优势。培养10 d后,SF-O2-Pep组的OD值有了较明显的增加,虽然低于SF-O2-Fg组,但是与阴性对照组之间已经没有显著差异。Fg可以通过与内皮细胞非整合素受体结合而与细胞相互作用,产生趋化作用,促进细胞粘附增殖。Fg也促进了HFF真皮成纤维细胞的增殖。这是韧带修复的重要环节。
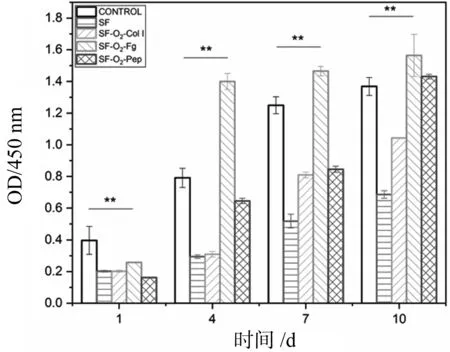
图7 丝素纤维人工韧带材料的细胞活性试验结果Fig.7 Results of cell viability of four artificial ligament materials
3 结论
本研究设计并制备了一种可降解的丝素纤维人工韧带材料,结合编织及机织的方法可获得与天然韧带相似的仿生结构。通过O2等离子体处理及化学接枝,对该丝素纤维人工韧带材料表面进行了改性。结果表明,表面接枝生物分子可改变丝素纤维人工韧带材料的表面微形貌。然而,由于天然丝素纤维材料表面显示亲水性,表面改性后的水接触角并没有发生明显改变。本研究所采的表面改性方法对丝素纤维人工韧带材料的分子结构和力学性能影响不大,改性后材料的拉伸断裂强度仍然满足作为ACL移植物的拉伸断裂强度要求。细胞试验结果表明,表面改性处理对提高丝素纤维人工韧带材料的细胞相容性有积极影响。其中,SF-O2-Fg组材料的细胞相容性表现最优。这可能提示,与ColI和Pep相比较,Fg对成纤维细胞的粘附增殖更为有利。此外,本研究所设计的这种人工韧带材料的明显优势在于其结构、尺寸和力学性能的可控性。
致谢
感谢东华大学化学化工与生物工程学院娄向新老师、郜增在细胞实验部分的帮助。

