C57BL/6小鼠p38丝裂原活化蛋白激酶通路抑制后抗结核效应
盛青 黄丽军 邹威凤 周强 周晓婷 祝涛
1广州市胸科医院呼吸内科(广州510095);2宜春市人民医院检验科(江西宜春336000)
结核病(tuberculosis,TB)是由结核分枝杆菌(mycobacterium tuberculosi,MTB)感染引起的慢性传染性疾病,以肺结核最为常见。最新数据显示,2018年全球大约有1 040万新发结核病例[1],表明结核病仍然是威胁人类健康的重大公共卫生问题。众所周知,在MTB感染过程中,宿主分泌的细胞因子在介导其对MTB的防御反应中发挥重要的作用,如MTB感染的巨噬细胞可分泌炎症因子,介导肉芽肿形成和T细胞免疫反应[2]。在宿主介导MTB感染的细胞内信号转导途径中,有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)是重要的细胞信号通路之一,其包括细胞外信号调节激酶1和2(extracellular signal-regulated kinase1/2,ERK1/2)、p38 MAPK和c-Jun N-末端激酶(Jun N-terminal kinase,JNK)[3]。笔者前期研究发现[4]:在肺结核患者和肺结核小鼠模型中p38 MAPK的磷酸化水平均显著增加,在巨噬细胞中p38 MAPK表达水平随感染时间的推移而逐步增高,提示磷酸化活化的p38 MAPK信号重要参与了抗结核感染过程。为进一步认识该信号通路在抗结核感染中的作用,本研究对应用p38 MAPK 抑制剂(SB203580)抑制小鼠内p38 MAPK 通路后的抗结核作用进行了初步研究,现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物SPF级8~10周龄雄性C57BL/6小鼠20只,体质量(20±0.8)g,由深圳第三人民医院肝病研究所提供。
1.1.2 主要仪器和试剂红细胞裂解液(Invitrogen),1640 培养基(Gibco),胎牛血清(Gibco),结核菌株H37Rv(广州市胸科医院结核病生物样本库保存株),荧光PCR 仪(Roche),紫外分光光度仪(DeNovix),普通PCR 仪(ABI),高速离心机(Eppendorf),流式细胞仪(BD FACSCantoⅡ),SB203580(Invitrogen),气溶胶感染装置(Glas-Col),细菌培养箱(上海合恒仪器设备有限公司),鼠抗CD11b APC(eBioscience),鼠抗F4/80 FITC(eBioscience),鼠抗Ly6G APC-CY7(eBioscience)。
1.2 方法
1.2.1 小鼠结核病模型构建p38 MAPK 抑制剂(SB203580)用DMSO 溶解,且终浓度用DMSO 稀释成2 mg/mL,将小鼠随机分为两组,每组10只,分别通过腹腔注射DMSO(对照组)和SB203580(观察组),并做好标记;将小鼠通过气溶胶雾化吸入系统感染约150 CFUs的有毒菌株H37Rv,30 d后处死小鼠[5],收集小鼠肺脏、淋巴结、脾脏和肝脏等组织进行细菌载量计数,检测小鼠肺组织炎症细胞比例、细胞因子表达水平以及CD4+、CD8+、CD4+IFN-γ+和CD8+IFN-γ+T细胞亚群比例。
1.2.2 小鼠细菌载量计数收集小鼠完整的各组织并放置于盛有4.5 mL生理盐水的离心管中,采用匀浆器匀浆组织片刻,使不见组织碎片为准,重悬后取500 μL组织匀浆液加入另一盛有4.5 mL 无菌生理盐水的离心管中,梯度稀释后分别取100 μL组织匀浆液接种至Middlebrook 7H11 罗氏平板中,轻轻摇匀后放置于细菌培养箱中,培养4 周左右后计数平板中菌落数,并计算各组织的细菌载量。
1.2.3 肺组织淋巴细胞的分离收集小鼠肺组织并剔除淋巴结,将小鼠肺组织剪成匀浆状,用Ⅳ型胶原酶混匀后37℃消化30 min,移出吹打片刻,再放置于37℃培养箱20 min,消化后加入12.5 mmol/L EDTA 冰上终止消化5 min,将上述制备的肺组织细胞悬液通过细胞滤网过滤,制备单细胞悬液,在4℃,2 000 r/min,离心5 min,收集细胞后加入3 mL 38%Percoll淋巴细胞分离液重悬混匀,在4℃,2 000 r/min,离心30 min,收集细胞见红细胞可加入1 mL 红细胞裂解液常温裂解5 min,裂解后加满PBS 至15 mL,以终止裂解反应并在4℃,2 000 r/min,离心5 min,弃细胞上清,加入2 mL RPMI 1640/5%FBS 培养基重悬细胞制成单细胞悬液,将所获得的细胞在显微镜下计数[6]。
1.2.4 流式检测术将鼠抗CD11b APC,鼠抗F4/80 FITC和鼠抗Ly6G APC-CY7等抗体以400倍稀释,避光放置于冰上。取1 mL 细胞悬液,5 000 r/min,离心5 min,弃细胞上清,加入100 μL 抗体稀释液,重悬后避光孵育15 min,孵育后加入1 mL PBS常规离心,弃上清,用100 μL PBS重悬细胞,上机检测。
1.2.5 qRT-PCR检测将组织匀浆液根据Total RNA Kit I试剂说明书抽提RNA 并利用紫外分光光度仪检测提取纯度;RNA 被反转录成cDNA,在荧光PCR 仪上检测基因的Ct值,并与内参基因GAPDH 对比,计算各基因的相对函数值。
1.3 统计学方法采用GraphPad Prism 6.0 软件进行统计分析,以DMSO 对照组和SB203580 观察组小鼠肺脏、淋巴结、脾脏和肝脏等组织的细菌载量,以及炎症细胞比例、细胞因子表达水平和CD4+、CD8+、CD4+IFN-γ+和CD8+IFN-γ+T细胞亚群比例以x±s表示,正态分布资料的两组间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 对照组和观察组小鼠各组织中细菌载量的变化本组研究结果显示,观察组小鼠肺、淋巴结、脾脏和肝脏等组织细菌载量均明显多于对照组,且差异有统计学意义(P<0.05),见表1。
2.2 对照组和观察组小鼠肺组织炎症细胞浸润程度的变化研究显示除CD4+、CD8+以及CD8+IFNγ+T细胞外,观察组小鼠肺组织单核细胞、中性粒细胞、巨噬细胞、CD4+IFN-γ+T细胞均显著低于对照组,且差异有统计学意义(P<0.05)(表2),提示p38 MAPK 活性被抑制后小鼠肺组织炎症细胞浸润程度发生了重要变化。
表1 小鼠各组织中细菌载量情况Tab.1 The circumstances of bacterial load in various tissues of mice ±s
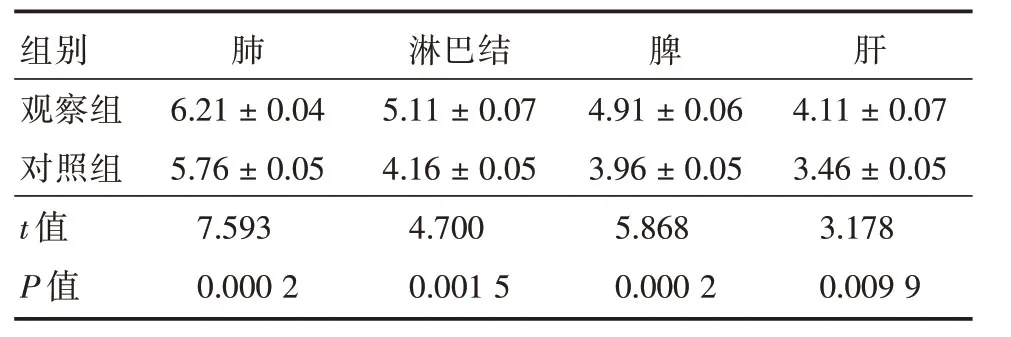
表1 小鼠各组织中细菌载量情况Tab.1 The circumstances of bacterial load in various tissues of mice ±s
组别观察组对照组t值P值肺6.21±0.04 5.76±0.05 7.593 0.000 2淋巴结5.11±0.07 4.16±0.05 4.700 0.001 5脾4.91±0.06 3.96±0.05 5.868 0.000 2肝4.11±0.07 3.46±0.05 3.178 0.009 9
2.3 对照组和观察组小鼠肺组织炎症因子表达水平的变化在发现观察组小鼠肺组织炎症细胞浸润显著低于对照组之后,我们进一步检测小鼠肺组织炎症因子的表达水平,研究显示:相对于内参基因,观察组小鼠肺组织TNF-α、IL-12P40、IL-17A、IFN-γ、CXCL1、CXCL5和CXCL15 基因表达水平均明显低于对照组,且差异有统计学意义(P<0.05),见表3。
表2 小鼠肺组织中炎症细胞浸润情况Tab.2 The ratio of inflammatory cell infiltration in lung tissue of mice ±s,%
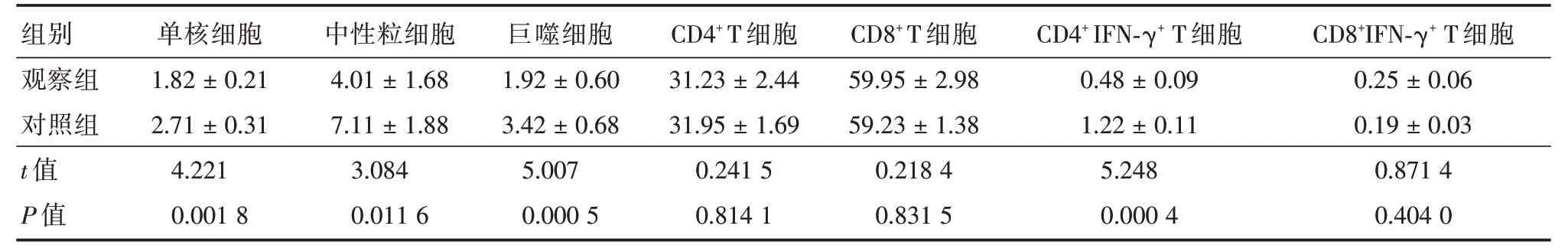
表2 小鼠肺组织中炎症细胞浸润情况Tab.2 The ratio of inflammatory cell infiltration in lung tissue of mice ±s,%
组别观察组对照组t值P值单核细胞1.82±0.21 2.71±0.31 4.221 0.001 8中性粒细胞4.01±1.68 7.11±1.88 3.084 0.011 6巨噬细胞1.92±0.60 3.42±0.68 5.007 0.000 5 CD4+T细胞31.23±2.44 31.95±1.69 0.241 5 0.814 1 CD8+T细胞59.95±2.98 59.23±1.38 0.218 4 0.831 5 CD4+IFN-γ+T细胞0.48±0.09 1.22±0.11 5.248 0.000 4 CD8+IFN-γ+T细胞0.25±0.06 0.19±0.03 0.871 4 0.404 0
表3 小鼠肺组织中炎症因子表达水平情况(相对于内参基因)Tab.3 Expression levels of inflammatory factors in mouse lung tissue(relative to the reference gene)±s
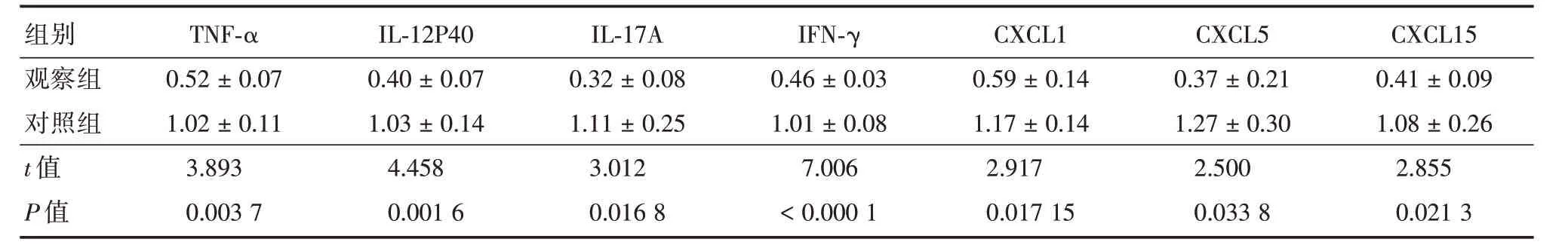
表3 小鼠肺组织中炎症因子表达水平情况(相对于内参基因)Tab.3 Expression levels of inflammatory factors in mouse lung tissue(relative to the reference gene)±s
组别观察组对照组t值P值TNF-α 0.52±0.07 1.02±0.11 3.893 0.003 7 IL-12P40 0.40±0.07 1.03±0.14 4.458 0.001 6 IL-17A 0.32±0.08 1.11±0.25 3.012 0.016 8 IFN-γ 0.46±0.03 1.01±0.08 7.006<0.000 1 CXCL1 0.59±0.14 1.17±0.14 2.917 0.017 15 CXCL5 0.37±0.21 1.27±0.30 2.500 0.033 8 CXCL15 0.41±0.09 1.08±0.26 2.855 0.021 3
3 讨论
人体抗结核免疫涉及各细胞群体间的一系列复杂相互作用[7],各类免疫细胞对感染结核分枝杆菌的吞噬与杀灭[8]、由各种免疫细胞分泌的细胞因子所策动的抗结核免疫保护作用可以控制感染[9],而由趋化因子所衍生的变态反应则可使感染局限化[10-11]。本研究结果显示C57BL/6小鼠的p38 MAPK 通路被其抑制剂SB203580 阻断后,在组织水平、细胞水平和相关分子水平上,对结核分枝杆菌感染的反应均表现出重要的变化:小鼠肺组织单核细胞、中性粒细胞、巨噬细胞、CD4+IFN-γ+T细胞在数量上大为减少,小鼠肺组织TNF-α、IL-12P40、IL-17A、IFN-γ、CXCL1、CXCL5和CXCL15表达水平大为降低,而最终呈现出小鼠肺、淋巴结、脾、肝等重要脏器的结核分枝杆菌载量较通路非抑制小鼠大幅升高,这些变化深刻表明p38 MAPK 通路在机体抗结核免疫中有着重要的作用。
从机体抗结核免疫的分子层面看,有研究揭示[12-13]:p38 MAPK 可重要影响分枝杆菌早期分泌蛋白ESAT6 诱导的小鼠巨噬细胞和肺上皮细胞巨噬细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)的表达水平,p38 MAPK 被抑制后MCP-1、TNF-α的表达水平明显降低。而MCP-1、TNF-α是结核病免疫和结核性肉芽肿形成过程中的重要分子[14],与本研究结果一致,即抑制p38 MAPK通路会降低感染机体的抗结核能力。YAO 等[1]的研究指出结核分枝杆菌Rv2346c 通过抑制通过p38/miRNA/NF-κB 途径产生的TNF-α和IL-6 来增强巨噬细胞内的分枝杆菌存活,则和本研究的观察组小鼠肺、淋巴结、脾、肝等重要脏器的结核分枝杆菌载量较对照小鼠大幅升高的结果相吻合。
对于结核病免疫,有学者归结为由巨噬细胞、中性粒细胞等发挥重要作用的固有免疫应答,以及由巨噬细胞和树突状细胞进行抗原提呈、众多细胞因子重要参与、各类淋巴细胞发挥免疫效应的适应性免疫应答[15-16]。从中可以看到中性粒细胞、巨噬细胞和各类淋巴细胞均重要参与其中,MOGUCHE 等[17]、GRANT 等[18]还指出淋巴细胞的分化路径也深刻影响机体抗结核免疫结局,本文观察组小鼠肺组织单核细胞、中性粒细胞、巨噬细胞、CD4+IFN-γ+T细胞在数量上大为减少的研究结果印证了这些结论。
另外,p38 MAPK 通路的抑制对小鼠抗结核作用的抑制涉及到小鼠肺、淋巴结、脾、肝等重要脏器,说明其影响是全身性的。本研究对小鼠肺组织的炎症细胞浸润情况和相关因子表达水平进行了较为深入地研究,基本阐明了小鼠肺脏结核分枝杆菌载量与其肺部免疫功能密切相关。但是,对于观察组小鼠淋巴结、脾、肝等器官的结核分枝杆菌的载量增加,是源自这些器官的免疫功能降低,还是因为肺组织结核分枝杆菌载量增加后细菌的繁殖扩张效应所致,则有待进一步的研究。
综上所述,结合笔者的前期研究[4],从p38 MAPK 通路激活与抑制两个相对的方面证实了该通路在抗结核免疫中的重要作用,这将为抗结核新疫苗的研发和抗结核新药的研制提供新的方向。

