漯河市农村妇女HLA抗原呈递通路相关基因多态性与宫颈高危型HPV感染相关性
张清伟 宋佳玉 孙明振 于江华 王慧芬 付秀虹
1漯河市中心医院妇产科(河南漯河462000);2漯河医学高等专科学校药学系(河南漯河462000)
高危型人乳头瘤病毒(human papilloma virus,HPV)感染是导致宫颈上皮内病变及宫颈癌的首要病因[1],但大多数的HPV感染为一过性,仅少部分高危型HPV 持续感染导致宫颈病变[2]。同时不同地区与不同人群之中感染的HPV型别也存在较大差别[3],具有区域性特点。因此寻找区域内与HPV感染和转归相关指标对预测HPV 预后、宫颈疾病发生有着重要的意义。
机体免疫状态、遗传易感性等因素可能是宿主感染HPV后转归的关键所在[4]。目前认为基因的单核甘酸多态性(polymorphisms,SNP)和特定SNP组合是影响疾病发生和转归的重要原因之一[5]。抗原呈递通路在病毒的免疫监视中具有重要地位,影响宿主免疫状态和疾病的发生、发展密切相关[6]。低分子量蛋白酶体(low molecular weight polypeptide,LMP)[7]、抗原处理相关转运体(transporter associated with antigen processing,TAP)[8]、人类白细胞抗原(human leukocyte antigen,HLA)DQ[9]做为HLA抗原呈递通路的关键位点,其基因位点的多态性影响宿主免疫状态且和多种病毒感染相关[10-12],但目前尚无与宫颈高危型HPV感染相关的报道。农村居住地人口相对稳定、人群间生活方式及遗传背景较一致,选择农村妇女为研究对象更能突出地域性特点。作者故选取我市农村妇女做为研究对象,检测相关位点并进行关联分析,探讨其相关性。
1 对象与方法
1.1 研究对象采用分层整群随机抽样法选取漯河市三区两县为抽样地区,按2016年农村适龄筛查女性人口比例分配各区(县)调查村庄数量,各区(县)随机整群抽取村庄,以该村所有适龄妇女作为筛查对象进行宫颈高危型HPV 筛查。纳入标准:年龄25~65岁,性生活史>3年;月经干净三天以上;取样前72 h 无性生活及阴道用药;排除标准:无性生活史;既往诊断有宫颈病变史;有免疫性疾病、移植、恶性肿瘤放疗史;子宫已切除。
根据前期调查结果[13],将年龄、文化程度、职业、家庭年收入、吸烟、是否绝经做为影响宫颈HPV感染的外部因素;感染组和对照组1∶1 配对,选择感染者和对照者各258例进行基因多态性研究。研究对象均签署知情同意书,研究获医院伦理委员会批准。
1.2 方法
1.2.1 HPV标本检测和问卷调查(1)对所有筛查对象均进行问卷调查。(2)由漯河市中心医院妇产科医生用专用HPV 采样器采集宫颈HPV 标本,按照15种型别HPV 测试剂盒(中生方政生物技术股份有限公司)说明书,采用恒温扩增-荧光法对15种高危型HPV(16、18、31、33、35、39、45、51、52、53、56、58、59、66和68)DNA 行半定量检测。根据HPV检测结果,以HPV 阳性者为感染组,阴性者为对照组。
1.2.2 血液样本采集所有筛查对象均采集静脉血5 mL,并用EDTA抗凝,于-80℃保存。
1.2.3 基因扩增及测序全血DNA提取按照takara试剂盒(大连宝生物工程有限公司)操作进行。引物由生工生物工程(上海)股份有限公司合成(表1)。PCR 扩增体系为20 μL 体系:DNA 模板2 μL(30 ng/μL),2×PCR Taq Mix 10 μL(takrar),上下游引物各0.5 μL(10 μm/μL),ddH2O7 μL。PCR 扩增条件:95℃3 min,98℃5 s,退火30 s,退火温度为56~63℃,72℃延伸40 s,共30个循环,最后72℃延伸10 min。2%琼脂糖凝胶电泳检测结果。产物送至通用生物(安徽)公司进行纯化,sanger 测序法测序。
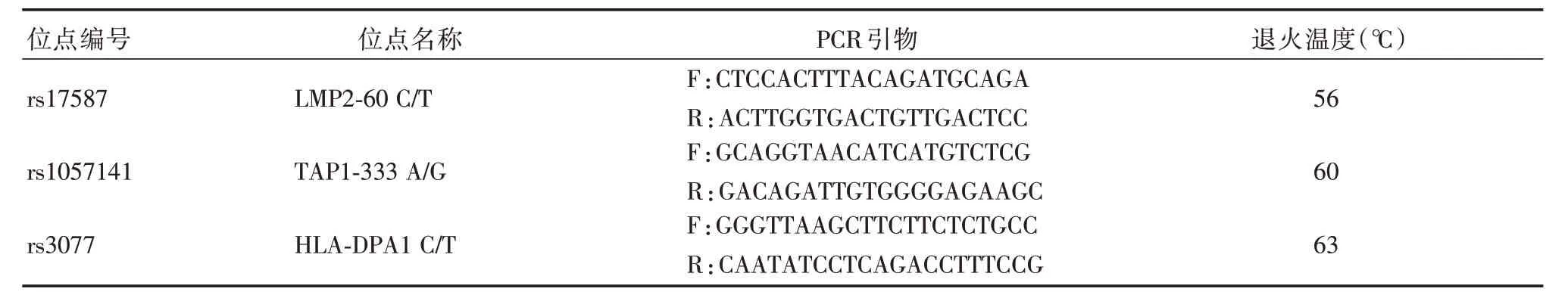
表1 设计引物Tab.1 Primer Design
1.3 统计学方法应用SPSS17.0 统计软件包进行统计分析,人口学特征采用卡方检验,感染组及对照组各位点基因型的遗传代表性采用Hardy-Weinberg 平衡定律检验,基因多态性及单倍体分析采用Logistic回归,单倍体的构建采用Haploview 软件,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较感染组和对照组两组间不同年龄、文化程度、职业、家庭年收入及是否吸烟、是否绝经的差异无统计学意义(P>0.05,表2)。
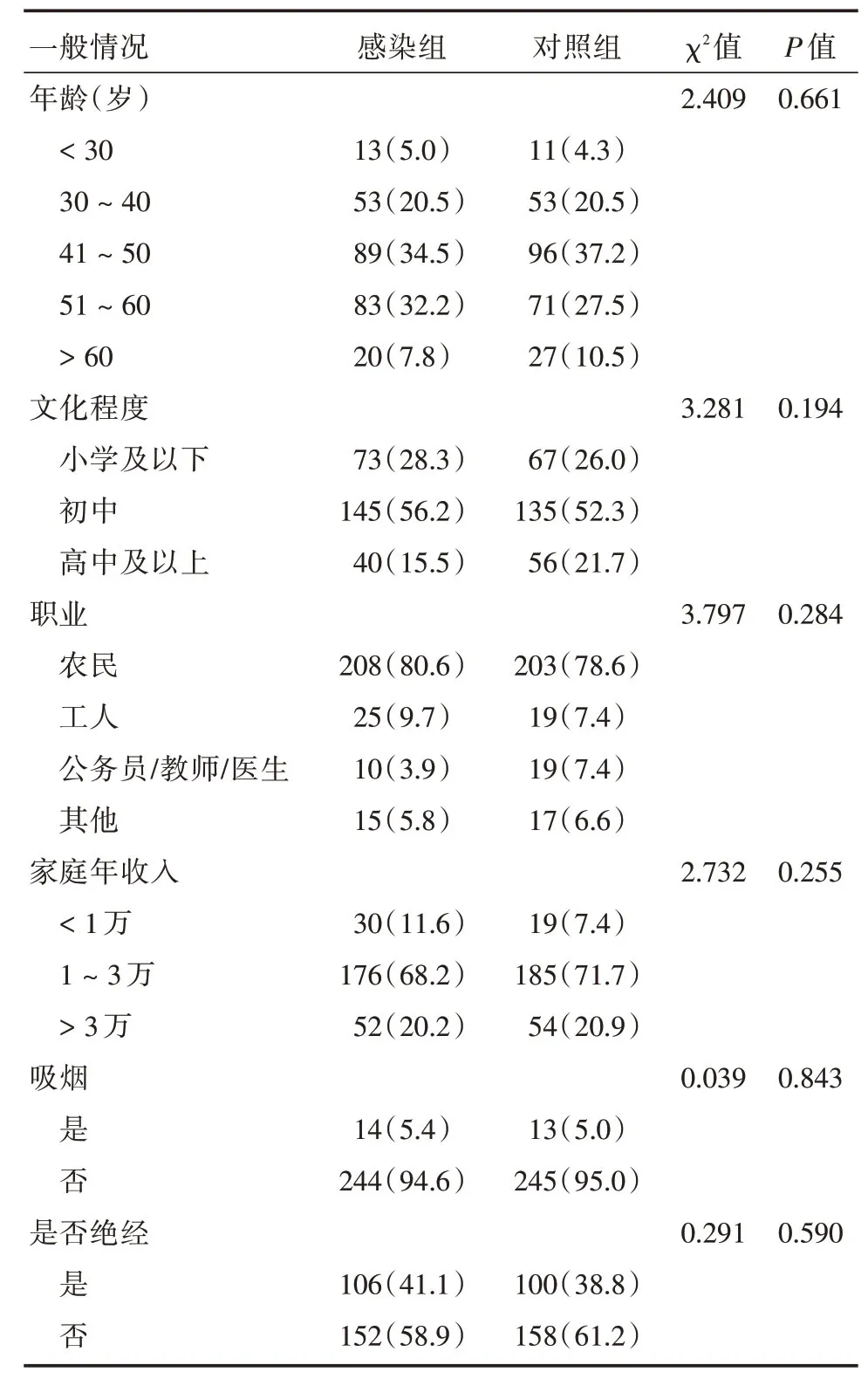
表2 研究对象基本特征比较Tab.2 The basic characteristics of the research object
2.2 TAP/LMP/HLA-DP多态性位点基因型结果TAPrs1057141、LMPrs17587、HLA-DPrs3077PCR扩增产物分别为430 bp、330 bp、796 bp,电泳图及多态位点测序结果见图1、2。
2.3 LMP/TAP/HLA-DP基因多态性分布情况经吻合度检验,TAP/LMP/HLA-DP 三位点的基因型分布在各组均符合Hardy Weinberg 平衡定律(感染组:P=0.421,对照组:P=0.288;感染组:P=1.002,对照组:P=0.283;感染组:P=0.064,对照组:P=0.927),各个基因型的期望值与观察值之间的差异均无统计学意义,所选取的样本具有可靠性和群体代表性。
logistic回归结果显示HLA-DPrs3077多态纯合型TT 在对照组中出现的频率明显低于感染组(P<0.05,OR=3.667,95%CI:2.320~5.799),提示多态纯合基因型TT可能增加个体宫颈高危型HPV易感性,而杂合基因型CT可能是保护性因素(P<0.05,OR=0.306,95%CI:0.189~0.496);LMPrs17587多态纯合型TT 在对照组中出现的频率明显高于感染组(P<0.05,OR=0.419,95%CI:0.194~0.904),提示多态纯合基因型TT可能为保护因素,可能会降低个体宫颈高危型HPV易感性;TAP rs1057141 杂合基因型和多态纯合基因型的频率与各自的野生纯合基因型频率差异无统计学意义(P>0.05,表3)。
2.4 LMP/TAP单倍型分析与HPV的易感性连锁不平衡分析LMP rs17587、TAP rs1057141位点间呈连锁不平衡关系(D′=0.772,r2=0.044),见图3。单倍型分析发现:常见的单倍体型为AC,四种单倍体型在两组间的分布差异无统计学意义(P>0.05,表4)。
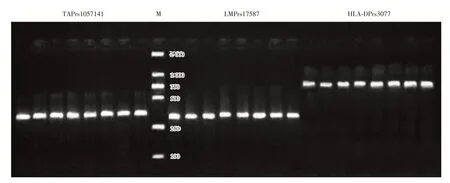
图1 LMP/TAP/HLA-DP PCR 扩增产物电泳图Fig.1 Eelectrophoretogram of PCR products of locus TAPrs1057141,LMPrs17587,HLA-DPrs3077
3 讨论
图2 LMP/TAP/HLA-DP 基因位点测序图Fig.2 Direct sequencing graph of locus TAPrs1057141、LMPrs17587 and HLA-DPrs3077
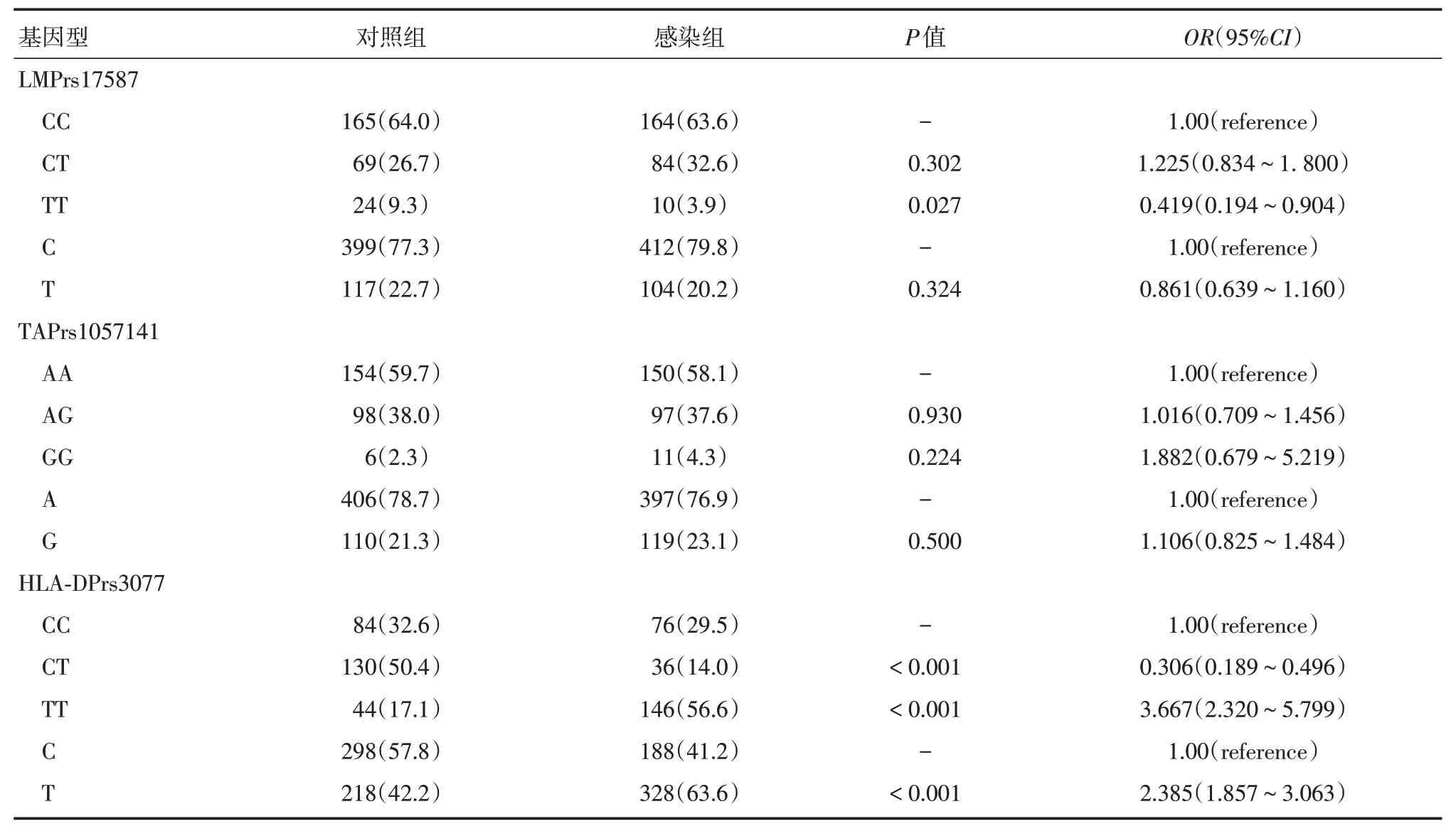
表3 漯河市农村妇女LMP/TAP/HLA-DP 基因多态性分布情况Tab.3 Comparison of polymorphism distribution of locus TAPrs1057141,LMPrs17587 and HLA-DPrs3077 gene in rural women in Luohe city例(%)
宫颈是否感染HPV是内外因共同作用的结果,与环境、生活方式、免疫、遗传等相关[14-16]。目前关于基因多态性和HPV感染的相关性的研究较少且未排除HPV感染的外部因素[17-19]。为减少外部影响因素,使影响HPV感染和转归的内因得到展现,作者根据前期研究[13],从年龄、文化程度、职业、年家庭收入、吸烟、是否绝经6个方面将感染组和对照组进行匹配,使两组在外因方面的差异无统计学意义(P>0.05)。河南省是传统的农业大省,漯河市尤其是农村人口流动性小,遗传背景较为一致,研究对象更符合HPV感染和基因多态性的地域性特点。
图3 LMP/TAP/HLA-DP 基因3个位点之间连锁不平衡分析结果Tab.3 Association between locus TAPrs1057141、LMPrs17587 and HLA-DPrs3077 detected by linkage disequilibrium analysis
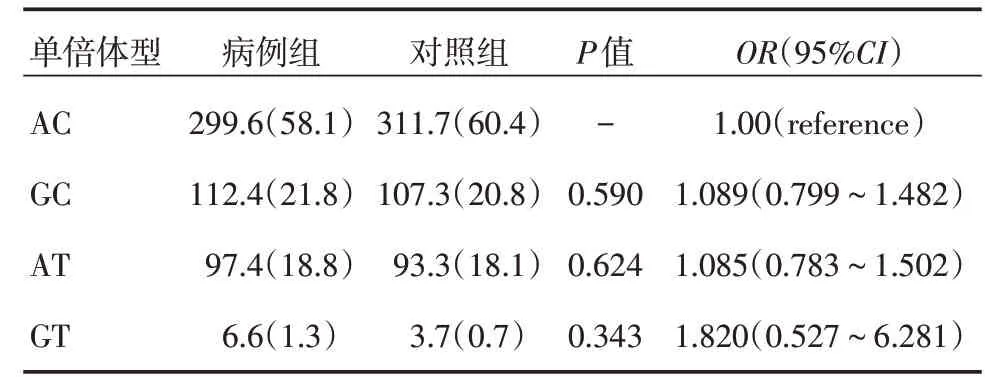
表4 LMP/TAP 单倍型分析与HPV的易感性关系Tab.4 Relationship between genotype of locus TAPrs1057141 and LMPrs17587 gene in cervical high-risk HPV infection group and healthy control例(%)
HPV 入侵宫颈上皮细胞以后作为抗原,主要通过抗原呈递通路启动免疫应答,引起T细胞对抗原的识别和清除,其免疫应答的强弱与HPV感染的预后密切相关[20]。在抗原呈递通路中LMP 参与内源性抗原加工,其蛋白将抗原降解为5~15个氨基酸的短肽以便与HLA 相结合[21-22],LMP rs17587基因多态性和宫颈癌发病具有相关性[23],但尚不清楚是否和宫颈HPV感染。作者首次对河南省漯河市农村妇女进行LMP rs17587基因多态性检测,并进行易感性关联分析。结果提示LMPrs17587多态纯合型TT可能为保护因素,降低宫颈高危型HPV感染的概率(P<0.05,OR=0.419,95%CI:0.194~0.904)。相关TAP分子参与内源性多肽的转运,借助于MHC-I分子可促进抗原呈递通路对HPV的识别和清除[24]。MENG 等[25]研究发现
TAP1-rs1135216、TAP1-rs4148873、TAP2-rs2228396、TAP2-rs241447和TAP2-rs4148873 可能和肿瘤发病无关,而TAP2-rs4148876含T等位基因可能是一个癌症发病的高危因素[25]。本研究结果TAP rs1057141杂合基因型和多态纯合基因型的频率与各自的野生纯合基因型频率差异无统计学意义,提示其对漯河市农村妇女宫颈是否会感染高危型HPV 无影响(P>0.05)。HLA-II 类分子参与外源性抗原的呈递,具有高度多态性,而特定的HLA 等位基因产物对所提呈的抗原有一定的选择性[26]。HLA的基因多态性是否影响宫颈感染HPV后的抗原提呈尚不清楚,本研究选择HLA-DPrs3077 等位基因分析研究发现含有T 等位基因的宫颈高危型HPV易感性是含C等位基因的2.385倍(P<0.05,OR=2.385,95%CI:1.857~3.063),提示HLA-DPrs3077C 等位基因是HPV感染的高危因素。
因此HLA-DPrs3077和LMPrs17587基因多态性可能与河南省漯河市农村妇女宫颈高危型HPV感染相关,而TAP rs1057141 不相关。为了进一步的探讨TAPrs1057141、LMP rs17587基因多态性和高危HPV易感性的关系,本研究构建并分析了LMP/TAP 单倍型。研究发现LMP与TAP位点的虽存在连锁不平衡关系但较弱(D′=0.772,r2=0.044),不同单倍体型并不会对高危HPV感染产生影响(P>0.05)。可能与样本量偏少有关有必要扩大样本量,进一步明确其易感性。
综上所述,我们首次发现LMP rs17587、HLADPrs3077基因多态性与河南省漯河市农村妇女高危HPV感染具有相关性,但TAP rs1057141 与其不相关。为进一步研究LMP、HLA-DP与宫颈高危HPV感染和HPV 转归,筛查HPV感染和宫颈疾病发病高危人群提供了研究基础和思路。但本研究仅仅研究LMPrs17587、TAP rs1057141、HLADPrs3077基因多态性与高危型HPV感染的关系,未能进一步细化与HPV16、18及其他HPV 高危亚型的关系,削弱了临床指导价值,有必要进一步细化研究方案。LMP与TAP位点的连锁不平衡关系较弱,不同单倍体型之间不存在差异,可能LMP与TAP 对高危型HPV感染并非仅仅与LMP rs17587、HLA-DPrs3077 两个基因位点多态性有关,有必要进一步其他相关基因多态性位点,并在发生机制方面等进行研究。

