不同时期干旱胁迫对甘薯生长和渗透调节能力的影响
张海燕 汪宝卿 冯向阳 李广亮 解备涛 董顺旭 段文学,* 张立明
不同时期干旱胁迫对甘薯生长和渗透调节能力的影响
张海燕1,**汪宝卿1,**冯向阳2李广亮3解备涛1董顺旭1段文学1,*张立明4,*
1山东省农业科学院作物研究所/ 农业农村部黄淮海薯类科学观测实验站/ 特色作物山东省工程实验室, 山东济南 250100;2昌乐县农业农村局, 山东昌乐 262400;3邹城市张庄镇农技站, 山东邹城 273507;4山东省农业科学院, 山东济南 250100
在人工控水条件下, 以抗旱品种济薯21和不抗旱品种济紫薯1号为试验材料, 每个品种设全生育期正常灌水(WW, 对照)、发根分枝期干旱胁迫(DS1)、蔓薯并长期干旱胁迫(DS2)、快速膨大期干旱胁迫(DS3) 4个水分处理, 研究不同时期干旱胁迫对甘薯生长和渗透调节能力的影响。结果表明, 干旱胁迫导致甘薯鲜薯产量显著下降, 不同时期干旱胁迫比较, 以发根分枝期干旱胁迫(DS1)下降幅度最大, 品种间比较, 以不抗旱品种下降幅度最大。从3年平均数据来看, DS1处理, 济薯21和济紫薯1号的鲜薯产量分别比对照降低28.59%和38.77%; DS2处理分别比对照降低25.20%和33.50%; DS3处理分别比对照降低14.55%和19.56%。干旱胁迫导致甘薯生物量显著下降, 栽后100 d, DS1、DS2、DS3的地上部生物量与对照相比, 济薯21分别降低32.68%、20.79%、11.72%, 济紫薯1号分别降低46.45%、31.89%、18.43%; 地下部生物量与对照相比, 济薯21分别降低37.69%、25.86%、10.67%, 济紫薯1号分别降低54.34%、33.48%、14.20%。干旱胁迫条件下, 甘薯功能叶相对含水量下降, 功能叶、纤维根和块根中的可溶性糖、可溶性蛋白、游离氨基酸总量和脯氨酸等渗透调节物质含量均上升, 干旱胁迫时间越早, 下降或升高的幅度越大。前期干旱胁迫对渗透调节能力的影响无法在复水后得到有效恢复, 而后期干旱胁迫对渗透调节能力的影响可在复水后恢复到对照水平。
甘薯; 干旱胁迫; 渗透调节能力
甘薯是重要的粮食、饲料和工业原料作物, 因其适应性强、抗旱耐瘠薄, 多数种植在半干旱地区。近年来, 随着全球气候变暖, 干旱频繁发生, 发根缓苗期和块根膨大期等生育关键期干旱已成为甘薯产量和品质提高的主要限制因子[1-2]。已有研究认为, 干旱胁迫抑制了甘薯叶片、茎蔓和根系的生长, 导致甘薯块根产量下降, 以发根分枝期干旱胁迫下降幅度最大[2]。针对不同程度和不同时期干旱胁迫对甘薯生长的影响, 前人已进行了大量研究, 认为重度干旱胁迫增加了土壤机械阻力, 影响了根系对养分的吸收, 限制了块根的膨大, 导致甘薯块根生长和干物质积累下降[3]。前期和中期干旱胁迫均显著降低了甘薯地上部和地下部的生物量, 影响了不定根的分化, 导致块根形成的数目减少, 不同时期干旱胁迫对甘薯生物量的影响为前期>中期>后期, 甘薯水分临界期处于前中期[4-5]。
干旱胁迫条件下, 作物在生理代谢方面产生一系列的适应性调节反应, 以抵御干旱胁迫, 渗透调节是作物忍耐和抵御干旱胁迫的重要生理机制之一[6]。探讨干旱胁迫条件下作物的渗透调节机制对于抗旱品种选育及其配套栽培技术研究具有重要意义。已有研究[7-9]认为, 干旱胁迫条件下, 作物通过大量积累渗透调节物质, 让细胞膨压维持在正常范围内, 脯氨酸、游离氨基酸、K+、可溶性糖等物质参与作物的渗透调节。作物不同生育时期渗透调节能力不同, 水分敏感时期渗透调节物质上升幅度大。不同器官渗透调节物质增加的幅度也不同, 小麦和水稻叶片的渗透调节能力大于根系, 且以可溶性糖最高, 其次是游离氨基酸和脯氨酸。甘薯在轻度水分胁迫后, 叶片脯氨酸和K+反应较敏感, 其次为可溶性糖与游离氨基酸, 且品种抗旱性越强, 渗透调节物质积累越多[10-11]。逆境条件下, 渗透调节物质维持着细胞膨压和组织保水能力[12-14], 脯氨酸作为酶和细胞大分子相容性较高的渗压剂, 在渗透胁迫下可降低植物组织渗透势, 并在稳定细胞形态中起重要作用, 具有抗旱、抗病和高干等优良性状的甘薯近缘野生种幼苗随着干旱胁迫时间的延长, 游离脯氨酸呈递增趋势[15]; 游离氨基酸以细胞质渗透调节物质维持细胞内膜系统的主动代谢; 可溶性糖可降低渗透势, 且与可溶性蛋白的热稳定性有关[10], 随着干旱胁迫程度的增加, 甘薯叶片可溶性糖和可溶性蛋白呈先升高后降低的变化规律[16]。重度干旱胁迫时, 细胞膜失去完整性, 渗透调节物质积累, 有利于清除自由基和活性氧, 降低细胞渗透势, 增强叶片的保水能力, 维持正常的光合速率, 而渗透调节物质又来自光合作用, 二者相辅相成[17]。干旱胁迫条件下, 甘薯叶片的光合性能下降, 导致渗透调节物质下降, 抗旱品种的渗透调节物质含量高于不抗旱品种, 因此抗旱品种可在低水势下维持叶片的生理功能和气孔导度, 有利于保持较高的电子传递能力和RUBP羧化酶活性, 从而维持较高的光合速率[18-19]。总之, 在植物抗旱性机制研究方面, 渗透调节能力已被广泛应用, 但在甘薯抗旱性研究中, 多集中在苗期叶片渗透调节能力对干旱胁迫的响应, 针对不同时期干旱胁迫, 研究甘薯功能叶、纤维根和块根渗透调节能力对干旱胁迫响应机制尚未见报道。目前, 选育节水抗旱的甘薯品种, 优化配套栽培管理措施已成为甘薯水分高效利用和优质高产高效的重要途径。前人将甘薯大田生长过程划分为发根分枝期(栽插至栽插后30 d)、蔓薯并长期(栽插后30~60 d)和块根快速膨大期(栽插后60~90 d) 3个时期, 认为发根分枝期干旱胁迫导致薯苗发根延迟, 造成缺苗断垄; 蔓薯并长期干旱胁迫茎叶生长缓慢, 光合产物合成和积累减少, 块根生长缓慢; 块根快速膨大期干旱胁迫植株早衰, 块根增长减缓[20]。因此, 本试验通过研究不同时期干旱胁迫对甘薯生长和渗透调节能力的影响, 期望阐明干旱胁迫导致甘薯减产的生理机制, 为节水抗旱品种的选育和干旱地区甘薯生产提供理论依据。
1 材料与方法
1.1 试验设计
试验于2013—2015年在山东省农业科学院防雨旱棚内进行, 抗旱池(长×宽= 6 m× 4 m, 深为2 m)四周水泥, 底部开放。以抗旱品种济薯21 (国品鉴甘薯2007001号)和不抗旱品种济紫薯1号(国品鉴甘薯2015009号)为试验材料, 每个品种设全生育期正常灌水(WW, 对照)、发根分枝期干旱胁迫(DS1)、蔓薯并长期干旱胁迫(DS2)、快速膨大期干旱胁迫(DS3) 4个土壤水分处理(表1), 随机区组设计, 每处理重复3次。栽插时间分别为2013年6月10日、2014年6月12日和2015年6月11日, 栽插密度为57,145株hm–2, 小区面积24 m2, 每小区种植137株, 收获时间分别为10月9日、10月11日和10月10日收获, 生育期均为122 d。采用测墒补灌的方法给抗旱池补充水分, 每隔5~7 d灌水一次。干旱胁迫处理的抗旱池在胁迫前7 d停止灌水。
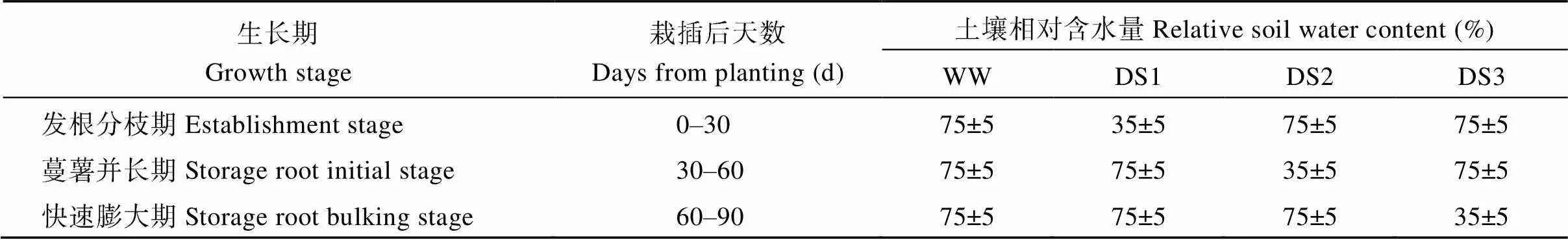
表1 不同时期的土壤相对含水量
全生育期正常灌水为对照(WW), 其他为干旱胁迫处理, 胁迫时期分别是发根分枝期(DS1)、蔓薯并长期(DS2)和快速膨大期(DS3)。
Well-watered treatment at whole stage was conducted as the control (WW), three drought treatments were establishment stage (DS1), storage root initial stage (DS2), and storage root bulking stage (DS3), respectively.
1.2 测定项目及方法
1.2.1 鲜薯产量测算方法 收获时进行小区测产,获得小区块根鲜薯产量, 计算获得单位面积的鲜薯产量。
1.2.2 田间取样方法 栽后40 d (蔓薯并长期)、60 d (蔓薯并长期)、80 d (块根快速膨大期)和100 d (块根快速膨大期), 连续选取代表性植株5株, 称重后对植株进行分样保存, 取主茎倒四叶, 锡箔纸包装, 编号后放置液氮, 留取部分样品烘干。将整个根系用蒸馏水冲洗干净, 用吸水纸吸干表面水分, 将纤维根和块根分类取样, 用锡箔纸包好, 编号后放置液氮, 留取部分样品烘干。将烘干样品常温保存用于可溶性糖含量测定, 将液氮速冻样品放入-80℃超低温冰箱中保存, 用于其他渗透调节物质含量测定。
1.2.3 地上部和地下部生物量测算方法 称量植株地上部和地下部鲜重, 取平均值, 获得单株地上部和地下部生物量。
1.2.4 功能叶相对含水量测定方法 取主茎倒四叶, 采用称重法[21]分别称取鲜重(fresh weight, Wf)、饱和重(saturated weight, Wt)和干重(dry weight, Wd), 叶片相对含水量(leaf relative water content, LWC)(%) = (Wf-Wd)/(Wt-Wd)×100%。
1.2.5 功能叶、纤维根和块根渗透调节物质测定方法 采用蒽酮比色法[22]测定可溶性糖含量, 称取烘干磨碎样品0.5000 g (W), 置10 mL离心管中, 加入6 mL水, 置沸水浴中加热提取20 min, 冷却后离心5 min (4000´), 转移上清液于50 mL容量瓶中, 重复提取, 合并上清液, 定容至刻度(V)。准确吸取提取液100 µL (A), 加入3 mL蒽酮试剂, 沸水浴10 min, 冷却后620 nm比色, 标准曲线求得糖量(C)。可溶性糖含量(% DW) = [(C×V/A)/(W× 106)]×100。
采用考马斯亮蓝法[22]测定可溶性蛋白含量, 称取0.5 g (W)样品放入研钵中, 加5 mL磷酸缓冲液(pH 7.8), 冰浴研磨, 匀浆倒入离心管, 冷冻离心20 min (10,000´), 测定上清液体积(V)。20 µL酶液(VS)+3 mL考马斯亮蓝G-250放置2 min, 595 nm比色(20 µL缓冲液+3 mL G-250为空白对照), 标准曲线求得提取液中的可溶性蛋白浓度(C)。可溶性蛋白质含量(mg g-1FW) = (C×V)/(W×VS×1000)。
采用茚三酮比色法测定[22]游离氨基酸含量, 称取新鲜样品0.5 g (W), 放入研钵加5 mL 10%乙酸研磨成糊状物, 转入50 mL容量瓶, 用无氨蒸馏水定容, 上清液过滤入三角瓶, 滤液为氨基酸提取液(V)。取提取液1 mL (Va), 加3 mL茚三酮-缓冲液, 再加入0.1 mL 0.3%的抗坏血酸, 充分摇匀, 沸水浴显色15 min, 间歇摇动冷却15 min, 加60%乙醇补充至5 mL, 在570 nm波长处测定吸光度, 标准曲线求得氨基酸含量(C)。游离氨基酸含量(μg g-1FW) = C×V/Va/W。
采用比色法测定[22]脯氨酸含量, 称取新鲜样品0.5 g (W), 置大试管中, 加入5 mL 3%的磺基水杨酸溶液, 沸水浴10 min, 冷却后过滤, 滤液为脯氨酸提取液(V)。吸取2 mL (Va)提取液, 加入冰醋酸和酸性茚三酮溶液各2 mL, 沸水浴中加热30~40 min, 冷却后加入4 mL甲苯, 震荡0.5 min, 静置, 取上层液, 离心5 min (3000´), 在520 nm波长处测定吸光度, 标准曲线求得脯氨酸含量(C)。脯氨酸含量(μg g-1FW) = C×V/Va/W。
1.3 数据处理与分析
采用Microsoft Excel 2010分析数据并作图, 采用DPS v8.01版数据处理系统进行方差分析和差异显著性检验。本试验采用3年试验数据, 方差分析结果表明, 各指标及其与年份间的互作不显著(< 0.05), 因此, 均采用3年的平均值进行分析。
2 结果与分析
2.1 不同时期干旱胁迫对甘薯生长的影响
2.1.1 鲜薯产量 由表2可知, 不同时期干旱胁迫均导致甘薯鲜薯产量下降, 两品种均以发根分枝期(DS1)下降幅度最大, 其次是蔓薯并长期(DS2)和块根快速膨大期(DS3)。品种间比较, 同一时期干旱胁迫, 抗旱品种鲜薯产量下降的幅度均小于不抗旱品种, 济薯21和济紫薯1号DS1处理的鲜薯产量分别比对照降低28.59%和38.77%, DS2处理分别比对照降低25.20%和33.50%, DS3处理分别比对照降低14.55%和19.56%。
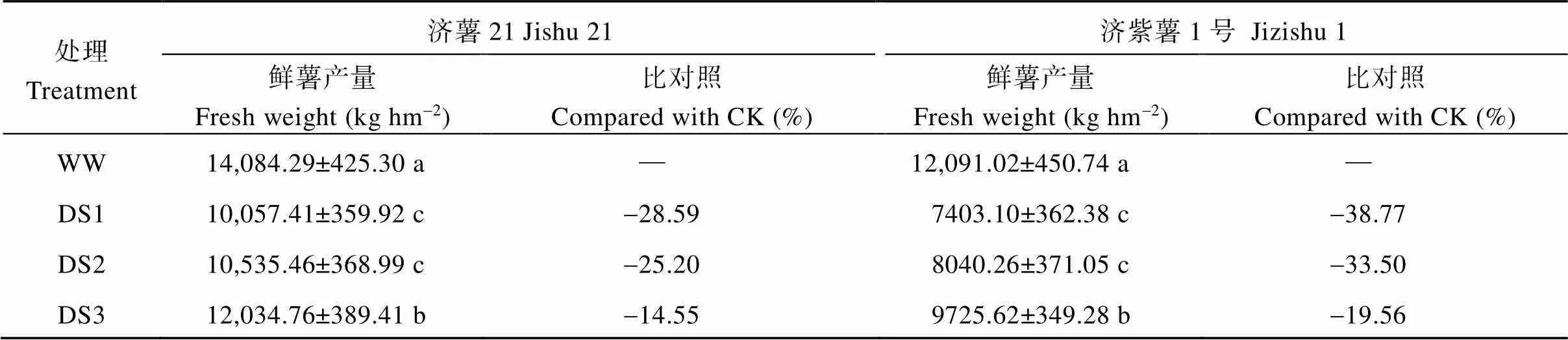
表2 不同时期干旱胁迫对甘薯鲜薯产量的影响
数据为3年的平均值±标准差。同列数据不同字母表示差异显著(<0.05)。处理同表1。
Data are the means ± standard deviation for three years. Values followed by different letters in the same column mean significantly different at<0.05. Treatments are the same as those given in Table 1.
2.1.2 地上部生物量 由表3可知, 不同时期干旱胁迫均导致甘薯地上部生物量下降, 两品种均以发根分枝期干旱胁迫(DS1)下降幅度最大, 其次是蔓薯并长期(DS2)和块根快速膨大期(DS3)。品种间比较, 抗旱品种济薯21下降幅度小于不抗旱品种济紫薯1号, 栽后100 d, DS1、DS2、DS3的地上部生物量与对照相比, 济薯21分别降低32.68%、20.79%、11.72%, 济紫薯1号分别降低46.45%、31.89%、18.43%。
2.1.3 地下部生物量 由表3可知, 不同时期干旱胁迫比较, 地下部生物量在各时期均表现出DS3 > DS2 > DS1, 发根分枝期对干旱胁迫最敏感, 地下部生物量最低。品种间比较, 济薯21和济紫薯1号在栽后100 d, DS1的地下部生物量分别比对照降低37.69%和54.34%, DS2处理的分别降低25.86%和33.48%, DS3处理的分别降低10.67%和14.20%, 以抗旱品种地下部生物量下降的幅度最低。
2.1.4 功能叶相对含水量 从图1可以看出, 不同时期干旱胁迫均导致甘薯功能叶相对含水量下降, 两品种变化趋势一致, 与对照相比, 均以DS1处理降低幅度最大, 其次为DS2和DS3。品种间比较, 栽后100 d, DS1、DS2、DS3与对照相比, 抗旱品种济薯21的功能叶相对含水量分别降低21.36%、11.55%、3.27%, 不抗旱品种济紫薯1号分别降低26.41%、14.79%、4.43%, 不抗旱品种功能叶相对含水量下降幅度高于抗旱品种。

表3 不同时期干旱胁迫对甘薯地上部和地下部生物量的影响
数据为3年的平均值±标准差。同列数据不同字母表示差异显著(<0.05)。处理同表1。
Data are the means of three years ± standard deviation. Different letters in the same column mean significantly different at<0.05. Treatments are the same as those given in Table 1.
2.2 不同时期干旱胁迫对甘薯功能叶渗透调节物质的影响
2.2.1 可溶性糖含量 正常灌水条件下, 两品种功能叶可溶性糖的变化趋势均呈单峰曲线, 济薯21的峰值出现在栽后60 d, 济紫薯1号峰值出现在栽后80 d。干旱胁迫可导致功能叶可溶性糖含量增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小(图2)。说明干旱胁迫时间越早, 持续时间越长对甘薯功能叶可溶性糖的影响越大。
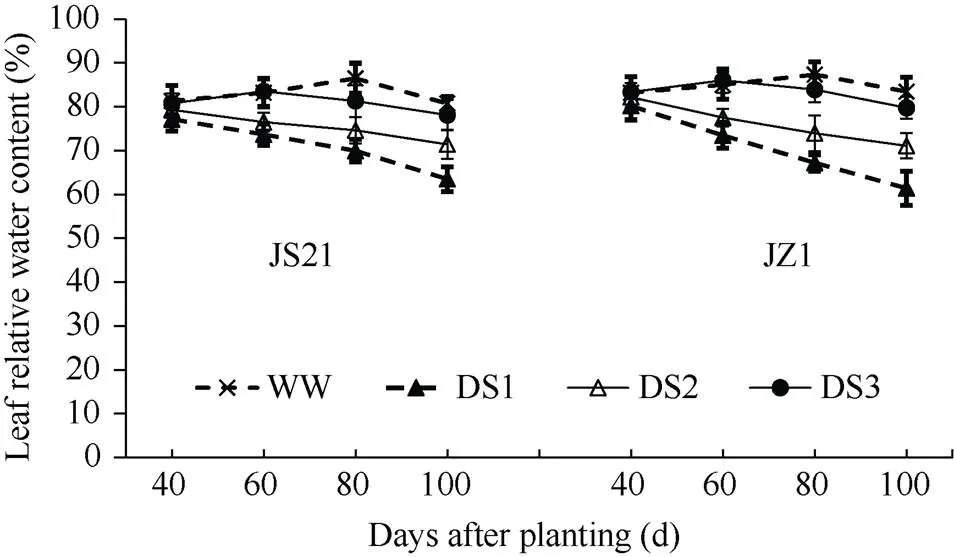
图1 不同时期干旱胁迫对甘薯功能叶相对含水量的影响
JS21: 济薯21; JZ1: 济紫薯1号。误差线表示3次重复的标准差。处理同表1。
JS21: Jishu 21; JZ1: Jizishu 1. Error bars show the standard deviations of three replicates. Treatments are the same as those given in Table 1.
2.2.2 可溶性蛋白含量 在正常灌水条件下, 甘薯功能叶可溶性蛋白含量呈单峰曲线, 两品种的峰值均出现在栽后80 d。干旱胁迫导致功能叶可溶性蛋白含量增加, 且随着干旱胁迫时间的延长, 可溶性蛋白含量持续增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小(图2)。
2.2.3 游离氨基酸总量 功能叶游离氨基酸含量在全生育期的变化趋势呈单峰曲线, 两品种所有处理的变化趋势一致, 均在栽后80 d达到峰值。干旱胁迫导致功能叶游离氨基酸含量增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小(图2)。
2.2.4 脯氨酸含量 正常灌水条件下, 甘薯功能叶脯氨酸含量较低, 且在各生育期差异不显著。干旱胁迫导致功能叶脯氨酸含量迅速增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小, 抗旱品种济薯21的功能叶脯氨酸含量与对照相比, 增加的幅度大于不抗旱品种济紫薯1号(图2)。说明干旱胁迫时间越早, 持续时间越长对甘薯功能叶脯氨酸含量的影响越大, 抗旱品种积累的脯氨酸量高于不抗旱品种。
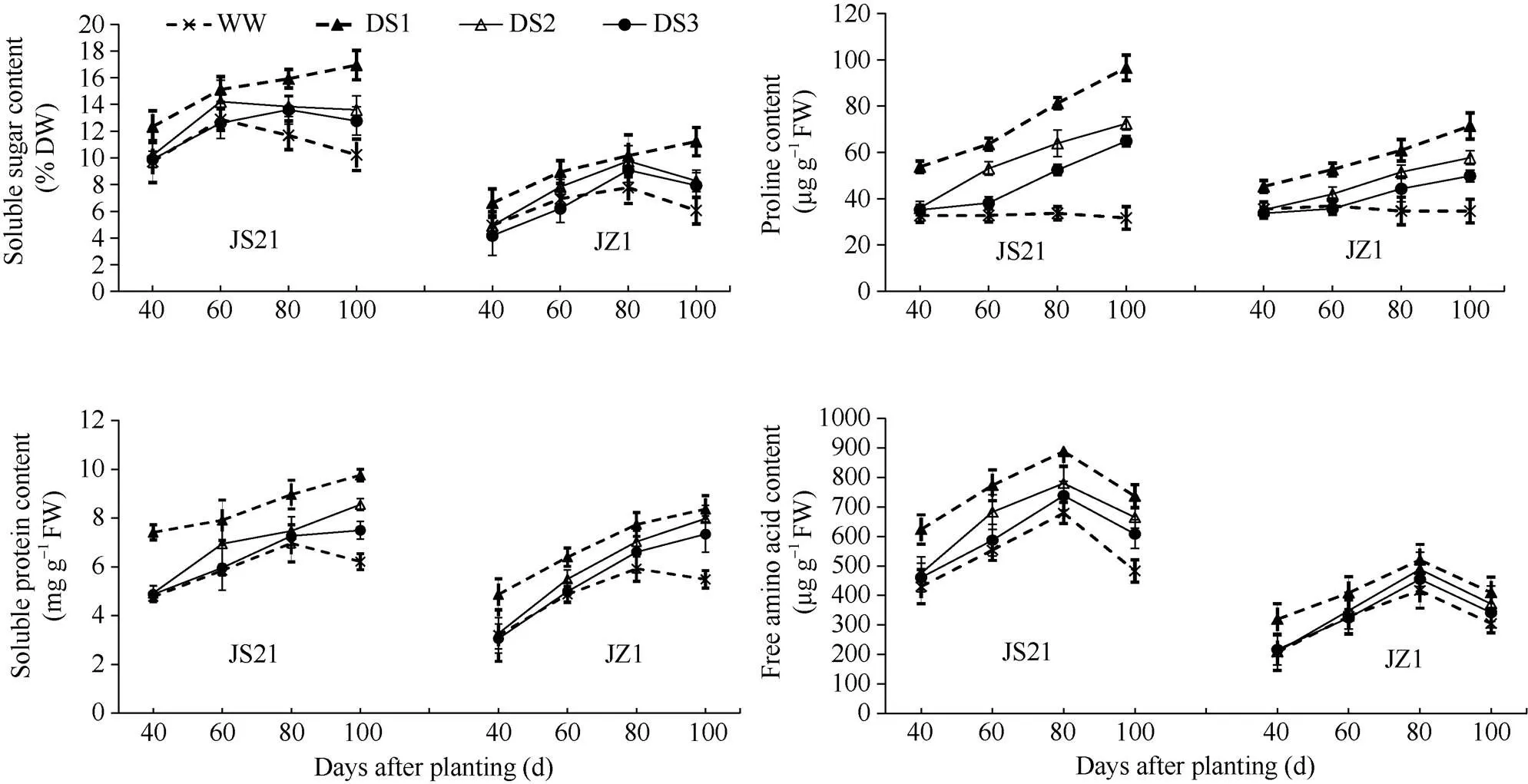
图2 不同时期干旱胁迫对甘薯功能叶可溶性糖、可溶性蛋白、游离氨基酸和脯氨酸含量的影响
JS21: 济薯21; JZ1: 济紫薯1号。误差线表示3次重复的标准差。处理同表1。
JS21: Jishu 21; JZ1: Jizishu 1. Error bars show the standard deviations of three replicates. Treatments are the same as those given in Table 1.
2.3 不同时期干旱胁迫对甘薯纤维根渗透调节物质的影响
2.3.1 可溶性糖含量 正常灌水条件下, 两品种纤维根可溶性糖的变化趋势均呈先降低后升高的趋势, 最低值均出现在栽后60 d。干旱胁迫导致纤维根可溶性糖含量增加, DS1增加幅度最大, 其次为DS2。DS3的纤维根可溶性糖含量在栽后40~80 d与对照差异不显著, 栽后100 d, 干旱胁迫处理DS3的纤维根可溶性糖含量显著高于对照(图3)。说明干旱胁迫时间越早, 持续时间越长, 对甘薯纤维根可溶性糖含量的影响越大。
2.3.2 可溶性蛋白含量 两品种各处理的纤维根可溶性蛋白含量在全生育期均呈持续增加的趋势。干旱胁迫导致纤维根可溶性蛋白含量增加, DS1升高幅度最大, 其次为DS2, DS3增加幅度最小。抗旱品种济薯21纤维根可溶性蛋白含量与对照相比, 增加的幅度高于不抗旱品种济紫薯1号(图3)。
2.3.3 游离氨基酸总量 纤维根游离氨基酸含量在全生育期的变化趋势呈单峰曲线, 两品种变化趋势一致, 正常灌水条件下, 峰值出现在栽后60 d, 干旱胁迫条件下, 峰值出现在栽后80 d。干旱胁迫导致纤维根游离氨基酸含量增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小。抗旱品种济薯21纤维根游离氨基酸含量与对照相比, 增加的幅度高于不抗旱品种济紫薯1号。
2.3.4 脯氨酸含量 正常灌水条件下, 纤维根脯氨酸含量较低, 且在各生育期差异不显著。干旱胁迫导致纤维根脯氨酸含量迅速增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小。抗旱品种济薯21纤维根脯氨酸含量与对照相比, 增加的幅度高于不抗旱品种济紫薯1号(图3)。说明干旱胁迫时间越早, 持续时间越长对甘薯纤维根脯氨酸含量的影响越大, 抗旱品种积累的脯氨酸量高于不抗旱品种。
2.4 不同时期干旱胁迫对甘薯块根渗透调节物质的影响
2.4.1 可溶性糖含量 正常灌水条件下, 两品种块根可溶性糖的变化趋势均呈先降低后升高的趋势, 最低值均出现在栽后80 d。干旱胁迫导致块根可溶性糖含量增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小(图4)。块根可溶性糖含量相对较高, 说明已具备一定的渗透调节能力, 因此干旱胁迫对其影响相对较小, 品种间块根可溶性糖含量与对照相比, 增加的幅度差异也不显著。
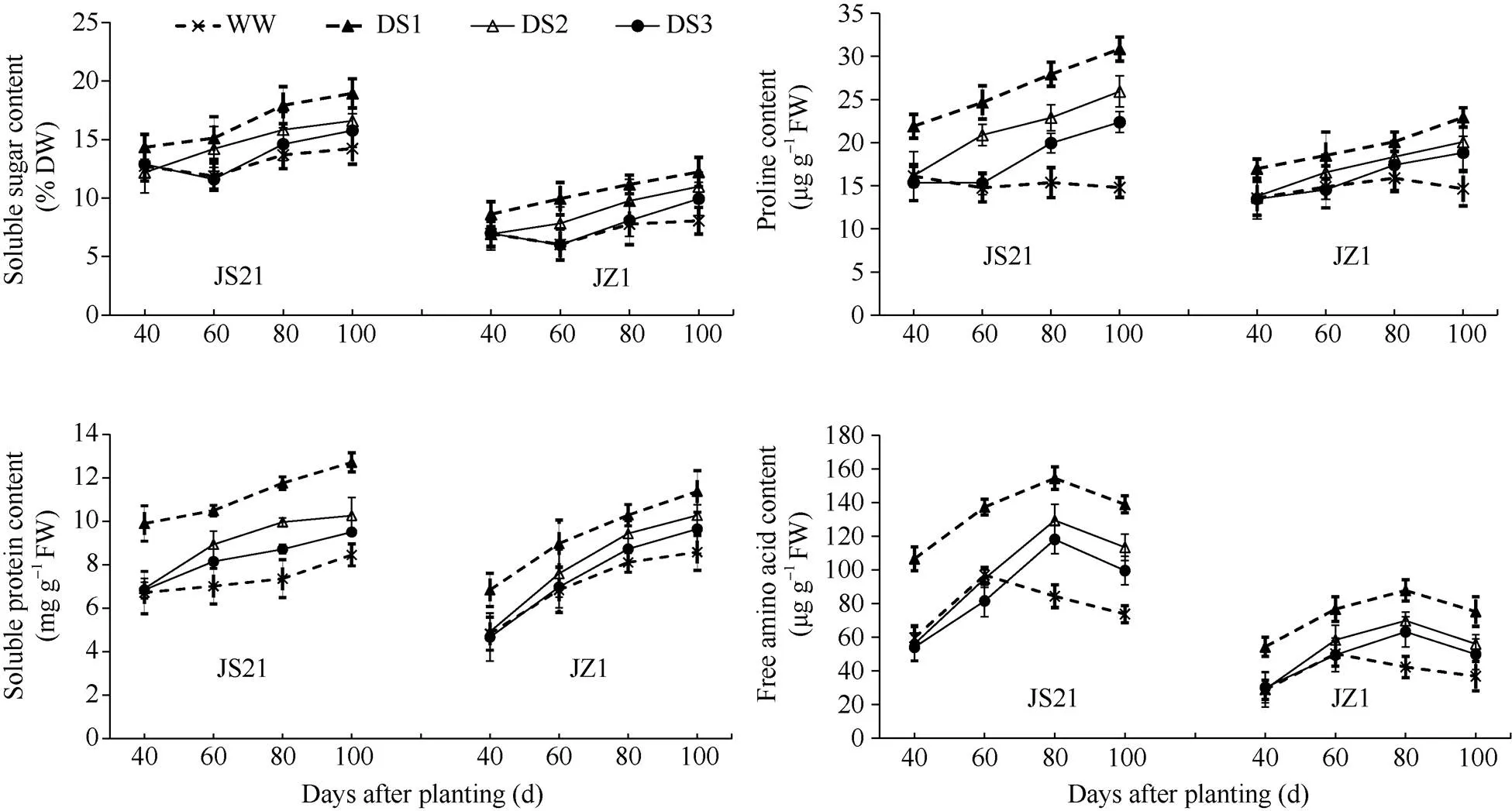
图3 不同时期干旱胁迫对甘薯纤维根可溶性糖、可溶性蛋白、游离氨基酸和脯氨酸含量的影响
JS21: 济薯21; JZ1: 济紫薯1号。误差线表示3次重复的标准差。处理同表1。
JS21: Jishu 21; JZ1: Jizishu 1. Error bars show the standard deviations of three replicates. Treatments are the same as those given in Table 1.
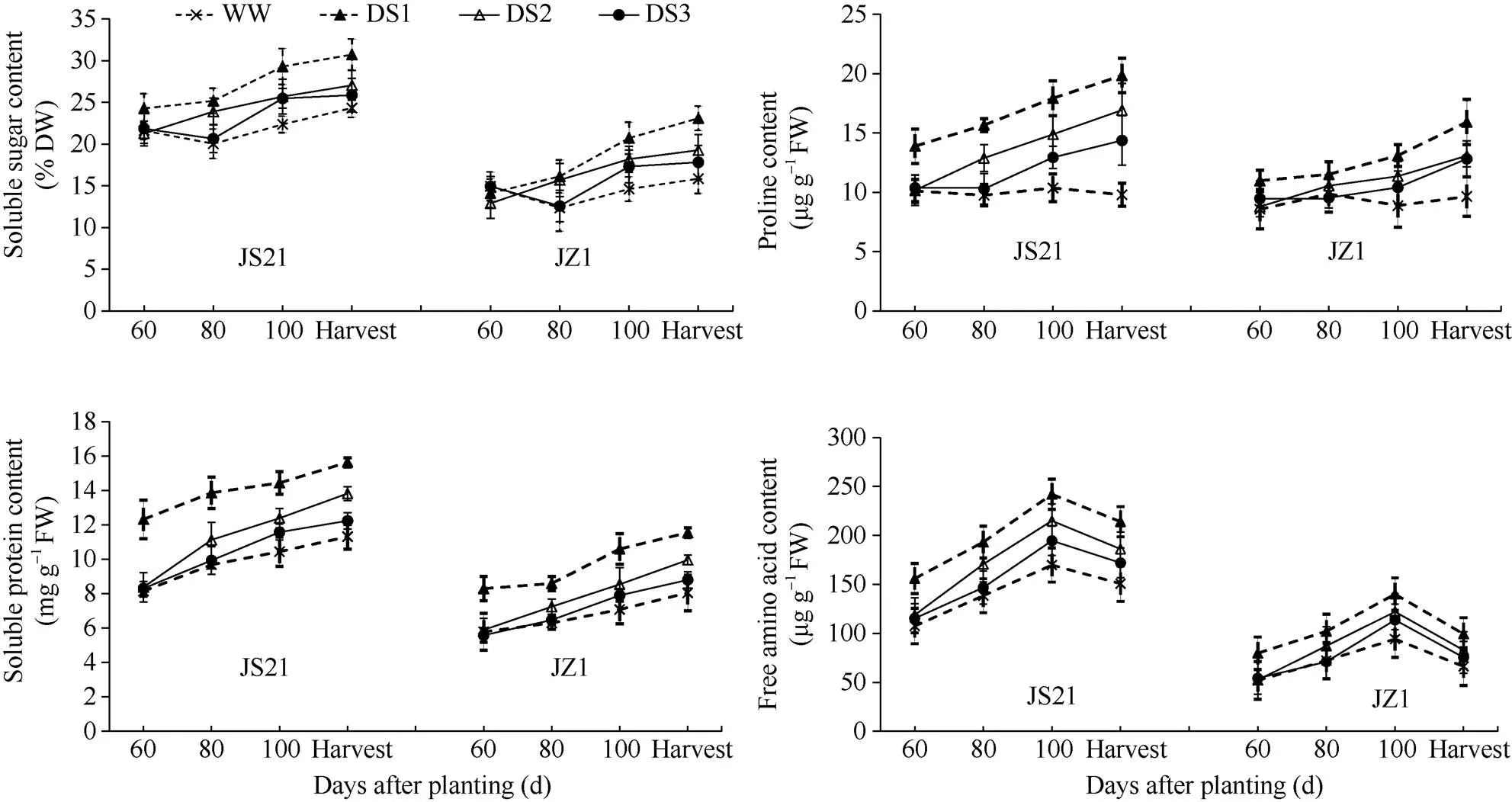
图4 不同时期干旱胁迫对甘薯块根可溶性糖、可溶性蛋白、游离氨基酸和脯氨酸含量的影响
JS21: 济薯21; JZ1: 济紫薯1号。误差线表示3次重复的标准差。处理同表1。
JS21: Jishu 21; JZ1: Jizishu 1. Error bars show the standard deviations of three replicates. Treatments are the same as those given in Table 1.
2.4.2 可溶性蛋白含量 两品种块根可溶性蛋白含量在全生育期均呈持续增加的趋势。干旱胁迫导致块根可溶性蛋白含量增加, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小(图4)。说明干旱胁迫时间越早, 持续时间越长, 对甘薯块根可溶性蛋白的影响也越大。
2.4.3 游离氨基酸总量 块根游离氨基酸含量在全生育期的变化趋势呈单峰曲线, 两品种所有处理的变化趋势一致, 均在栽后100 d达到峰值。干旱胁迫导致块根游离氨基酸含量增加, DS和DS1的块根游离氨基酸含量在全生育期均显著高于对照, DS2和DS3的块根游离氨基酸含量则在栽后100 d收获期显著高于对照。干旱胁迫处理的块根游离氨基酸总量与对照相比, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小。抗旱品种济薯21块根游离氨基酸总量与对照相比, 增加的幅度高于不抗旱品种济紫薯1号(图4)。
2.4.4 脯氨酸含量 正常灌水条件下, 块根脯氨酸含量较低, 且在各生育期差别不显著。干旱胁迫导致块根脯氨酸含量迅速增加, DS、DS1和DS2的块根脯氨酸含量在栽后80 d收获期均显著高于对照, 而DS3的块根脯氨酸含量则在栽后100 d收获期显著高于对照。干旱胁迫处理的块根脯氨酸含量与对照相比, DS1增加幅度最大, 其次为DS2, DS3增加幅度最小。抗旱品种济薯21的块根脯氨酸含量与对照相比, 增加的幅度高于不抗旱品种济紫薯1号(图4)。说明干旱胁迫时间越早, 持续时间越长对块根脯氨酸的影响越大。与不抗旱品种相比, 抗旱品种可积累更多的脯氨酸。
3 讨论
3.1 不同时期干旱胁迫对甘薯生长的影响
甘薯虽然较一般作物耐旱, 但是水分敏感期干旱胁迫限制了其增产潜力, 干旱胁迫作为限制甘薯生长的主要因素, 不同生育时期表现的敏感程度有差异[2,23]。苗期干旱胁迫影响了甘薯的发根缓苗, 造成缺苗断垄; 中期干旱胁迫, 影响了根系对养分的吸收, 限制了茎叶生长、干物质积累和块根膨大; 后期干旱胁迫, 土壤机械阻力增大, 限制了块根的膨大[5]。前人研究表明, 前期和中期干旱胁迫对甘薯产量影响较大, 发根分枝期是块根产量形成对水分最敏感的时期[2,5]。本试验中, 不同时期干旱胁迫均导致甘薯鲜薯产量下降, 两品种均以发根分枝期下降幅度最大, 其次是蔓薯并长期和块根快速膨大期。已有研究认为, 甘薯块根产量下降的幅度可作为鉴定品种抗旱性的指标[24]。本研究中得出相似结果,品种间比较, 同一时期干旱胁迫条件下, 抗旱品种济薯21鲜薯产量下降的幅度均小于不抗旱品种济紫薯1号。因此, 干旱地区甘薯生产, 首先要选用抗旱品种, 其次要保证前中期的水分供应, 促进甘薯的发根缓苗和根系生长, 为后期块根膨大积累充足的养分。
干旱胁迫条件下, 甘薯叶片、茎蔓和根系会产生一系列变化抵御干旱胁迫[25], 叶片厚度、茎蔓长度[26]、根系活力[27]和叶片相对含水量[28]均下降。叶片相对含水量是反映植物水分状况的重要指标, 水分胁迫程度越重, 对其影响越显著, 植物的保水能力也就越差, 细胞壁延展性降低, 细胞伸长生长受抑制, 从而抑制了植物的生长发育[29]。不同甘薯品种叶片结构有差异, 表面蜡质层厚度不同, 干旱胁迫对叶片相对含水量的影响也不同, 不抗旱品种下降幅度大于抗旱品种[28]。本研究中, 不同时期干旱胁迫均导致甘薯功能叶相对含水量下降, 两品种变化趋势一致, 与对照相比, 均以发根分枝期干旱胁迫降低幅度最大。品种间比较, 不抗旱品种济紫薯1号功能叶相对含水量下降幅度高于抗旱品种济薯21。
干旱胁迫降低了甘薯总叶数[30], 单株叶面积降低, 单株光合面积下降[31], 光合生产能力下降, 从而导致生物量下降[32], 干旱胁迫时间越早, 下降的幅度越大, 前期干旱胁迫生物量降低50%, 后期干旱胁迫生物量降低10%[5]。前人研究认为, 植株形态、生长势和产量性状等对干旱胁迫的适应能力差异, 反映了甘薯品种抗旱性的差异, 叶面积系数、比叶面积、块根重量等与品种抗旱性呈显著的正相关关系[33], 生物量和相对茎叶重能反映不同品种对逆境条件的适应性, 上述指标均可用于甘薯品种抗旱性鉴定评价[24]。本研究认为, 干旱胁迫导致甘薯叶片相对含水量的下降, 限制了甘薯的生长发育, 从而导致光合生产能力下降, 不同时期干旱胁迫甘薯地上部和地下部生物量均下降, 不同时期胁迫比较, 均以发根分枝期干旱胁迫下降幅度最大, 其次是蔓薯并长期和块根快速膨大期。品种间比较, 抗旱品种济薯21下降幅度小于不抗旱品种济紫薯1号。植株形态、生长势和产量性状对干旱胁迫的适应性反映最终导致甘薯块根产量的下降。因此, 生产中可根据植株形态、生长势等表型症状判断甘薯受干旱胁迫的程度, 及时进行补充灌溉, 保障甘薯各生育关键期对水分的需求, 为获得高产打好基础。
3.2 不同时期干旱胁迫对甘薯渗透调节能力的影响
渗透调节是作物对逆境适应性调节的重要机制,逆境条件下, 作物可大量积累渗透调节物质, 组织水势下降, 细胞膨压得以维持, 进而保证了作物生理代谢活动的正常进行, 增强抗逆性[8]。渗透调节物质对干旱胁迫的响应与基因型、胁迫程度和胁迫时期有关, 不同生育时期、不同部位对干旱胁迫的耐受能力不同[34-35]。前人研究认为, 过度胁迫导致作物的渗透调节能力下降, 而可溶性糖、可溶性蛋白、游离脯氨酸等小分子物质可在胁迫时参与渗透调节,在复水后参与生理修复[36-37]。本研究认为, 不同时期干旱胁迫均导致甘薯叶片、纤维根和块根中的可溶性糖、可溶性蛋白、游离氨基酸总量和脯氨酸含量上升, 且干旱胁迫时间越早, 升高的幅度越大。发根分枝期是渗透调节物质对干旱胁迫最敏感的时期,其次是蔓薯并长期和快速膨大期。甘薯不同器官渗透调节物质含量也不同, 功能叶的游离氨基酸总量和脯氨酸含量高于纤维根和块根, 而可溶性糖和可溶性蛋白含量则低于纤维根和块根。不同器官渗透调节物质的变化趋势也不同, 正常灌水条件下, 功能叶可溶性糖含量和可溶性蛋白含量先升高后降低,纤维根和块根可溶性糖含量先降低后升高、可溶性蛋白呈持续升高的趋势。干旱胁迫条件下, 甘薯功能叶和纤维根的渗透调节物质含量变化幅度较大, 块根的变化幅度较小。前人研究认为, 逆境胁迫后渗透调节物质的变化幅度不同, 脯氨酸的变化幅度最大, 其次是可溶性糖和游离氨基酸, 但小麦和水稻叶片则是可溶性糖的增加幅度最大, 其次是游离氨基酸和脯氨酸[8-9]。本研究认为, 干旱胁迫条件下, 甘薯功能叶、纤维根和块根中的脯氨酸反应较敏感, 变化幅度较大, 可溶性糖、可溶性蛋白和与游离氨基酸变化幅度相对较小, 且抗旱性强的甘薯品种积累的渗透调节物质多于抗旱性弱的品种, 这与前人研究结果一致[11]。因此, 甘薯栽培管理中, 应保证生育关键期的水分供应, 保证植株组织水势, 维持正常的生理生化代谢, 提高根系对水分和养分的吸收能力, 提高水肥利用率, 达到提质增效的目的。
4 结论
干旱胁迫导致甘薯鲜薯产量显著下降, 不同时期干旱胁迫比较, 以发根分枝期干旱胁迫下降幅度最大, 品种间比较, 不抗旱品种下降幅度高于抗旱品种。干旱胁迫条件下, 甘薯功能叶、纤维根和块根均受到不同程度的破坏, 细胞膜透性增大, 渗透调节物质积累, 生理代谢平衡被破坏, 限制了甘薯叶片和根系的正常生长以及块根的膨大, 导致产量下降。早期干旱胁迫导致生理代谢平衡的破坏无法在复水后得到有效修复, 进入块根快速膨大期, 地上部和地下部均已具有较高生理代谢水平, 该时期干旱胁迫对甘薯生长的影响较小。因此, 干旱胁迫时间越早, 对甘薯生理代谢的影响越大, 导致减产的幅度也最大。
[1] Babajide O O, Patrick O A, David M M, Sunette M L, Abe S G. Greenhouse and field evaluation of selected sweetpotato ((L.) Lam.) accessions for drought tolerance in South Africa., 2014, 5: 3328–3339.
[2] 张海燕, 段文学, 解备涛, 董顺旭, 汪宝卿, 史春余, 张立明. 不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系. 作物学报, 2018, 44: 126–136. Zhang H Y, Duan W X, Xie B T, Dong S X, Wang B Q, Shi C Y, Zhang L M. Effects of drought stress at different growth stages on endogenous hormones and its relationship with storage root yield in sweetpotato., 2018, 44: 126–136 (in Chinese with English abstract).
[3] Chowdhury S R, Singh R, Kundu D K, Antony E, Verma H N. Growth, dry-matter partitioning and yield of sweet potato (L.) as influenced by soil mechanical impedance and mineral nutrition under different irrigation regimes., 2002, 16: 25–29.
[4] Villordon A Q, Labonte D, Firon N, Kfir Y, Pressman E, Schwartz A. Characterization of adventitious root development in sweetpotato., 2009, 44: 651–655.
[5] 李长志, 李欢, 刘庆, 史衍玺. 不同生长时期干旱胁迫甘薯根系生长及荧光生理的特性比较. 植物营养与肥料学报, 2016, 22: 511–517. Li C Z, Li H, Liu Q, Shi Y X. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages., 2016, 22: 511–517 (in Chinese with English abstract).
[6] 杨阳, 申双和, 马绎皓, 王润元, 赵鸿. 干旱对作物生长的影响机制及抗旱技术的研究进展. 科技通报, 2020, 36(1): 8–15. Yang Y, Shen S H, Ma Y H, Wang R Y, Zhao H. Advances in the effects of drought on crop growth and research on drought resistance techniques., 2020, 36(1): 8–15 (in Chinese with English abstract).
[7] 王一鸣, 汪湖, 龙胜举, 赵英鹏, 陈延, 贺忠群. 干旱胁迫对蒲公英渗透调节物质、酶保护系统及质膜水孔蛋白基因表达的影响. 华北农学报, 2017, 32(4): 85–90. Wang Y M, Wang H, Long S J, Zhao Y P, Chen Y, He Z Q. Effects of drought stress on osmoregulation substances, enzyme protection system and expression of plasma membrane hole protein geneinHand.-Mazz., 2017, 32(4): 85–90 (in Chinese with English abstract).
[8] 蔡昆争, 吴学祝, 骆世明. 不同生育期水分胁迫对水稻根叶渗透调节物质变化的影响. 植物生态学报, 2008, 32: 491–500. Cai K Z, Wu X Z, Luo S M. Effects of water stress on osmolytes at different growth stage in rice leaves and roots., 2008, 32: 491–500 (in Chinese with English abstract).
[9] 李春香, 王玮, 李德全. 长期水分胁迫对小麦生育中后期根叶渗透调节能力、渗透调节物质的影响. 西北植物学报, 2001, 21: 924–930. Li C X, Wang W, Li D Q. Effects of long-term water stress on osmotic adjustment and osmolytes in wheat roots and leaves., 2001, 21: 924–930 (in Chinese with English abstract).
[10] 张明生, 彭忠华, 谢波, 谈锋, 张启堂, 付玉凡, 杨春贤, 杨永华. 甘薯离体叶片失水速率及渗透调节物质与品种抗旱性的关系. 中国农业科学, 2004, 37: 152–156. Zhang M S, Peng Z H, Xie B, Tan F, Zhang Q T, Fu Y F, Yang C X, Yang Y H. Relationship between water loss rate of cutting leaves and osmotic regulators under water stress and drought resistance in sweet potato., 2004, 37: 152–156 (in Chinese with English abstract).
[11] 张明生, 谈锋, 张启堂. 快速鉴定甘薯品种抗旱性的生理指标及方法的筛选. 中国农业科学, 2001, 34: 260–265. Zhang M S, Tan F, Zhang Q T. Physiological indices for rapid identification of sweet potato drought resistance and selection of methods., 2001, 34: 260–265 (in Chinese with English abstract).
[12] Aroca R, Irigoyen J J, Sánchez-díaz M. Drought enhances maize chilling tolerance: II. Photosynthetic traits and protective mechanisms against oxidative stress., 2003, 117: 540–549.
[13] Babita M, Maheswari M, Rao L M, Shanker A K, Rao D G. Osmotic adjustment, drought tolerance and yield in castor (L.) hybrids., 2010, 69: 243–249.
[14] Yousifi N, Slama I, Ghnaya T, Savoure A, Abdelly C. Effects of water deficit stress on growth, water relations and osmolyte accumulation inandpopulations., 2010, 333: 205–213.
[15] 曹清河, 李雪华, 戴习彬, 唐君, 周志林, 赵冬兰, 张安. PEG-6000模拟干旱胁迫对甘薯近缘野生种(Kunth) G. Don幼苗生理生化指标的影响. 西南农业学报, 2016, 29: 2536–2541. Cao Q H, Li X H, Dai X B, Tang J, Zhou Z L, Zhao D L, Zhang A. Effects of drought simulated by PEG-6000 on seedling physiological and biochemical indexes of wild sweetpotato relative(Kunth) G. Don.,2016, 29: 2536–2541 (in Chinese with English abstract).
[16] 储凤丽, 刘亚军, 王文静, 胡启国, 杨爱梅. 干旱胁迫对甘薯活性氧代谢、渗透调节物质、SPAD及叶绿素荧光特性的影响. 中国农学通报, 2019, 35(26): 29–34. Chu F L, Liu Y J, Wang W J, Hu Q G, Yang A M. Effects of drought stress on active oxygen metabolism, osmotic regulators, SPAD and chlorophyll fluorescence characteristics of sweet potato., 2019, 35(26): 29–34 (in Chinese with English abstract).
[17] 杜伟莉, 高杰, 胡富亮, 郭德林, 张改生, 张仁和, 薛吉全. 玉米叶片光合作用和渗透调节对干旱胁迫的响应. 作物学报, 2013, 39: 530–536. Du W L, Gao J, Hu F L, Guo D L, Zhang G S, Zhang R H, Xue J Q. Responses of drought stress on photosynthetic trait and osmotic adjustment in two maize cultivars., 2013, 39: 530–536 (in Chinese with English abstract).
[18] 丁成伟, 钮福祥, 郭小丁, 华希新. 甘薯品种资源抗旱性鉴定研究. 河南农业科学, 1997, (10): 3–5. Ding C W, Niu F X, Guo X D, Hua X X. Identification on the drought resistance in sweet potato genetic resource., 1997, (10): 3–5 (in Chinese with English abstract).
[19] 张明生, 谈峰, 张启堂. 快速鉴定甘薯品种抗旱性的生理指标及PEG浓度的筛选. 西南师范大学学报(自然科学版), 1999, 24(1): 73–80. Zhang M S, Tan F, Zhang Q T. Physiological indices of rapid identification for sweet potato drought-resistance and selection of PEG concentration.(Nat Sci Edn), 1999, 24(1): 73–80 (in Chinese with English abstract).
[20] 江苏省农业科学院, 山东省农业科学院. 中国甘薯栽培学. 上海: 上海科学技术出版社, 1984. pp 51–56. Jiangsu Academy of Agricultural Sciences, Shandong Academy of Agricultural Sciences. Chinese Sweetpotato Cultivation. Shanghai: Shanghai Scientific and Technical Publishers, 1984. pp 51–56 (in Chinese).
[21] 梁鹏, 邢兴华, 周琴, 韩亮亮, 田一丹, 张国正, 邢邯, 江海东. α-萘乙酸对干旱和复水处理下大豆幼苗生长和光合作用的影响. 大豆科学, 2011, 30: 50–55.Liang P, Xing X H, Zhou Q, Han L L, Tian Y D, Zhang G Z, Xing H, Jiang H D. Effect of NAA on growth and photosynthetic characteristic of soybean seedling under drought and re-watering., 2011, 30: 50–55 (in Chinese with English abstract).
[22] 陈建勋, 王晓峰. 植物生理学实验指导(第2版). 广州: 华南理工大学出版社, 2006. pp 64–66. Chen J X, Wang X F. Guidance of Plant Physiological Experiment, 2nd edn. Guangzhou: South China University of Technology Publishers, 2006. pp 64–66 (in Chinese).
[23] Lewthwaite S L, Triggs C M. Sweetpotato cultivar response to prolonged drought., 2012, 42: 1–10.
[24] 张海燕, 解备涛, 汪宝卿, 董顺旭, 段文学, 张立明. 不同甘薯品种抗旱性评价及耐旱指标筛选. 作物学报, 2019, 45: 419–430. Zhang H Y, Xie B T, Wang B Q, Dong S X, Duan W X, Zhang L M. Evaluation of drought tolerance and screening for drought-tolerant indicators in sweetpotato cultivars., 2019, 45: 419–430 (in Chinese with English abstract).
[25] Sokoto M B, Sadiq K A. Productivity of sweet potato (L.) as influenced by water stress and variety in Sokoto Sudan Savannah, Nigeria., 2016, 12: 1–9.
[26] 李欢, 陈雷, 王晨静, 赵习武, 陆国权. 4个观赏甘薯品种的抗旱性比较. 浙江农业学报, 2015, 27: 1945–1952. Li H, Chen L, Wang C J, Zhao X W, Lu G Q. Evaluation of the drought tolerance of four ornamental sweetpotato cultivars., 2015, 27: 1945–1952 (in Chinese with English abstract).
[27] 张海燕, 段文学, 董顺旭, 解备涛, 汪宝卿, 张立明. 苗期干旱胁迫条件下外源ABA对甘薯膜透性和抗氧化酶系统的影响. 华北农学报, 2018, 33(2): 177–187. Zhang H Y, Duan W X, Dong S X, Xie B T, Wang B Q, Zhang L M. Effects of exogenous abscisic acid on membrane permeability and antioxidant system of sweetpotato at seedlings Stage under drought stress., 2018, 33(2): 177–187 (in Chinese with English abstract).
[28] 吴巧玉, 何天久, 夏锦慧. 干旱胁迫对甘薯生理特性的影响. 贵州农业科学, 2013, 41(6): 52–54. Wu Q Y, He T J, Xia J H. Effects of drought stress on physiological characteristics of sweet potato., 2013, 41(6): 52–54 (in Chinese with English abstract).
[29] 霍红, 张勇, 陈年来, 李彩霞, 高海宁. 干旱胁迫下五种荒漠灌木苗期的生理响应和抗旱评价. 干旱区资源与环境, 2010, 25(1): 185–189. Huo H, Zhang Y, Chen N L, Li C X, Gao H N. Physiological response and evaluation of drought resistance about five desert shrubs under drought stress., 2010, 25(1): 185–189 (in Chinese with English abstract).
[30] 许育彬, 程雯蔚, 陈越, 华千勇. 不同施肥条件下干旱对甘薯生长发育和光合作用的影响. 西北农业学报, 2007, 16(2): 59–64.Xu Y B, Cheng W W, Chen Y, Hua Q Y. Effect of drought on growth and development and photosynthesis of sweet potato under different fertilization conditions., 2007, 16(2): 59–64 (in Chinese with English abstract).
[31] 孙哲, 史春余, 刘桂玲, 高俊杰, 柳洪鹃, 郑建利, 张鹏. 干旱胁迫与正常供水钾肥影响甘薯光合特性及块根产量的差异. 植物营养与肥料学报, 2016, 22: 1071–1078. Sun Z, Shi C Y, Liu G L, Gao J J, Liu H J, Zheng J L, Zhang P. Effect difference of potassium fertilizer on leaf photosynthetic characteristics and storage root yield of sweet potato under drought stress and normal water condition., 2016, 22: 1071–1078 (in Chinese with English abstract).
[32] 张海燕, 解备涛, 段文学, 董顺旭, 汪宝卿, 张立明, 史春余. 不同时期干旱胁迫对甘薯光合效率和耗水特性的影响. 应用生态学报, 2018, 29: 1943–1950. Zhang H Y, Xie B T, Duan W X, Dong S X, Wang B Q, Zhang L M, Shi C Y. Effects of drought stress at different growth stages on photosynthetic efficiency and water consumption characteristics in sweet potato., 2018, 29: 1943–1950 (in Chinese with English abstract).
[33] 张明生, 谢波, 戚金亮, 谈锋, 张启堂, 杨永华. 甘薯植株形态、生长势和产量与品种抗旱性的关系. 热带作物学报, 2006, 27(1): 39–43. Zhang M S, Xie B, Qi J L, Tan F, Zhang Q T, Yang Y H. Relationship of drought resistance of sweet potato with its plant type, growth vigour and yield under water stress., 2006, 27(1): 39–43 (in Chinese with English abstract).
[34] 姜慧芳, 任小平. 干旱胁迫对花生叶片SOD活性和蛋白质的影响. 作物学报, 2004, 30: 169–174. Jiang H F, Ren X P. The effect on SOD activity and protein content in groundnut leaves by drought stress., 2004, 30: 169–174 (in Chinese with English abstract).
[35] 张智猛, 宋文武, 丁红, 慈敦伟, 康涛, 宁堂原, 戴良香. 不同生育期花生渗透调节物质含量和抗氧化酶活性对土壤水分的响应. 生态学报, 2013, 33: 4257–4265. Zhang Z M, Song W W, Ding H, Ci D W, Kang T, Ning T Y, Dai L X. The responses of leaf osmoregulation substance and protective enzyme activity of different peanut cultivars to non-sufficient irrigation., 2013, 33: 4257–4265 (in Chinese with English abstract).
[36] Mbinda W, Ombori O, Dixelius C, Oduor R. Xerophyta viscosa aldose reductase, XvAld1, enhances drought tolerance in transgenic sweetpotato., 2018, 60: 203–214.
[37] Fan W J, Zhang M, Zhang H X, Zhang P. Improved tolerance to various abiotic stresses in transgenic sweet potato () expressing betaine aldehyde dehydrogenase., 2012, 7: e37344.
Effects of drought treatments at different growth stages on growth and the activity of osmotic adjustment in sweet potato [(L.) Lam.]
ZHANG Hai-Yan1,**, WANG Bao-Qing1,**, FENG Xiang-Yang2, LI Guang-Liang3, XIE Bei-Tao1, DONG Shun-Xu1, DUAN Wen-Xue1,*, and ZHANG Li-Ming4,*
1Crop Research Institute, Shandong Academy of Agricultural Sciences / Scientific Observation and Experimental Station of Tubers and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture and Rural Affairs / Shandong Engineering Laboratory of Featured Crops, Jinan 250100, Shandong, China;2Agricultural and Rural Bureau of Changle, Changle 262400, Shandong, China;3Zhangzhuang Town Agrotechnical Station of Zoucheng City, Zoucheng 273507, Shandong, China;4Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China
Field experiments were conducted using two sweet potato cultivars (Jishu 21, a drought-tolerant cultivar, and Jizishu 1, a drought-sensitive cultivar) with four water treatments to investigate the effects of drought treatments at different growth stages on growth and the activity of osmotic adjustment in sweet potato [(L.) Lam.], including well-watered treatment during the whole growth period (WW, control), drought stress during the establishment stage (DS1), drought stress during the storage root initial stage (DS2), and drought stress during the storage root bulking stage (DS3). Drought stress resulted in significant decrease of fresh weight of storage roots in sweet potato. Compared with drought stress in different periods, drought stress during the establishment stage (DS1) decreased the fresh weight most. Compared between cultivars, drought-sensitive cultivar decreased the fresh weight most. The average in three years, compared with the control, the fresh weight of drought-tolerant cultivar (Jishu 21) and drought-sensitive cultivar (Jizishu 1) decreased 28.59% and 38.77% in DS1 treatment, respectively, while 25.20% and 33.50% in DS2 treatment, respectively and 14.55% and 19.56% in DS3 treatment, respectively. Drought stress resulted in significant decrease of biomass of storage roots in sweet potato. One hundred days after planting, compared with the control, the biomass of aboveground part of Jishu 21 in DS1, DS2, and DS3 decreased 32.68%, 20.79%, and 11.72%, respectively, while Jizishu 1 decreased 46.45%, 31.89%, and 18.43%, respectively. The biomass of underground part of Jishu 21 in DS1, DS2, and DS3 decreased 37.69%, 25.86%, and 10.67%, respectively, while Jizishu 1 decreased 54.34%, 33.48%, and 14.20%, respectively. Under drought stress, the relative water content of functional leaves decreased, and the content of soluble sugar, soluble protein, free amino acid and proline in functional leaves, fibrous roots and storage roots increased. The earlier the application of drought stress, the greater the decrease or increase. The effects of drought stress applied at early stages on osmotic adjustment could not be effectively recovered after re-watering, while the osmotic adjustment could be recovered to the control level after re-watering when drought stress was applied at later stage.
sweet potato; drought stress; activity of osmotic adjustment
10.3724/SP.J.1006.2020.04079
本研究由山东省薯类产业创新团队项目(SDAIT-16-09), 国家现代农业产业技术体系建设专项(CARS-10-B08), 山东省农业科学院农业科技创新工程项目(CXGC2016A05)和山东省农业重大应用技术创新项目(SD2019ZZ022)资助。
This study was supported by the Shandong Province Modern Agricultural Technology System Tubers and Root Crops Innovation Team (SDAIT-16-09), the China Agriculture Research System (CARS-10-B08),the Agricultural Scientific and Technological Innovation Project of Shandong Academy of Agricultural Sciences (CXGC2016A05), and the Major Agricultural Application Technological Innovation Project in Shandong Province (SD2019ZZ022).
段文学, E-mail:duanwenxue2010@163.com; 张立明, E-mail: zhanglm11@sina.com
**同等贡献(Contributed equally to this work)
张海燕, E-mail: zhang_haiyan02@163.com; 汪宝卿, E-mail:76853722@qq.com
2020-03-27;
2020-07-02;
2020-07-14.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200713.1824.012.html

