甘蓝型春油菜早花位点加密及位点聚合创建优异早花资源
柳海东 潘云龙 杜德志
甘蓝型春油菜早花位点加密及位点聚合创建优异早花资源
柳海东**潘云龙**杜德志*
青海大学农林科学院 / 青海省春油菜遗传改良重点实验室 / 国家油菜改良中心青海分中心 / 农业农村部春油菜科学观测实验站 / 青海省春油菜工程技术研究中心, 青海西宁 810016
前期在甘蓝型春油菜NNDH群体中定位到和2个早花主效QTL, 分别开发了与紧密连锁的SSR标记G1803、InDel标记IA7-4, 以及与紧密连锁的SSR标记S035。本研究在此基础上构建了早花QTL位点的BC2F2群体, 进一步对该位点加密, 开发了与紧密连锁的标记SNP11。利用开发的与两个位点紧密连锁的4个标记对93个甘蓝型春油菜自然资源进行早花基因型鉴定, 从中筛选出含有位点的资源3164和2216, 含有位点的资源3484和2857, 两位点资源之间两两正反杂交进行位点聚合。通过小孢子培养和标记辅助选择快速获得聚合DH系, 筛选出性状优良且早花的聚合系与波里马细胞质雄性不育系配置杂交组合, 连续2年多点进行测产试验, 对聚合系利用价值进一步分析。加密结果显示, 该位点被定位于SNP11和SNP12区间中, 与SNP11共分离。自然资源早花基因型鉴定结果显示, 含有位点的单株50个, 平均初花期58.1 d, 含有位点的单株16个, 平均花期58.3 d, 同时含有两位点的单株16个, 平均花期55.2 d, 表明同时包含两早花位点株系比只含有一个早花位点株系早开花。聚合结果显示, 早花位点和的聚合单株开花时间比单位点亲本单株的开花时间提前2~3 d, 其中来自位点的3164和位点的3484聚合后的DH18比亲本早开花3 d, 产量相关性状都优于其他品系。进一步利用DH18与波里马细胞质雄性不育系025A配置组合, 将该组合定名为TZG18, 2年9点测产结果表明, TZG18比青藏高原白菜型主栽品种浩油11号增产17.5%以上。综上研究结果说明, 早花位点聚合品系比早花单位点品系在开花时间上有着明显的优势, 同时对增加油菜产量也有影响。本研究是甘蓝型春油菜早花性状MAS育种的初步探索, 为春油菜区特早熟甘蓝型春油菜品种替代白菜型油菜提供了材料支持, 也为基因聚合育种技术提供了新途径。
甘蓝型春油菜; 早花位点; 基因聚合; 早花资源
分子标记辅助选择(molecular marker-assisted selection, MAS)是从分子水平上快速准确地分析个体的遗传组成, 实现对基因型的直接选择[3]。目前, MAS技术应用主要集中在基因聚合(gene pyramiding)、基因渗入(gene transgression)、根据育种计划构建基因系等方面。鲁守平等[4]以高油玉米自交系By804为供体, 利用MAS技术, 将2个主效QTL分别回交转育至普通玉米自交系lx9801、lx03-2及lx00-1中, 结果表明, 转育目标QTL后自交系绝对含油量较轮回亲本平均增加0.72%。杨海峰等[5]利用分子标记辅助筛选洋葱不育系并配制杂交组合, 随后利用分子标记检测杂交种的育性, 共选育出101A、A1、D-9、A3和T五套不育系。付蓉[6]利用MAS技术, 将抗根肿病位点和导入到不含抗根肿病位点的高油酸材料中, 通过回交选育得到农艺性状优良的抗根肿病高油酸新材料。Abhilash等[7]利用分子标记辅助回交育种(molecular marker-assisted backcross breeding,MABB), 将水稻中抗细菌性白叶枯病基因和、抗瘟性基因和导入到中纤细谷物型杂交水稻的稳定恢复系RPHR-1005中, 提高了水稻对细菌性白叶枯病和稻瘟病的抗性。李旭[8]利用油菜9012AB核不育资源, 通过分子标记辅助选择, 将抗根肿病基因导入ZH5和ZS9三系高油酸材料中, 育性表现和高油酸核不育系相似, 实现了抗根肿病高油酸ZH5材料和ZS9材料的三系配套。基因聚合是将分散在不同品种中的优良性状基因通过杂交、回交、复合杂交等手段聚合到同一个品种中, 已经成为现代作物育种的一个重要的育种手段[9]。Zhong等[10]通过农杆菌介导转化方法将甜菜孢囊线虫的抗性基因BvHs1和转移到油菜中, 获得不同的转基因品系, 并将Hs1基因聚合到同一植物内。侯富恩等[11]将抗番茄黄化曲叶病基因、和进行聚合, 利用MAS技术选择, 分别获得含与和与的聚合系, 2份株系整个生育期在田间对番茄黄化曲叶病都表现抗病, 并且园艺性状优良稳定。
在油菜众多的农艺性状中, 早花是早熟的前提条件, 早熟性状是当前油菜品种选育的一个重要性状指标[12], 在高海拔春油菜产区早熟育种尤为重要, 该类地区白菜型油菜产量较低, 品质差, 而甘蓝型春油菜产量和品质方面都优于白菜型油菜, 但在生育期上不具优势, 因此, 选育出早熟的甘蓝型油菜代替青海等高海拔地区的白菜型油菜, 对提高和改善现有高海拔地区油菜的产量和品质意义重大, 这也是春油菜产区研究的主要内容[13-14]。前期利用NNDH群体定位到和2个主效QTL, 分别位于A7和C8染色体, 共同解释花期表型变异的23%, 两主效QTL等位基因都来自于早花亲本, 能促进晚花材料提前开花2~3 d, 且分别开发了与紧密连锁的SSR标记G1803 (0.1 cM)[15]、InDel标记IA7-4 (共分离)[16], 以及与紧密连锁的SSR标记S035 (0.4 cM)[15]。本研究进一步构建BC2F2群体对该位点加密, 开发紧密连锁标记, 并通过分子标记辅助选择(MAS)育种技术和位点聚合技术, 将不同早花主效QTL位点导入聚合到一个品系中, 以期为春油菜区特早熟甘蓝型春油菜品种替代白菜型油菜提供材料支持, 为基因聚合育种技术提供新途径。
1 材料与方法
1.1 试验材料
利用已构建完成的包含527个单株的BC2F2分离群体(NN DH系中的早花材料DH189为母本, 晚花亲本No.5246轮回亲本)对位点进行加密。甘蓝型春油菜资源93份, 波里马细胞质雄性不育系025A, 对照材料为白菜型地方品种浩油11号, 以上材料均由青海大学农林科学院春油菜研究所提供。
1.2 试验方法
1.2.1 DNA提取 采用CTAB法[17]提取DNA, 每个材料苗期取新鲜嫩叶5 g。
1.2.2主效位点SNP和InDel标记开发
选取早花亲本No.4512、晚花亲本No.5246、NNDH系中极端早花和晚花的株系各20株, 等量混合构建的早花混合池(E池)和晚花池(L池) 4个测序样本, 送北京诺和致源Illumina HiSeqPE150平台测序。测序数据与甘蓝型油菜基因组(http://www. genoscope.cns.fr/brassicanapus/data/Brassica_napus_ v4.1.chromosomes.fa.gz)比对, 结果经SAMTOOLS 0.1.19去除重复[18]。采用GATK3.3软件[19]的Unified Genotyper模块进行多个样本SNP的检测, 使用Variant Filtration过滤。再根据混池间的基因型频率差异进行SNP-index计算, 用Δ(SNP-index)统计候选区间[20-21], 根据候选区间SNP和InDel信息开发标记。
调取SNP和InDel位点上下游各150 bp的序列, 使用软件Primer 5设计引物, CG含量在40%~50%之间,m值为55℃左右, 长度为18~22 bp, 由上海生工生物工程有限公司[Sangon Biotech (Shanghai) Co., Ltd.]合成引物。SSR标记PCR扩增体系为10 μL, 包含DNA 1 μL、dNTP 0.8 μL、10×TE buffer 1 μL、酶0.2 μL、primer 0.5 μL、超纯水(ddH2O) 6.5 μL。SNP和InDel标记PCR扩增体系为10 μL, 包含DNA 2.5 μL、dNTP 1 μL、10×TE buffer 1 μL、酶0.2 μL、primer 1 μL、ddH2O 4.3 μL。通过6%聚丙烯酰胺凝胶电泳, 然后使用银染法检测基因型。
1.2.3区间加密及定位 利用已设计的SNP和InDel标记对BC2F2群体进一步扫描。采用JoinMap 4.0 软件[22]构建连锁图谱, 选用Kosambi函数将重组值转换为图距单位(centi-Morgan, cM)[23]。利用Mapchart 2.1软件绘制连锁图谱[24]。利用WinQTLcartographer 2.5软件中复合区间作图法(composite interval mapping, CIM)进行QTL分析定位, 操作步骤参照Doerge和Churchill[25]描述进行。
4.我产奶,我有犄角,但我不是奶牛。我是谁?(答案:a milk truck 奶车。horn 既有“犄角”的意思,又有“喇叭”的意思。)
1.2.4 甘蓝型春油菜资源早花基因型鉴定及两早花位点聚合 利用已开发的与早花主效QTL紧密连锁的标记SSR G1803和InDel IA7-4、与QTL紧密连锁的标记SSR S035及本试验中开发的紧密连锁的SNP标记对93份春性甘蓝型油菜资源进行基因型鉴定。与早花材料No.4512基因型相同的用AA表示, 与晚花材料No.5246基因型相同的用BB表示; 从93份基因型库中筛选到分别含有和的单株各2株, 不同单位点的单株两两杂交获得F1, 通过小孢子培养快速获得DH系, 并进行基因型鉴定、花期和农艺性状考察。
1.2.5 农艺性状考察 于2016年将BC2F2群体及亲本种植于青海大学农林科学院试验地, 统计初花期, 初花期 = 25%开花时间 − 播种期[26], 以小区内每个植株第1朵花开为标准, 当小区中25%的植株达到开花标准后则认为该材料达到初花期。于2017年春季将93个自然资源、聚合后两位点聚合系及其亲本种植于青海大学农林科学院试验地, 随机区组设计3个重复, 每重复3行, 行长1.6 m, 行间距30 cm, 株距20 cm, 每行苗期定苗8株。材料成熟时, 每小区在中间1行随机取样6株考种, 考察角果长度、每角粒数、全株角果数、千粒重、单株产量和初花期等农艺性状。角果长度: 果身长度(不包括果柄和果喙); 每角粒数: 在主轴及上、中、下分枝花序上随机取10个正常角果, 计算其平均每果饱满和略欠饱满的种子数; 全株角果数: 全株具有1粒以上饱满或略欠饱满种子的角果总数; 千粒重: 将整个小区完熟种子混匀称千粒重量; 单株产量: 整株所有种子称量结果[26]。田间管理按常规进行。
1.2.6 与不育系配制杂交组合产量分析 于2017年秋季将筛选出的聚合后产量、品质性状优良及早花的DH系与波里马细胞质雄性不育系025A在云南元谋配制杂交组合, 于2018年将F1、浩油11号分别种植于门源沙沟梁(36°48′N, 101°06′E, 海拔3030 m)、门源后院(36°45′N, 101°15′E, 海拔2863 m)、湟源(36°31′N, 101°07′E, 海拔3132 m)、同德(35°09′N, 100°09′E, 海拔3280 m), 2019年种植于门源后院、湟源、同德、贵南牧场(35°45′N, 101°35′E, 海拔3315 m)和海北(35°25′N, 101°25′E, 海拔3150 m)。各品种(系)在不同地方按3个重复种植, 每重复0.0015 hm2, 栽培管理按常规进行, 各地水肥措施一致。成熟后收获并称取产量, 最终产量(kg hm-2) = 小区产量/0.0015, 增产比率 = (试验组产量 − 对照组)/对照组产量×100%。
1.2.7 数据处理 利用Microsoft Excel和SPSS 22.0进行产量及花期相关数据的检验和方差分析(ANOVE), 数据以“平均数±标准误”表示。
2 结果与分析
2.1 早花位点cqDTFC8加密
2.1.1 SNP和InDel标记的开发及筛选 结合NNDH群体定位结果和BSA重测序结果,位于C8染色体SSR标记S033和S035之间, 其物理位置为1.6~6.0 Mb[27], 根据该区间候选SNP和InDel信息开发标记, 共开发标记32对, 其中SNP标记12对, InDel标记20对。进一步对32对标记在早花亲本DH189和晚花亲本No.5246中进行多态性筛选, 双亲采取2对2的方式进行筛选, 即同时添加2个早亲模板和2个晚期模板, 发现有6对SNP标记和3对InDel标记在2对早亲中带型一致, 同样在2对晚亲中带型相同, 且双亲中差异明显, 带型清晰、易读, 都表现为共显性。序列信息如表1。

表1 SNP和Indel引物序列信息
2.1.2 局部遗传连锁图谱构建及定位
利用侧翼及区间标记S033、S034、S035 (图1-A)以及上述筛选出的6对SNP和3对InDel标记对BC2F2群体进行扫描, 以及鉴定群体单株基因型并构建局部遗传连锁图谱。通过对12对标记数据连锁分析发现, 新开发的9个标记被定位在原区S033和S035区间之内。局部遗传图谱遗传距离为0~11.6 cM, 平均遗传距离0.97 cM, 遗传距离最小的区间为InDel 60~InDel 55 (0.2 cM) (图1-B)。
位点在NNDH群体中被定位于P7MC5-285~S035之间, 置信区间为131.0~133.5 cM,区间距离2.5 cM (图1-A)。结合局部遗传连锁图谱和BC2F2群体表型, 进一步将定位于2.2 cM的位置, 置信区间为2.1~2.7 cM, 介于SNP11与SNP12之间, 区间距离0.6 cM, 且与SNP11共分离, 解释表型贡献率为34% (图1-B)。通过进一步加密, 将原来区间缩小到0.6 cM。通过与新开发标记物理图谱共线性分析发现, 4个标记SNP6、SNP11、SNP12、SNP14在新遗传图谱上的排布与物理图谱一致, 共线性较好, 但SNP20、SNP21和3个InDel标记在新遗传图谱上的排布较之物理图谱稍有变化(图1-B, C)。表明本研究有效地将9对新开发标记定位于候选区间之内, 并进一步加密了早花主效QTL位点。

图1 加密前后分子标记遗传连锁图谱主要位点对比及新标记共线性分析
A: NNDH群体中构建的C8染色体局部遗传连锁图谱; B: BC2F2群体中加密位点后的局部遗传连锁图谱; C: 加密标记的物理图谱。
A: partial genetic linkage map of chromosome C8 constructed in the NNDH population; B: partial genetic linkage map after encryptinglocus in BC2F2population; C: the physical map of the encrypted markers.
2.2 自然资源中早花基因型鉴定
利用加密前距离最近的共显性SSR标记S035 (0.4 cM)、加密后与共分离的标记SNP11、与位点紧密连锁的标记G1803 (0.1 cM)及共分离标记IA7-4对93个甘蓝型春油菜资源进行不同位点基因型鉴定。93个自然资源被4个标记分为AA和BB 2种基因型(表2)。在位点G1803标记下, 有53个携带早花等位基因的资源开花时间变幅为53.2~62.1 d, 平均初花期为58.7 d, 40个BB基因型的资源开花时间变幅为63.2~77.3 d, 平均初花期为65.7 d, AA基因型的资源平均初花期显著短于BB基因型(<0.05); 对IA7-4位点分析显示, 有50个携带早花基因的品系和43个携带晚花基因的资源平均开花时间分别为58.1 d和65.9 d, 差异呈显著水平(<0.05), 初花期变幅与G1803标记下的变幅相差不大。位点S035标记也将93份资源分成AA和BB 2种基因型, 其中AA基因型的资源21个, 初花期变幅为55.7~61.7 d, 平均初花期58.6 d, 72个BB基因型的资源初花期变幅为62.3~77.7 d, 平均初花期64.9 d, 显著晚于AA基因型的资源初花期(<0.05); SNP11扫描后获得AA基因型的资源16个, 初花期变幅为52.4~59.3 d, 平均初花期58.3 d, BB基因型的资源77个, 变幅为62.1~79.3 d, 平均初花期64.4 d, 二者初花期差异呈显著水平(<0.05)。在4个标记中同时呈现AA基因型的资源有16个, 平均初花期55.2 d, 同时呈现BB基因型的资源有30个, 平均初花期65 d, 两者呈极显著差异(<0.01), 同时可以看出变幅减小(表2)。说明在自然资源中, 当早花位点或存在时, 早开花; 当不存在两早花位点等位基因时, 晚开花; 同时包含两早花位点株系比只含有一个早花位点株系的开花时间早, 花期变幅越小。

表2 93份甘蓝型春油菜资源在两早花位点4个标记中的基因型鉴定结果
值后的a、b、c、d、e分别表示G1803、IA7-4、S035、SNP11以及同时含有4个标记下的AA、BB基因型的资源平均初花期检验。
a,b,c,d, andeafter-values represent average first flowering time by Student’s-test for G1803, IA7-4, S035, SNP11, and the four markers AA and BB genotypes, respectively.
2.3 早花位点聚合及初花期、产量相关性状分析
为了快速选育特早熟甘蓝型春油菜资源, 从上述93个自然资源中选取初花期较早且相近, 每位点2个标记下都表现早花基因型但不包含另外一个位点的资源进行早花位点聚合, 其中含早花位点的资源为3164和2216, 含早花位点的资源为3484和2857, 不同位点单株两两正反杂交, F1进行小孢子培养, 共筛选到15个与亲本初花期相近或较早的DH系。利用与紧密连锁的标记G1803、IA7-4和与紧密连锁的标记S035、SNP11对这15个DH系的基因型鉴定发现, DH2、DH4、DH5、DH12、DH18、DH20和DH23共7个聚合DH系在G1803 (330 bp)、IA7-4 (120 bp)、S035 (170 bp)和SNP11 (105 bp) 4个标记下都表现为早花带型(图2)。进一步对单位点亲本及7个聚合DH系初花期分析发现, 含有早花位点的资源3164和2216初花期分别为58.3 d和59.2 d, 含有早花位点的资源3484和2857初花期分别为57.6 d和60.0 d, 7个聚合DH系初花期介于54.5 d至57.3 d之间, 比各自亲本平均初花期早2~3 d, 其中来自(3484×3164)的DH18初花期最早, 为54.5 d, 比两亲本早开花3 d (表3)。
亲本3484 ()角果长度和全株角果数分别为8 cm和341个, 显著高于2216 ()和2857 (); 3164 ()角果长度为7.8 cm, 显著高于2857 (<0.05); 每角粒数最多的是3164 (296个), 与其他3个亲本差异达显著水平(<0.05); 千粒重除了2857最低之外, 其余3个差异不显著; 4个亲本单株产量无明显差异(表3)。7个聚合DH系中, DH18在角果长度、每角粒数、千粒重、全株角果数等4个性状上都显著优于其他6个聚合DH系(<0.05); DH18千粒重为21.4 g, 在7个聚合DH系中最高, 除与DH2和DH20无明显差异外, 与其他4个聚合DH系差异均达显著水平(<0.05, 表3)。说明在4个亲本中, 3484和3164在角果长度、全株角果数和每角粒数等产量相关因子方面优于其他两亲本; 通过3484和3164杂交聚合和后, 获得的DH18不但花期提前, 而且产量性状表现优异。表明亲本农艺性状的优良决定了子代性状的好坏。

图2 4个紧密连锁标记对聚合DH系基因型鉴定结果
a: 与连锁标记G1803鉴定结果; b: 与连锁标记IA7-4鉴定结果; c: 与连锁标记S035鉴定结果; d: 与连锁标记SNP11鉴定结果。M为marker, 4512为早花亲本, No.5246为晚花亲本, 两者基因型为标准, 与4512带型相同则认为含有早花位点, 与5246带型相同则不含。箭头所指的是7个聚合DH系在4个标记下都与4512带型一致。
a: identification results of G1803 linkage mark with; b: identification results of IA7-4 linkage mark with; c: identification results of S035 linkage mark with; d: identification results of SNP11 linkage mark with. M is marker, 4512 is the parent of early flowering, and 5246 is the parent of late flowering. Both genotypes are considered as standard, and the same as No.4512 band type is considered to contain early flowering locus, while the same as 5246 band type is not considered to contain early flowering locus. The arrow points to seven polymerized DH lines that are consistent with the 4512 band type under four markers.
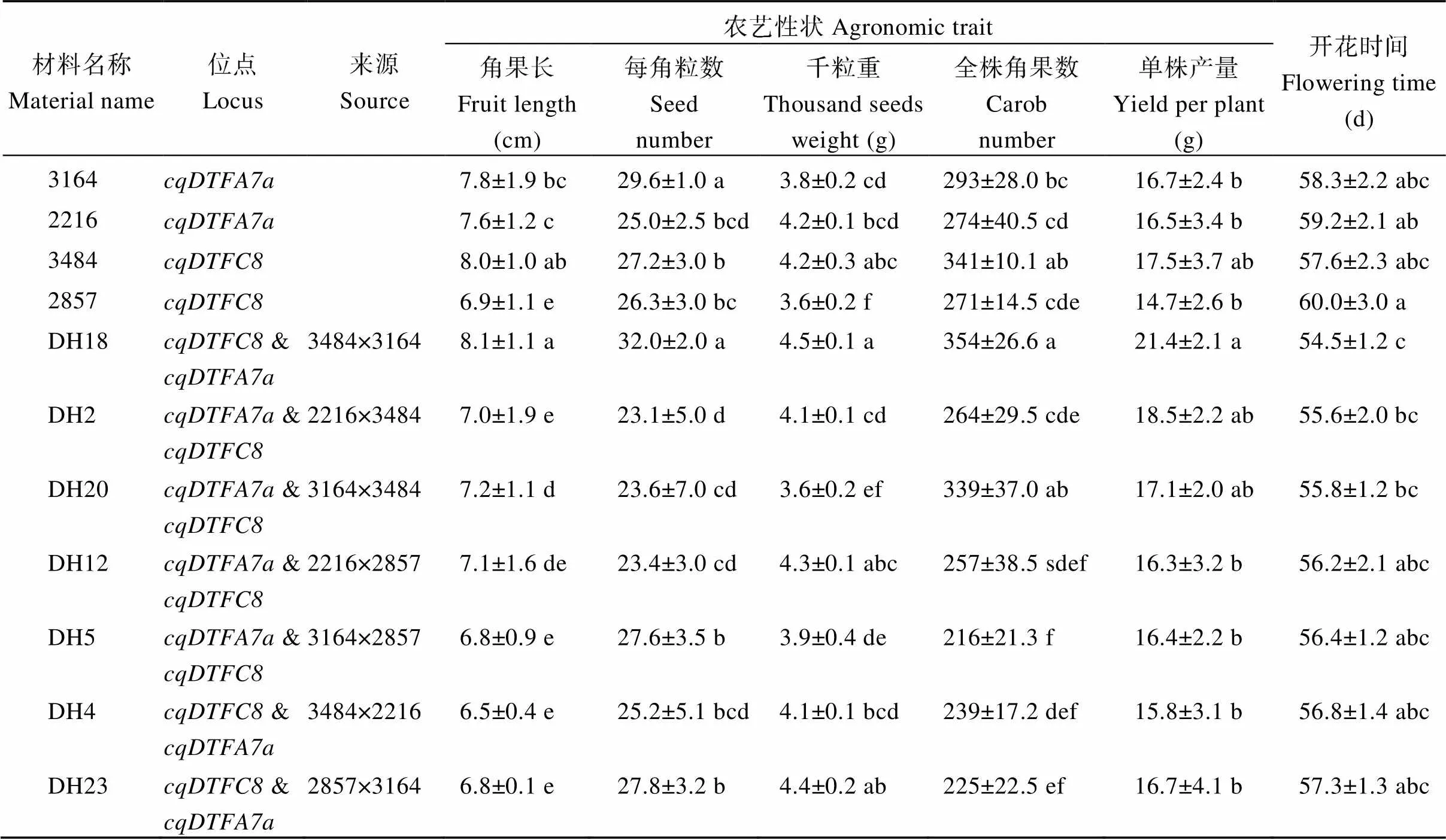
表3 单位点亲本及位点聚合系产量性状和开花时间表现
各性状后的小写字母表示在0.05水平的差异显著性。
Values not sharing the same lowercase letters are considered statistically significant at the 0.05 probability level.
2.4 聚合系DH18配制杂交种潜力分析
于2017年利用DH18与波里马细胞质雄性不育系025A配置组合, 杂种F1定名为TZG18, 连续2年进行测产。2018年在青海省门源沙沟梁、门源后院、湟源、同德4地测产, 2019年在青海省门源后院、湟源、同德、贵南牧场、海北州5地测产。2018年TZG18在湟源、同德两地表现增产, 较浩油11号产量达到显著水平(<0.05), 在门源沙沟梁和门源后院略有减产, 但与浩油11号差异不明显; TZG18在4个地方平均产量为1391.7 kg hm-2, 显著高于浩油11号(1150.0 kg hm-2) 21% (表4)。2019年TZG18在门源后院和贵南牧场产量表现较浩油11号没有明显差异(>0.05), 但在湟源、同德和海北产量显著高于浩油11号(<0.05), 综合5地的平均产量, TZG18为2488.0 kg hm-2, 浩油11号为2117.3 kg hm-2, TZG18显著增产, 其比率达到17.5% (表4)。

表4 TZG18两年测产统计
产量后的小写字母表示在0.05水平差异显著。
Values not sharing the same lowercase letter are considered statistically significant at the 0.05 probability level.
3 讨论
分子标记辅助选择(MAS)的高可靠性、高效率主要依赖于标记与候选基因紧密连锁的程度,位点在NNDH群体中定位的置信区间为2.5 cM, 通过进一步扩大群体, 将定位于0.6 cM范围之内, 较初定位缩小了1.9 cM, 通过区间缩小之后再选紧密连锁标记提高了MAS选择的可靠性。此外, 随着高通量测序技术的发展, 连锁标记的选择类型也由传统标记向新型标记过度, 使得标记的特异性和准确性逐步提高。张素君等[28]选用在棉花基因组上均匀分布多态性较好的237个SSR标记对214份陆地棉材料的基因组变异进行扫描, 共检测到695个等位变异, 发掘出与黄萎病抗性显著关联的SSR位点27个, 推测这些稳定存在的SSR标记位点有可能与抗病基因紧密连锁, 为棉花黄萎病抗性材料筛选和抗病基因挖掘奠定了基础。黄冰艳等[29]改良KASP分子标记检测体系, 开发了AS-PCR-MP高油酸分子标记检测方法, 选择河南省大面积推广种植的4个不同类型的花生品种为轮回亲本, 定向获得了4个稳定高油酸改良材料24个, 拓展了高油酸花生的遗传背景, 为快速高效改良花生油酸含量探索了新的方法。SNP标记是随高通量测序技术的发展应运而生的一类标记, 该标记不能直接用于辅助选择, 而需通过其变异位点或位点附近是否存在酶切位点进一步设计CAPS、SNP等类型标记[30-31]。本研究通过高通量测序手段, 发掘出候选SNP和InDel位点, 再根据变异位点设计相应的SNP和InDel标记, 利用与早花位点紧密连锁的标记在自然群体中的鉴定发现, 自然资源中同时含有2个早花位点时, 开花时间早于只含有一个早花位点的资源, 说明在春性甘蓝型油菜中根据早花位点开发的紧密连锁标记G1803和IA7-4以及根据开发的紧密连锁标记S035和SNP11可用于甘蓝型春油菜早花性状辅助选择育种。
早花是早熟的先决条件, 早熟性状有诸多优点, 可以避免后期高温逼熟, 以及在高温条件下产生的一些病虫害, 以保证产量。在油菜、水稻等大田作物中, 早熟品种选育是一个主要的方向, 在现实生产中早熟品种不可或缺, 如南方三季稻区的早熟水稻品种、春油菜高海拔区的早熟春油菜品种等。通常情况, 作物“高产”与“早熟”是一对矛盾, 早熟又高产品种的选育是一个巨大的挑战, 早熟品种产量一般较低, 因为光合作用产生碳水化合物的速率受到生育期的限制, 而产量较高的品种一般生育期较长[32]。目前, 从基因水平入手探索解决这一矛盾成为行之有效的办法, 在诸多的早花基因中, 挑选一些对产量有利的早花基因必须具备2个条件, 一是这些早花基因没有与产量相关性状基因连锁累赘的现象存在, 二是这些早花基因与一些有利基因连锁或互作, 能增强作物光合效率或氮的高效利用, 如水稻中的早花显性基因就同时具备这2个条件, 在一些早熟稻明星品种如Ce64、明恢77、R402中都含有该基因, 通过Ce64早熟恢复系选育的微优64和汕优64比其近等基因系成熟期缩短7~20 d而不减产[33]。在油菜中, 通过对开花时间和菌核病抗性QTL定位发现, 两者部分QTL有共有的置信区间, 共同的遗传区域可能同时影响油菜的菌核病抗性和开花时间, 开花时间与菌核病抗性负相关[34-35], 因此, 在选择早花基因或QTL聚合时选择菌核病抗性、产量等性状比较优异的亲本对品种改良具有重要的意义。本研究选择的两位点聚合资源3484和3164产量相关性状优良, 聚合后获得的2个DH系产量相关性状较好, 花期较其他聚合系早, 尤其DH18在角果长度、每角粒数, 千粒重、全株角果数等4个性状上都显著优于其他聚合DH系, 表明通过花期位点聚合不仅能创建更早花资源, 也可能将亲本有利的产量相关基因进行聚合。当然, 在此过程中, 是否与抗菌核病、抗倒伏等性状相关基因有连锁累赘或聚合后非等位基因之间是否存在互作等还需进一步研究。
在青藏高原脑山地区, 油菜是最主要的经济作物, 由于气候冷凉, 无霜期较短, 只能种植一些生育期较短的白菜型油菜, 俗称“小油菜”, 而浩油11号是该地区主栽的白菜型油菜品种之一, 年种植面积约30万亩, 如果能选育出特早熟甘蓝型油菜来替代白菜型油菜, 产区的产量将大幅提高。为将筛选到的资源快速应用到育种进程中, 本研究利用青海省农林科学院通过回交转育选育的一个特早熟波里马细胞质雄性不育系025A与DH18配置组合, 对DH18优势潜力进行分析, 并将该组合定名为TZG18, 产量较白菜型油菜增产显著。通过进一步分析发现, TZG18芥酸含量为0.58%, 硫甙含量为28.62 μmol g-1, 品质达到“双低”, 含油量44.62%。除产量和品质外, 生育期是早熟育种的关键, 浩油11号在门源沙沟梁、门源后院、湟源、同德、贵南牧场、海北等6个地区全生育期在125 d左右, 而TZG18在130 d左右, 基本属同期成熟。因此, 在今后推广中, TZG18将有可能大面积替代浩油11号。本研究是甘蓝型春油菜早花性状MAS育种的初步探索, 将MAS技术与现代生物技术相结合, 应用于基因聚合等方面, 能够加快育种研究的进程, 缩短育种年限。本研究为培育高海拔地区的特早熟甘蓝型春油菜品种提供了材料支持, 也为基因聚合育种技术提供了新途径。未来应将实验室研究与大田生产相结合, 利用多种优良基因相互聚合, 保留优异的种质资源, 将基因聚合带来的社会效益和经济效益最大化。
4 结论
早花位点被定位于SNP11和SNP12区间中, 解释表型变异的34%。通过进一步加密, 将原来区间距离2.5 cM缩小到0.6 cM, 且与SNP11共分离; 93个自然资源被4个标记分为AA和BB 2种基因型, 同时包含两早花位点株系比只含有一个早花位点株系早开花; 通过两早花位点聚合获得7个聚合DH系, 这些DH系比其亲本提前开花2~3 d, 在7个聚合DH系中, DH18产量相关性状最优, 初花期最早, 进一步利用DH18与波里马细胞质雄性不育系025A配置组合, 并定名为TZG18, 连续2年多地测产分析得出, TZG18比高海拔白菜型油菜主栽品种浩油11号增产17.5%以上。说明早花位点聚合品系比早花单位点品系在开花时间上有着明显的优势, 同时对增加油菜产量也有着很大影响。
[1] 官春云, 靳芙蓉, 董国云, 官梅, 谭太龙. 冬油菜早熟品种生长发育特性研究. 中国工程科学, 2012, 14(11): 4–12. Guan C Y, Jin F R, Dong G Y, Guan M, Tan T L. Exploring the growth and development properties of early variety of winter rapeseed., 2012, 14(11): 4–12 (in Chinese with English abstract).
[2] 徐亮, 星晓蓉, 赵志, 姚艳梅. 特早熟春油菜品种青7号的选育. 中国种业, 2011, 31(8): 66–67. Xu L, Xing X R, Zhao Z, Yao Y M. Breeding of special precocious spring rape variety Qingza No.7., 2011, 31(8): 66–67 (in Chinese with English abstract).
[3] 邓世峰, 王先如, 张安存, 陈次娥, 吴明. 分子标记辅助选择在我国水稻抗病育种中的研究进展. 江西农业, 2019, 31(22): 40–46. Deng S F, Wang X R, Zhang A C, Chen C E, Wu M. Advances in molecular marker assisted selection in rice breeding for disease resistance in China., 2019, 31(22): 40–46 (in Chinese with English abstract).
[4] 鲁守平, 张华, 孟昭东, 穆春华. 利用分子标记技术对玉米自交系子粒油分的改良研究. 作物杂志, 2019, (3): 24–28. Lu S P, Zhang H, Meng Z D, Mu C H. Improvement of grain oil content in maize inbred lines by molecular marker technology., 2019, (3): 24–28 (in Chinese with English abstract).
[5] 杨海峰, 惠林冲, 陈微, 李威亚, 何林玉, 郇国磊, 王江英, 徐卫平, 李景芳, 缪美华, 陈振泰, 潘美红. 应用分子标记辅助选育洋葱不育系及其杂交应用. 江西农业学报, 2019, 31(7): 1–9. Yang H F, Hui L C, Chen W, Li W Y, He L Y, Huan G L, Wang J Y, Xu W P, Li J F, Miao M H, Chen Z T, Pan M H. Application of molecular marker-assisted selection of onion () sterile lines and hybrid application., 2019, 31(7): 1–9 (in Chinese with English abstract).
[6] 付蓉. 分子标记辅助选择在油菜抗根肿病和高油酸育种中的应用. 华中农业大学硕士学位论文, 湖北武汉, 2019. Fu R. Application of Molecular Marker-Assisted Selection in Clubroot Resistance and High Oleic Acid Breeding in. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2019 (in Chinese with English abstract).
[7] Abhilash K V, Balachiranjeevi C H, Bhaskar N S, Rambabu R, Rekha G, Harika G, Hajira S K, Pranathi K, Anila M, Kousik M, Vijay K S, Yugander A, Aruna J, Dilip K T, Vijaya S R K, Hari P A S, Madhav M S, Laha G S, Balachandran S M, Prasad M S, Viraktamath B C, Ravindra B V, Sundaram R M. Development of gene-pyramid lines of the elite restorer line, RPHR-1005 possessing durable bacterial blight and blast resistance., 2016, 7: 1195–1210.
[8] 李旭. 分子标记辅助选择改良油菜核不育系. 华中农业大学硕士学位论文, 湖北武汉, 2019. Li X. Improvement of Male Sterile Line inL. by Marker-Assisted Selection. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2019 (in Chinese with English abstract).
[9] 鲁秀梅, 张宁, 陈劲枫, 钱春桃. 作物基因聚合育种的研究进展. 分子植物育种, 2017, 15: 1445–1454. Lu X M, Zhang N, Chen J F, Qian C T. The research progress in crops pyramiding breeding., 2017, 15: 1445–1454 (in Chinese with English abstract).
[10] Zhong X B, Zhou Q Z, Cui N, Cai D G, Tang G X.andgenes pyramiding enhanced beet cyst nematode (Schm.) resistance in oilseed rape (L.)., 2019, 20: 1740–1756.
[11] 侯富恩, 郝科星, 张涛, 苏东涛, 王铭. 番茄抗TYLCV分子标记辅助聚合育种. 中国瓜菜, 2019, 32(1): 18–21. Hou F E, Hao K X, Zhang T, Su D T, Wang M. Pyramiding breeding of resistance genes to TYLCV by molecular marker-assisted selection in tomato., 2019, 32(1): 18–21 (in Chinese with English abstract).
[12] 张尧锋, 余华胜, 曾孝元, 林宝刚, 华水金, 张冬青, 傅鹰. 早熟甘蓝型油菜研究进展及其应用. 植物遗传资源学报, 2019, 20: 258–266. Zhang Y F, Yu H S, Zeng X Y, Lin B G, Hua S J, Zhang D Q, Fu Y. Progress and application of early maturity in rapeseed (L.)., 2019, 20: 258–266 (in Chinese with English abstract).
[13] 杜德志, 肖麓, 赵志, 柳海东, 姚艳梅, 星晓蓉, 徐亮, 李开祥, 王瑞生, 李钧, 付忠, 赵志刚, 唐国永. 我国春油菜遗传育种研究进展. 中国油料作物学报, 2018, 40: 633–639. Du D Z, Xiao L, Zhao Z, Liu H D, Yao Y M, Xing X R, Xu L, Li K X, Wang R S, Li J, Fu Z, Zhao Z G, Tang G Y. Advances in genetic breeding of spring rapeseed in China., 2018, 40: 633–639 (in Chinese with English abstract).
[14] 柳海东. 春性甘蓝型油菜遗传连锁图谱构建及开花时间的QTL定位分析. 青海大学博士学位论文,青海西宁, 2015. Liu H D. Construction of Genetic Linkage Map and Identification of Quantitative Trait Loci (QTL) for Days to Flowering in Spring Rapeseed (L.). PhD Dissertation of Qinghai University, Xining, Qinghai, China, 2015 (in Chinese with English abstract).
[15] Liu H D, Du D Z, Guo S, Xiao L, Zhao Z, Zhao Z G, Xing X R, Tang G Y, Xu L, Fu Z, Yao Y M, Duncan R W. QTL analysis and the development of closely linked markers for days to flowering in spring oilseed rape (L.)., 2016, 36: 1–14.
[16] 潘云龙, 柳海东. 甘蓝型春油菜早花位点加密及其近等基因系构建. 分子植物育种, 2019, 17: 7047–7057. Pan Y L, Liu H D. Encryption for an early flowering time locusand construction of NILs in springL., 2019, 17: 7047–7057 (in Chinese with English abstract).
[17] Doyle J. Isolation of plant DNA from fresh tissue., 1990, 12: 13–15.
[18] Li H, Durbin R. Fast and accurate short read alignment with burrows-wheeler transform., 2009, 25: 1754–1760.
[19] Mckenna A, Hanna M, Banks E, Sivachenko A, Cibulskis K, Kernytsky A, Garimella K, Altshuler D, Gabriel S, Daly M, DePristo M A. The genome analysis toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data., 2010, 20: 1297–1303.
[20] Hill J T, Demarest B L, Bisgrove B W, Gorsi B, Su Y C, Yost H J. Mmappr: mutation mapping analysis pipeline for pooled RNA-seq., 2013, 23: 687–697.
[21] Rym F, Hiroki T, Muluneh T, Akira A, Satoshi N, Hiroki Y. Mutmap+: genetic mapping and mutant identification without crossing in rice., 2013, 8: e68529.
[22] Jansen R C, Ooijen J W V, Stam P. Genotype-by-environment interaction in genetic mapping of multiple quantitative trait loci., 1995, 91: 33–37.
[23] Kosambi D. The estimation of map distances from recombination values., 1994, 12: 172–175.
[24] Voorrips R E. MapChartTMversion 2.0: MapChart: software for the graphical presentation of linkage maps and QTL., 2001, Wageningen, Netherlands.
[25] Doerge R W, Churchill G A. Permutation tests for multiple loci affecting a quantitative character., 1996, 142: 285–294.
[26] 柳海东, 李开祥, 徐亮, 杜德志. 半冬性甘蓝型油菜资源在春性环境下的利用价值. 西北农业学报, 2019, 28: 1609–1620. Liu H D, Li K X, Xu L, Du D Z. Study on utilization value of semi-winter rapeseed ofin spring environment., 2019, 28: 1609–1620 (in Chinese with English abstract).
[27] 柳海东, 赵绪涛, 杜德志. 利用QTL-seq技术定位甘蓝型春油菜早花位点及其近等基因系构建. 植物生理学报, 2020, 56: 219–234. Liu H D, Zhao X T, Du D Z. Mapping of theof early flowering site using QTL-seq technique and construction of its near-isogenic lines inL., 2020, 56: 219–234 (in Chinese with English abstract).
[28] 张素君, 唐丽媛, 李兴河, 王海涛, 刘存敬, 张香云, 张建宏. SSR标记与陆地棉田间黄萎病抗性的关联分析. 华北农学报, 2018, 33(6): 152–159. Zhang S J, Tang L Y, Li X H, Wang H T, Liu C J, Zhang X Y, Zhang J H. Association analysis of Verticillium wilt-resistance in upland cotton germplasm population based on ssr markers., 2018, 33(6): 152–159 (in Chinese with English abstract).
[29] 黄冰艳, 齐飞艳, 孙子淇, 苗利娟, 房元瑾, 郑峥, 石磊, 张忠信, 刘华, 董文召, 汤丰收, 张新友. 以分子标记辅助连续回交快速提高花生品种油酸含量及对其后代农艺性状的评价. 作物学报, 2019, 45: 546–555. Huang B Y, Qi F Y, Sun Z Q, Miao L J, Fang Y J, Zheng Z, Shi L, Zhang Z X, Liu H, Dong W Z, Tang F S, Zhang X Y. Improvement of oleic acid content in peanut (L.) by marker assisted successive backcross and agronomic evaluation of derived lines., 2019, 45: 546–555 (in Chinese with English abstract).
[30] Derek W. Barchenger K R, Li J, Stephen F H, Paul W B. Allele-specific CAPS marker in a Ve1 homolog offor improved selection ofresistance., 2017, 37:134–137.
[31] Fan C, Cai G, Qin J, Li Q, Yang M, Wu J, Fu T, Liu K, Zhou Y. Mapping of quantitative trait loci and development of allele-specific markers for seed weight in., 2010, 121: 1289–1301.
[32] Rossi M, Bermudez L, Carrari F. Crop yield: challenges from a metabolic perspective., 2015, 25: 79–89.
[33] Fang J, Zhang F T, Wang H R, Wang W, Zhao F, Lie Z J, Sun C H, Chen F M, Xu F, Chang S Q, Wu L, Bu Q Y, Wang P R, Xie J K, Chen F, Huang X H, Zhan Y J, Zhu X G, Han B, Deng X J, Chu C C.locus shortens rice maturity duration without yield penalty., 2019, 116: 18717–18722.
[34] Zhao J W, Udall J A, Quijada P A, Grau C R, Meng J L, Osborn T C. Quantitative trait loci for resistance toand its association with a homeologous nonreciprocal transposition inL., 2006, 112: 509–516.
[35] Wei D, Mei J, Fu Y, Joseph O D, Li J, Qian W. Quantitative trait loci analyses for resistance toand flowering time in., 2014, 34: 1797–1804.
Locus encryption for early flowering and QTL polymerization to create excellent early flowering resources of springs L.
LIU Hai-Dong**, PAN Yun-Long**, andDU De-Zhi*
Academy of Agricultural and Forestry Sciences, Qinghai University / Qinghai Spring Rape Engineering Research Center / Spring Rape Scientific Observation Experimental Station of Ministry of Agriculture and Rural Areas / Qinghai Research Branch of the National Rapeseed Genetic Improvement Center / Key Laboratory of Qinghai Province for Spring Rapeseed Genetic Improvement, Xining 810016, Qinghai, China
and, two major effects of early flowering QTL, were identified in the NNDH population of spring, and closely linked markers SSR G1803, InDel IA7-4, and SSR S035 withdeveloped in previous studies. In this study, a BC2F2population for early flowering QTL locuswas constructed, and a closely linked SNP marker was further developed. The early flowering genotypes of one natural resources contained 93 springvarieties were identified used four closely linked markers with two loci, and selected 3164 and 2216 resources withsite, 3484 and 2857 resources withsite. Two site resources were aggregated by site polymerization through reciprocal hybridization. The polymerized DH system was rapidly obtained by microspore culture and maker assisted selection. A hybrid combination was created between polymeric line with good traits and early flowers and the Polima CMS, and the utilization value of the polymeric line was further analyzed by the production test at multiple environments for two consecutive years.encryption results showed that this site was located in the SNP11 and SNP12 interval, and separated from SNP11 altogether. The identification results of early flowering genotypes of natural resources showed that there were 50 individuals containinglocus, with an average initial flowering period of 58.1 days; 16 single plants containinglocus, with an average flowering period of 58.3 days; and 16 single plants containing two loci, with an average flowering period of 55.2 days, indicating the more early flowering sites containing, the earlier flowering. The results of polymerization showed that the flowering time of the polymerized lines ofandwas 2–3 days earlier than that of the single locus parents, among which the polymerized DH18 from 3164 ofand 3484 ofwas 3 days earlier than that of the parents, and the yield-related traits were better than those of other lines. The combination of DH18 and the Polima CMS 025A was further utilized, and the combination was named TZG18. Yield results of two years and nine environments showed that yield of TZG18 was above 17.5% higher than the Haoyou 11, a localvariety on the Qinghai-Tibet plateau. Those results indicated that the early flowering site polymeric lines had an obvious advantage over the single locus lines in flowering time, and had an effect on the increasement of rapeseed yield. This study is a preliminary exploration of MAS breeding for early flowering traits of, providing materials support for replacingvarieties using early maturityvarieties in spring rapeseed region, and approaches for gene polymerization breeding technology.
spring; early flowering locus; gene pyramiding; early flowering resources
10.3724/SP.J.1006.2020.04012
本研究由国家重点研发计划项目(2018YFD0100501), 国家自然科学基金项目(31760395),国家现代农业产业技术体系建设专项(CARS-12), 青海省重点研发与转化计划项目(2018-NK-C07), 青海省春油菜遗传改良重点实验室(2017-ZJ-Y09)和青海省农林科学院科研专项(2018-NKY-011)资助。
This study was supported by the National Key Research and Development Plan (2018YFD0100501), the National Natural Science Foundation ofChina (31760395), the China Agriculture Research System (CARS-12), the Key Research and Development and Transformation Project of Qinghai Province (2018-NK-C07), the Laboratory of Spring Rape Genetic Improvement of Qinghai Province (2017-ZJ-Y09), and the Qinghai Academy of Agriculture and Forestry Sciences Research Project (2018-NKY-011).
杜德志, E-mail: qhurape@126.com, Tel: 0971-5366520
**同等贡献(Contributed equally to this work)
柳海东, E-mail: dahaima@163.com; 潘云龙, E-mail: pylscorpio@126.com
2020-01-15;
2020-06-02;
2020-06-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200615.1336.002.html

