冬枣浆胞病菌的有效拮抗酵母筛选①
吴芳梅梅明鑫
(1海南省食品检验检测中心(海南省试验动物中心)海南海口571100;2昌江黎族自治县现代农业检验检测预警防控中心海南昌江572700)
沾化冬枣是枣属(Zizyphus JujubeMill.)植物果实,富含氨基酸和多种维生素,具有较高的食用价值和保健功效[1],因其皮薄、肉脆、汁多、口感好、营养丰富而倍受消费者喜爱。但是,沾化冬枣成熟期晚(10月中上旬成熟),常温下很不耐贮藏,果实采收5~10 d以后就会失去鲜脆状态,出现严重的皱缩、失水、酒软和霉烂,还会伴有维生素的大量损失,导致冬枣供应期短,销售面窄,一直以来都处于小范围发展状态。因此,做好冬枣的采后保鲜、延长鲜果供应期、提高采后效益尤为重要。
冬枣果实采后病害多数是潜伏性侵染病害,在采摘或贮藏过程中由于机械损伤及自身衰老过程的加剧,给了病原微生物可乘之机。因此,要减少采后病害引起的腐烂,需要在采后采取各种措施来抑制病原菌生长。目前冬枣采后病害防治主要有减压贮藏、低温贮藏、气调贮藏、热水处理等物理防治方法;此外还有采用保鲜剂、熏蒸和化学杀菌剂等化学防治,以及利用生防菌、植物源防腐保鲜剂等生物防治方法[2]。
利用拮抗微生物替代传统化学杀菌剂来控制果蔬采后病害已经成为研究的热点。目前,已经有研究表明,可以作为果蔬采后病害生防拮抗菌的微生物有细菌、霉菌和酵母菌等。其中,酵母菌营养要求低、拮抗效果好,一般不产生毒素、不会对公众的健康及生态环境造成危害[3],且酵母菌的遗传学基础研究比较清楚,具有通过基因工程技术改造来提高防病能力的潜力,一般不会产生对人体和寄主有害的代谢产物;对多种胁迫条件和逆境具有较强的耐受力,对多数化学杀菌剂不敏感,能够与多种化学物质及物理方法结合使用,并且酵母细胞本身含有丰富的营养物,许多酵母菌被广泛应用于食品加工及酿造工业,已成为果蔬采后病害生物防治研究的主要菌种[4]。
本研究以冬枣浆孢腐烂病菌蜡样芽孢杆菌为指示菌,通过离体筛选几种水果表面拮抗酵母,并利用拮抗酵母对采后新鲜冬枣进行处理[5],贮藏一段时间后检测其对冬枣的保鲜效果;通过检测冬枣的失重率、腐烂率、可溶性固形物、酸含量、VC含量等指标来评价其作用效果[6],以期为冬枣的贮藏保鲜提供新途径和新方法。
1 材料与方法
1.1 材料
1.1.1 酵母菌株分离样品
丰水梨、水蜜桃、葡萄及四川泡菜水购自雅安苍坪路农贸市场。
1.1.2 冬枣
沾化冬枣购买于吉选超市,挑选大小一致、单果重20 g左右、无机械伤、无病虫害、成熟度一致的冬枣。冬枣先用自来水清洗2遍,然后自然晾干,备用。
1.1.3 指示菌
蜡样芽孢杆菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌。
1.1.4 培养基
(1)BDA培养基将200.0 g黄豆芽放入1.0 L的蒸馏水中煮沸30 min后,滤出黄豆芽;称取20.0 g葡萄糖、17.0 g琼脂加入到滤液中,加热待琼脂溶化,补水至1.0 L,用0.5 mol/L NaOH溶液或5%HCl(V/V)调节pH为6.8。
(2)BD培养液除了不加琼脂外,配置方法同BDA。
(3)PDA培养基[4]马铃薯先洗净去皮,再称取200 g,切成小块,加水煮烂(煮沸20~30 min,能被玻璃棒戳破即可),用纱布过滤,再加入葡萄糖20.0 g、琼脂17.0 g、蒸馏水1.0 L,调节pH至6.8。
(4)KBA培养基K2HPO41.5 g、MgSO4·7H2O 1.5 g、甘油10.0 g、蛋白胨20.0 g、琼脂200 g、蒸馏水1.0 L,pH调至6.8。
(5)KB培养液除了不加琼脂外,配置方法同KBA。
以上培养基均在121℃下高压蒸汽灭菌25 min,备用。BDA用于酵母菌的分离,KBA用于酵母菌平板筛选,酵母菌的纯化与保存用PDA。
1.2 方法
1.2.1 拮抗酵母的分离与筛选
1.2.1.1 拮抗酵母的分离
用水果刀切取10.0 g的果实样品,将其切碎,放入装有90 mL BD培养液的三角瓶中,然后加入3滴乳酸,置于恒温摇床上振荡培养(26℃,200 r/min)30 min;用无菌移液管吸取富集菌体的滤液1 mL,加入至装有9 mL无菌生理盐水(0.85%)的试管中,即稀释为10倍,编号为1号;混匀后,从1号试管中吸取1 mL菌悬液加入另一个装有9 mL无菌生理盐水(0.85%)的试管中,即为10-2,编号为2,同法稀释成10-3,10-4,10-5,10-6倍浓度样品稀释液;吸取不同浓度梯度稀释液100滋L注入90 mm BDA平板,用灭菌涂布器涂布均匀,置于28℃培养箱培养2 d;取出平板,镜检形态整齐、大小均匀、菌态饱满的单菌落菌体,确定为酵母菌后,反复纯化后PDA斜面4℃保存备用。每个稀释度重复3个平板[7]。
1.2.1.2 拮抗酵母的筛选
用移液管吸取l×108cfu/mL酵母菌悬液1 mL均匀涂布于PDA培养基平板上,于28℃培养箱中培养48 h;待酵母菌在培养基表面长成一层较厚的菌苔,用7 mm内径的无菌打孔器打孔,制备酵母菌苔琼脂块[8]。将指示菌分别制成菌悬液备用;将装有l00 mL PDA固体培养基的三角瓶加热融化,置于55℃的水浴锅中保温,取l mL指示菌菌悬液加入培养基中,摇匀,迅速倒入灭菌的培养皿内,待其凝固;将分离出的酵母菌制成酵母菌苔,挑取酵母菌苔,正面朝上放置于混菌培养基上,每个平板均匀放置4个酵母菌苔,于28℃培养24 h,观察是否出现抑菌圈,并用十字交叉法测定抑菌圈直径,实验重复3次。
1.2.1.3 拮抗酵母菌的复筛
方法同1.2.1.2,筛选出最适拮抗酵母菌。
1.2.2 拮抗酵母发酵液处理冬枣的贮藏保鲜效果
1.2.2.1 冬枣的处理
将所筛选的最适拮抗酵母菌接种在PDA液体培养基中,置28℃、200 r/min摇床培养24 h,用血球计数板制成l×108CFU/mL菌悬液。试验共设5个不同处理[9],分别为CK、BAY、AYB1、AYB2、AYB3,每 处 理2次 平行,每小组40个果实。(1)对照组(CK):冬枣以无菌水浸泡1 min,自然晾干,再浸泡蜡样芽孢杆菌发酵液1 min。(2)自身对照组(BAY):先浸泡蜡样芽孢杆菌发酵液,自然晾干后再浸泡108CFU/mL酵母发酵液。(3)AY处理组:分别用106CFU/mL(AYB1)、107CFU/mL(AYB2)、108CFU/mL(AYB3)的酵母发酵液浸泡1 min,自然晾干,各浸泡蜡样芽孢杆菌发酵液1 min。每处理20个冬枣,2次重复。处理完毕后,自然晾干,将处理组与对照组的冬枣分别封入聚乙烯保鲜袋中编号,于(4±1)℃贮藏[10]。每隔5 d观察一次,统计冬枣果实腐烂情况,随机挑选8个果实,测定各项贮藏品质指标。
1.2.2.2 相关指标测定
腐烂率计算公式:腐烂率=腐烂果实数/处理的果实总数×100%;失重率采用称重法。
果肉硬度采用硬度计测定(由于冬枣果实比较小,为了比较硬度的变化,规定每次进入硬度计8 mm即可,测得果实硬度为相对硬度[11]);可溶性固形物含量采用手持糖度仪测定;可滴定酸含量用酸碱滴定法(以柠檬酸计[12]),按照GB/T 12456-2008测定;维生素C含量的采用紫外快速测定法。
1.2.3 数据处理与分析
试验数据采用Excel和SPSS软件进行统计与分析,差异显著性分析方法。
2 结果与分析
2.1 拮抗酵母的筛选结果
经过初步分离纯化,共获得6株抑菌作用明显的酵母菌株。由表1可知,S24对指示菌的抑菌效果最好,对蜡状芽孢杆菌的抑菌圈直径为18.9 mm,对枯草芽胞杆菌的抑菌圈直径达20.3 mm,比其他的酵母菌的抑菌圈都要大。

表1拮抗酵母菌株对病原菌的抑菌圈直径 单位:mm
由图1可知,S24对枯草芽胞杆菌的抑制效果最为明显,对蜡样芽胞杆菌也有较好的抑菌效果。因此,将此株菌用于冬枣的贮藏实验最为合适。
2.2 菌种的鉴定结果
挑取单菌落,利用显微镜镜台测微尺和目镜测微尺进行观察测量,确定S24为酵母菌株,形状为球形或椭球形,酵母菌直径为3.86~6.46滋m(图2)。
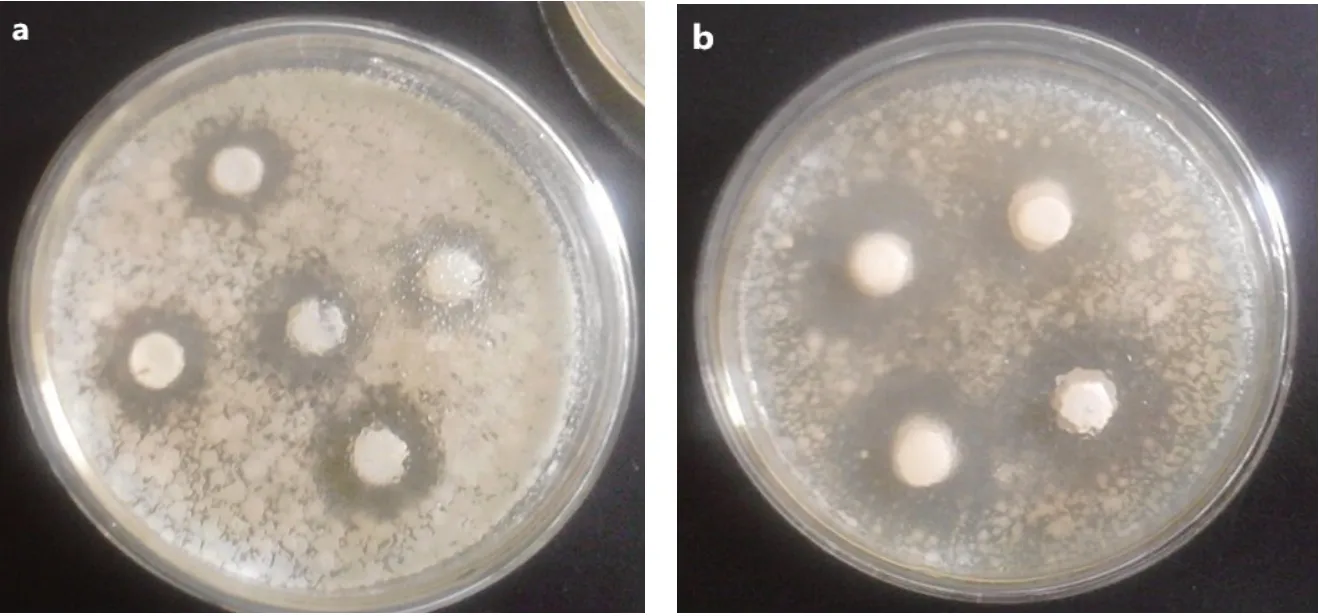
图1 S24对蜡样芽胞杆菌(a)和枯草芽胞杆菌(b)的抑菌效果
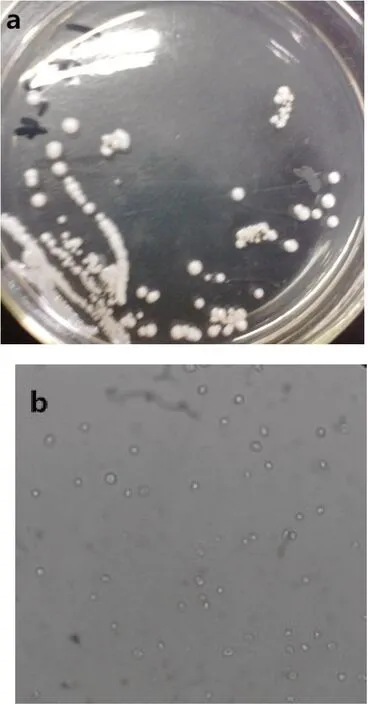
图2 S24单菌落(a)和显微(40×)(b)照片
2.3 拮抗酵母S24对贮藏冬枣保鲜效果
2.3.1 对冬枣可滴定酸含量的影响
由图3可知,冬枣在贮藏过程中,可滴定酸含量的变化均呈现出先上升后下降的趋势。经过拮抗酵母S24处理的AYB3、AYB2、AYB1,可滴定酸含量变化不明显,在贮藏25 d时,AYB3、AYB2、AYB1可滴定酸含量分别为2.53、2.38、2.49 g/kg,BAY可滴定酸含量为2.07 g/kg,处理组与对照组差异显著(p<0.05)。说明拮抗酵母抑制了冬枣果实内部物质的转化,可以延缓果实衰老,与李青云等[6]的研究结果一致。
2.3.2 对冬枣VC含量的影响
有研究表明,VC可以作为衡量鲜枣冻藏保鲜效果的生理指标[13]。由图4可知,VC含量在冬枣果实贮藏过程中呈现出下降的趋势,在BAY组及CK组贮藏前期急剧下降,而拮抗酵母S24处理的3组呈现较为平稳的下降趋势;在贮藏25 d时,经过拮抗酵母处理的AYB3、AYB2、AYB1与自身对照组BAY、空白对照组CK的VC含量差异显著(p<0.05)。说明拮抗酵母菌能在一定程度上保持冬枣的营养,与李青云[14]的研究结果一致。
2.3.3 拮抗酵母S24对贮藏冬枣硬度的影响
果实的衰老往往伴随着果肉质地变软、硬度下降,甚至出现腐烂变质。硬度可作为判定果实成熟以及衰老程度的指标[15]。由图5可以看出,拮抗酵母S24对维持贮藏期间冬枣的硬度有较为明显的效果,贮藏至25 d时,AYB3的硬度为13.50 kg/cm2,明显高于CK与BAY组,差异显著(p<0.05)。
2.3.4 对冬枣可溶性固形物的影响
冬枣的可溶性糖含量很高,是其重要的营养物质,也是呈现冬枣口感的重要因子。由图6可以看出,经过拮抗酵母S24处理后,冬枣可溶性固形物含量的代谢速率减缓,延迟了高峰期的到来。由此可见,拮抗酵母S24能够抑制冬枣可溶性固形物的代谢速率。
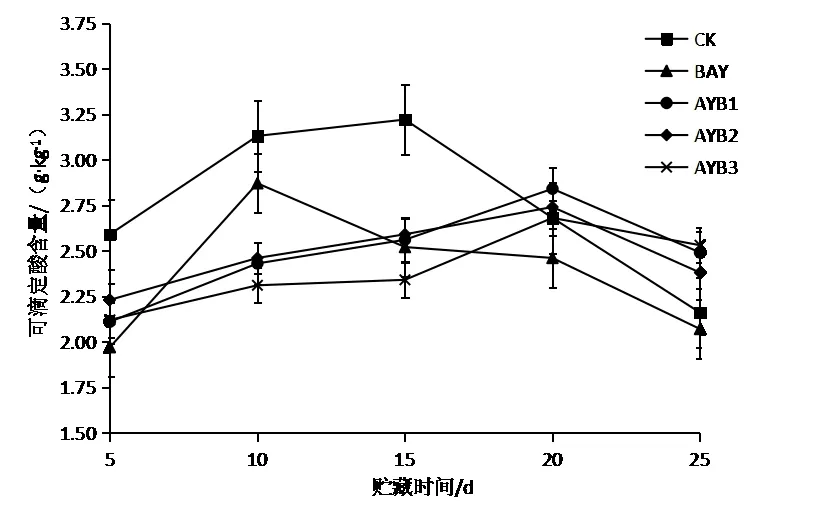
图3拮抗酵母S24对冬枣可滴定酸含量的影响
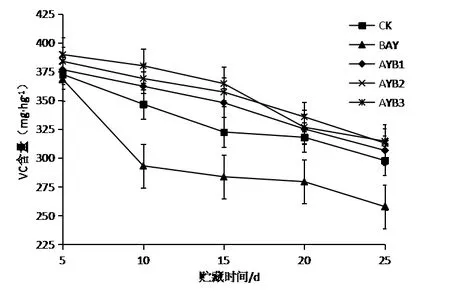
图4拮抗酵母S24对冬枣中VC含量的影响
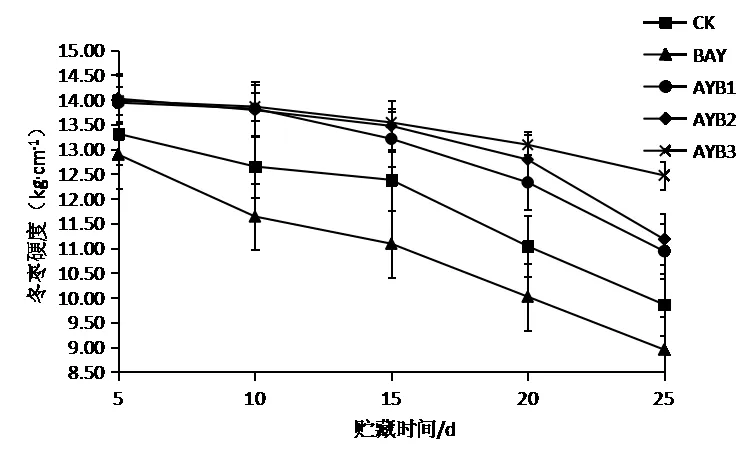
图5拮抗酵母S24对冬枣硬度的影响
2.3.5 对冬枣失重率及其自然腐烂率的影响
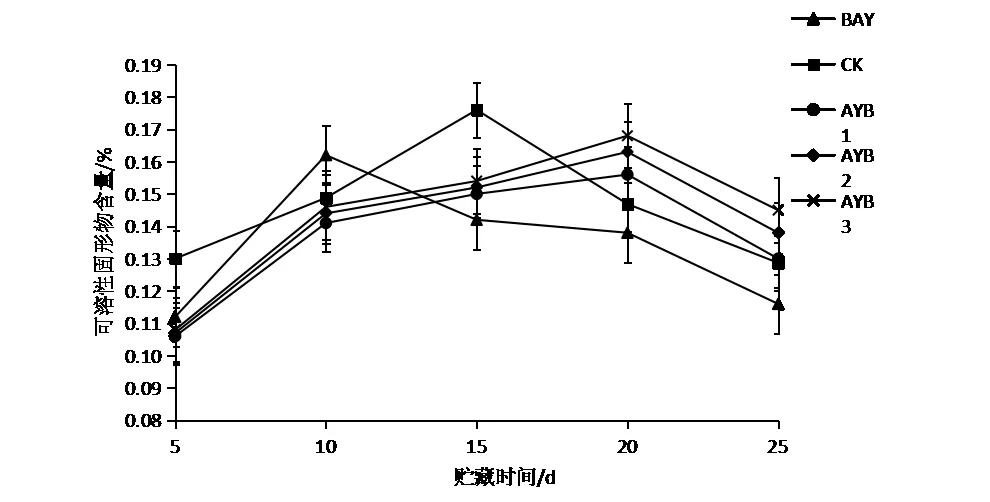
图6拮抗酵母S24对冬枣可溶性固形物含量的影响
冬枣贮藏期由于受环境及自身携带微生物侵染而导致腐败变质,这直接影响冬枣的商品货架期。由表2可知,冬枣贮藏25 d后,拮抗酵母S24处理组的腐烂率显著低于BAY组与CK对照组(p<0.05);此外,拮抗酵母S24处理组还能够显著降低冬枣的失重率,有助于保持冬枣的贮藏品质。因此,选用拮抗酵母作为冬枣采后病害生物防治菌种是可行的。
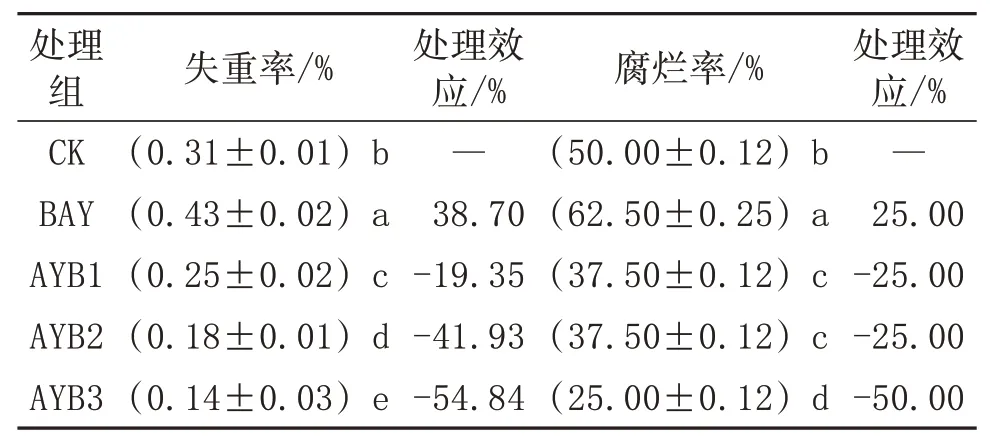
表2拮抗酵母S24对贮藏25 d冬枣的失重率及其自然腐烂率的影响
3 讨论与结论
近些年来,酵母菌应用于果蔬采后病害的生物防治越来越受到人们的重视[16-17]。与其他生防微生物相比,酵母菌作为果蔬生物防治拮抗菌最大的优点是能够在较干燥的果蔬表面生存,并且能够迅速繁殖,受杀虫剂的影响也较小[18]。对于果蔬采后拮抗酵母菌的分离方法,大多数研究者还是倾向于从果蔬表面直接分离,一方面拮抗酵母一般对人、畜无毒害[19-20],另一方面能够适应果蔬表面的微生态环境。本次实验仅从抑菌效果、小批量冬枣贮藏保鲜效果方面筛选出适用于冬枣采后病害生物防治的酵母菌,而未探究拮抗酵母菌的增殖培养条件及生化特性等。
离体筛选试验结果显示,拮抗酵母菌(S24)的抑菌效果最佳。从贮藏期间果实内含物质含量的变化情况可知,该拮抗酵母能有效抑制冬枣在低温贮藏条件下的自然腐烂,并较好地保持冬枣贮藏期间的相关品质指标值。因此,该株酵母菌适用于冬枣采后腐烂病害的生物防治。

