离子色谱-三重四极杆质谱法同时测定血浆和尿液中百草枯和敌草快
张秀尧, 蔡欣欣, 张晓艺, 李瑞芬
(温州市疾病预防控制中心, 浙江 温州 325001)

图 1 百草枯和敌草快的化学结构Fig. 1 Chemical structures of paraquat (PQ) and diquat (DQ)
百草枯(paraquat, PQ)和敌草快(diquat, DQ)为世界上产量第二和第三的灭生型除草剂(化学结构见图1),二者常配伍使用。百草枯对人类的毒性极大,中毒时病变主要发生于肺部,称为百草枯肺。百草枯可使患者肺细胞纤维化,气体交换严重受损,致使患者血液和组织缺氧而最终导致死亡[1-4]。百草枯的中毒多因自杀吞服引起,2016年7月1日起,我国明令禁止百草枯水剂在国内使用和出售,此后敌草快的销量逐渐上升,敌草快中毒的患者也随之增多。敌草快的生产成本较百草枯高,有少数商家为了牟利,将百草枯改名为“敌草快”或将百草枯掺入敌草快中出售。敌草快属于中等毒性除草剂,毒理作用与百草枯相似,但毒性小于百草枯,也可引起死亡[5-7]。百草枯和敌草快中毒病人目前无特效治疗药,中毒病死率高,对血浆和尿液中百草枯和敌草快浓度的同时监测,可以为临床早期诊断和预后提供有价值的信息。
血浆和尿液中百草枯和敌草快的主要检测方法有紫外分光光度法[8]、液相色谱法[9-10]、高效液相色谱-串联质谱法(HPLC-MS/MS)[11-13],其中液相色谱-质谱法是检测百草枯和敌草快最常用方法,然而百草枯和敌草快均为强极性水溶性化合物,在反相色谱柱上难以保留。在流动相中加入离子对试剂,如七氟丁酸(HFBA),有助于反相色谱柱保留PQ和DQ[11,13],但离子对试剂有离子抑制作用,会降低质谱检测的灵敏度,同时还会给质谱系统增加额外的污染,也有采用亲水色谱(HILIC)-质谱法分离血浆和尿液中PQ和DQ[12,14-17],但流动相中需加入高浓度的甲酸铵缓冲盐,也会影响质谱的响应值,同时亲水色谱法分离易受基质成分影响,保留时间不稳定。
离子色谱-质谱法在环境和食品检测中的应用越来越广泛[18-20],近年来也开始应用于生物样品的检测[21,22],但多采用阴离子交换色谱与质谱联用。有关阳离子交换色谱-三重四极杆质谱法测定血浆和尿液中百草枯和敌草快的检测方法鲜有文献报道。考虑到百草枯和敌草快在水溶液中以双电荷联吡啶离子状态存在,更适合采用阳离子交换色谱法分离,本文将血浆和尿液样品的水稀释液直接通过混合型聚合物反相吸附和弱阳离子交换的固相萃取柱(Oasis WCX SPE)进行净化,处理液中待测化合物经阳离子交换色谱柱分离,三重四极杆质谱法检测,稳定同位素内标法定量,方法灵敏、准确、精密。
1 实验部分
1.1 仪器、试剂与材料
离子色谱系统由Dionex ICS-1100离子色谱仪、淋洗液发生器(RFC-30)、电解再生抑制器(CDRS 600)和自动进样器(DV-AS)组成,由变色龙工作站(7.22版)控制(美国Thermo Scientific公司); QTRAP 6500三重四极杆/复合线性离子阱质谱仪(美国AB SCIEX公司); 24孔N-EVAP氮吹仪(美国Organomation公司); Gradient A10 Mill-Q超纯水器(法国Millipore公司)。
甲醇、甲酸和乙腈均为色谱级(德国Merck公司); Oasis WCX混合型聚合物反相吸附和弱阳离子交换固相萃取柱(60 mg/3 mL,美国Waters公司),临用时分别用各3.0 mL甲醇和水活化;百草枯二氯化物(纯度为97.5%)和敌草快二溴化物标准物质(纯度为98.0%)(德国Dr. Ehrenstorfer公司),百草枯-d8二氯化物(纯度为98.5%)和敌草快-d4二溴化物标准物质(纯度为98.7%) (加拿大CDN公司)。健康人血浆经浙江省卫生行政部门审批,由温州市中心血站提供,尿液由健康志愿者提供。
用水溶解标准物质并稀释成1.00 mg/mL的标准储备溶液,于-20 ℃保存。临用时再用水稀释成混合标准工作溶液,其中百草枯和敌草快的质量浓度分别为2.0 μg/mL和1.0 μg/mL;用水稀释制成混合内标工作溶液,其中百草枯-d8和敌草快-d4的质量浓度分别为0.20 μg/mL和0.10 μg/mL。
1.2 实验条件
1.2.1样品前处理
吸取100 μL血浆或尿液,置于2 mL Eppendrof管中,加入10 μL混合内标工作溶液,混匀,放置30 min,再加入900 μL水,混匀,以1.0 mL/min的流速上样于Oasis WCX SPE柱,分别用3.0 mL水和甲醇淋洗,再用2.0 mL含2%(v/v)甲酸的88%(v/v)乙腈水溶液洗脱,洗脱流速为1.0 mL/min,洗脱液收集于5 mL Eppendorf管中,于50 ℃氮气吹干,加入1.0 mL水,旋涡溶解,溶解液转移入0.5 mL带滤头自动进样瓶中,待测。
1.2.2色谱条件
分析柱为Ionpac CS 18型色谱柱(250 mm×2 mm, 6.0 μm),保护柱为CG18(50 mm×2 mm, 7.0 μm), CDRS 600阳离子抑制器(2 mm,外加水模式),甲磺酸(MSA)淋洗液由RFC-30在线自动产生。梯度淋洗程序:0~4.0 min, 30 mmol/L MSA; 4.0~7.0 min, 30 mmol/L MSA~60 mmol/L MSA; 7.0~11.0 min, 60 mmol/L MSA; 11.0~11.1 min, 60 mmol/L MSA~30 mmol/L MSA; 11.1~15.0 min, 30 mmol/L MSA。淋洗液流速为0.30 mL/min;柱温为45 ℃;通过三通装置在抑制器流出液中泵入3%(v/v)甲酸乙腈溶液,流速为0.30 mL/min,进样体积为10 μL。
1.2.3质谱条件
电喷雾电离(ESI)源,正离子扫描方式,多离子监测(MRM)模式检测。离子化电压(IS): 4 500 V,离子源温度(TEM): 600 ℃,气帘气(CUR)压力:277 kPa,喷雾气(GS1)压力:277 kPa,辅助加热气压力(GS2): 414 kPa,碰撞器(CAD)压力强度:Medium;优化后的各待测物的母离子、子离子、去簇电压和碰撞能量等参数见表1。

表 1 百草枯、敌草快及同位素内标物的质谱参数
* Quantitative ion.
2 结果与讨论
2.1 实验条件考察
2.1.1质谱条件优化

图 2 百草枯和敌草快前体离子的质谱图Fig. 2 Mass spectra of precursor ions of paraquat and diquat



图 3 百草枯和敌草快及同位素内标物的子离子质谱图Fig. 3 Mass spectra of product ions of paraquat, paraquat-d8, diquat and diquat-d4
2.1.2离子色谱条件优化
百草枯和敌草快属季铵盐化合物,极性大,反相色谱柱难以保留,有文献采用离子对反相色谱法[11,13,24]和亲水作用色谱法[14-17,23]分离百草枯和敌草快,也有使用基于离子液体机理的Trinity P1[25]和Trinity Q1色谱柱来分离[26]。百草枯和敌草快极易被玻璃和不锈钢等材料吸附,(超)高效液相色谱仪的管路和色谱柱大都是不锈钢材质,同时硅胶基色谱柱上残留的硅羟基对带正电荷的PQ和DQ会有二级吸附作用,表现为较宽且拖尾的色谱峰,为了减少吸附,往往在流动相中加入较高浓度的甲酸铵或离子对试剂,而高浓度的缓冲盐和离子对试剂对质谱信号有抑制作用,且会对质谱系统产生不利影响。
离子色谱仪的管路为全聚醚醚酮(PEEK)材料,不会非特异吸附PQ和DQ, IonPac CS 18型色谱柱为中等容量羧酸型弱阳离子交换聚合物基的色谱柱,特别适合PQ和DQ的分离。采用淋洗液发生器产生的甲基磺酸作为流动相进行梯度洗脱分离,PQ和DQ在Ionpac CS 18色谱柱上能很好保留。PQ和DQ在化学结构上属于同系物,只能实现部分分离,采用多反应监测(MRM)模式进行检测时,只要二者在质谱通道上没有相互干扰,即使只有部分分离也不影响定量分析,但PQ和DQ的相对分子质量只相差2,不确定在质谱通道上是否有相互干扰。因此本实验首先进样PQ,然后在DQ质谱通道上没有观察到色谱峰,再进样DQ,在PQ质谱通道上也没有观察到色谱峰,说明它们不存在相互干扰。色谱柱流出液经阳离子抑制器抑制,去除了流动相中甲基磺酸根离子等阴离子后生成纯水,实验发现,纯水体系进入质谱离子源不利于PQ和DQ的离子化。有文献[27]报道,利用高压泵以一定的比例泵入乙腈、甲醇等有机溶剂通过三通装置与抑制器流出液汇合后再进入质谱进行测定,可以改善待测物的电离效果,从而使质谱信号有数倍增加。考虑到如果泵入甲醇,与水混合易产生气泡,且压力较高,而阳离子抑制器中膜的耐压为692 kPa,而乙腈与水混合后压力较低,因此选择泵入乙腈,观察到PQ和DQ的响应值有所增高。实验比较了以0.10、0.20和0.30 mL/min的流速泵入乙腈时的质谱响应值,结果表明,泵入的流速≥0.20 mL/min时,PQ和DQ质谱响应值最高,与不泵入乙腈相比,响应值有1~2倍提高。但仅泵入乙腈,PQ和DQ在质谱上有残留,使得基线抬高,这可能是离子源上电喷雾针为金属材料,其吸附PQ和DQ,而引起的残留效应。在乙腈中加入甲酸可以减少残留效应,实验选用含3%(v/v)甲酸的乙腈溶液作为柱后泵入溶剂,流速为0.30 mL/min时,可完全消除残留效应。加标血浆样品中百草枯(1.0 μg/L)和敌草快(0.5 μg/L)的色谱图见图4。
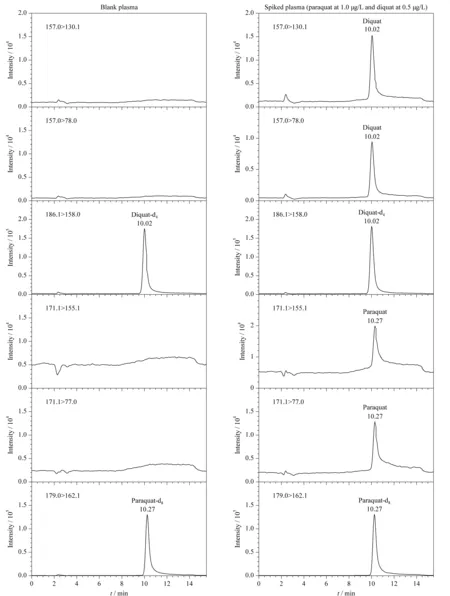
图 4 空白和加标血浆样品中百草枯和敌草快的色谱图Fig. 4 Chromatograms of paraquat and diquat in blank and spiked plasma samples
2.1.3前处理条件优化
血浆和尿液中PQ和DQ的提取和净化方法有很多,包括乙腈蛋白沉淀法[14-15]、甲醇蛋白沉淀法[16]、液液萃取法(LLE)[28]和固相萃取法(SPE)[13,17,24]等。蛋白沉淀法净化效果不佳,基质效应(ME)比较严重;LLE回收率不高,操作烦琐;基于强(弱)阳离子交换机理[17,24]和反相色谱机理[13]的固相萃取法已成功用于PQ和DQ的提取和净化。考虑到基质效应和回收率等综合因素,本法采用混合型聚合物反相吸附和弱阳离子交换的固相萃取柱,用于样品的前处理。
考虑到PQ和DQ中毒大多数是由自杀引起的,血浆和尿液中PQ和DQ浓度往往较高,故将洗脱液氮气吹干后溶于1.0 mL水中,稀释样品10倍。取来自6份不同个体的血浆和尿液样品,经样品前处理后进样分析,结果显示内源性物质均不干扰待测物的测定。因为PQ和DQ易被玻璃材料吸附,故操作全程应避免接触玻璃器皿。
2.2 方法学考察
2.2.1线性范围、检出限和定量限
对系列混合标准工作溶液和混合内标工作溶液进行分析,其中百草枯的质量浓度分别为1.0、3.0、10、20、100和150 μg/L,敌草快的质量浓度分别为0.5、1.5、5.0、10、50和75 μg/L,百草枯-d8和敌草快-d4的质量浓度分别为2.0 μg/L和1.0 μg/L,采用MultiQuant定量软件处理,以定量离子对与内标物的峰面积比值(Y)对物质的质量浓度(X, μg/L)进行线性回归(权重取1/X)。结果表明,百草枯和敌草快分别在1.0~150 μg/L和0.5~75 μg/L范围内线性关系良好,回归方程分别为Y=0.508X+0.029 3和Y=0.365X+0.016 6,相关系数均>0.999。
在空白血浆和尿液样品中分别加入系列低浓度的待测物进行测定,以两对分子离子对的信噪比均≥3和≥10时的样品浓度作为检出限(LOD)和定量限(LOQ),结果测得血浆和尿液中百草枯和敌草快的检出限分别为0.3 μg/L和0.2 μg/L,定量限分别为1.0 μg/L和0.5 μg/L,能够满足中毒检测的要求。

表 3 血浆和尿液中PQ和DQ的基质效应和提取回收率(n=5)
2.2.2加标回收率和精密度试验
按欧洲药品管理局(EMEA)的要求[29]在定量限、3倍定量限(low QC)、中等浓度(medium QC)和高浓度(high QC)进行加标回收率和精密度试验,在空白血浆和尿液中加标使百草枯和敌草快的质量浓度分别为1.0、3.0、20、120 μg/L和0.5、1.5、10、60 μg/L,每个水平平行测定6次,血浆中百草枯和敌草快的平均加标回收率分别为93.5%~117%和91.7%~112%,相对标准偏差(RSD)分别为3.4%~16.7%和2.8%~13.2%;尿液中百草枯和敌草快的平均加标回收率分别为90.0%~118%和99.2%~116%, RSD分别为5.6%~14.9%和2.4%~17.3%(见表2)。结果符合EMEA的要求。
2.2.3基质效应和提取回收率
在空白血浆和尿液的前处理液中加入PQ(1.0、3.0、20、120 μg/L)和DQ(0.5、1.5、10、60 μg/L)混合标准工作溶液制成基质标准溶液,测定PQ和DQ的峰面积(A),再测定相同水平溶剂标准溶液中PQ和DQ的峰面积(B),平行测定5次。根据公式ME=A/B×100%[30]计算基质效应。
提取回收率为空白血浆和尿液加标样品中PQ和DQ的峰面积(C)与相同水平基质标准溶液中PQ和DQ的峰面积之比,公式为提取回收率=C/A×100%[30]。PQ和DQ的评估水平分别为1.0、3.0、20、120 μg/L和0.5、1.5、10、60 μg/L,平行试验5次(见表3)。结果显示,PQ和DQ在血浆和尿液中存在一定的基质效应,可以通过稳定同位素稀释法进行定量,校正样品的基质效应和提取回收的不完全。
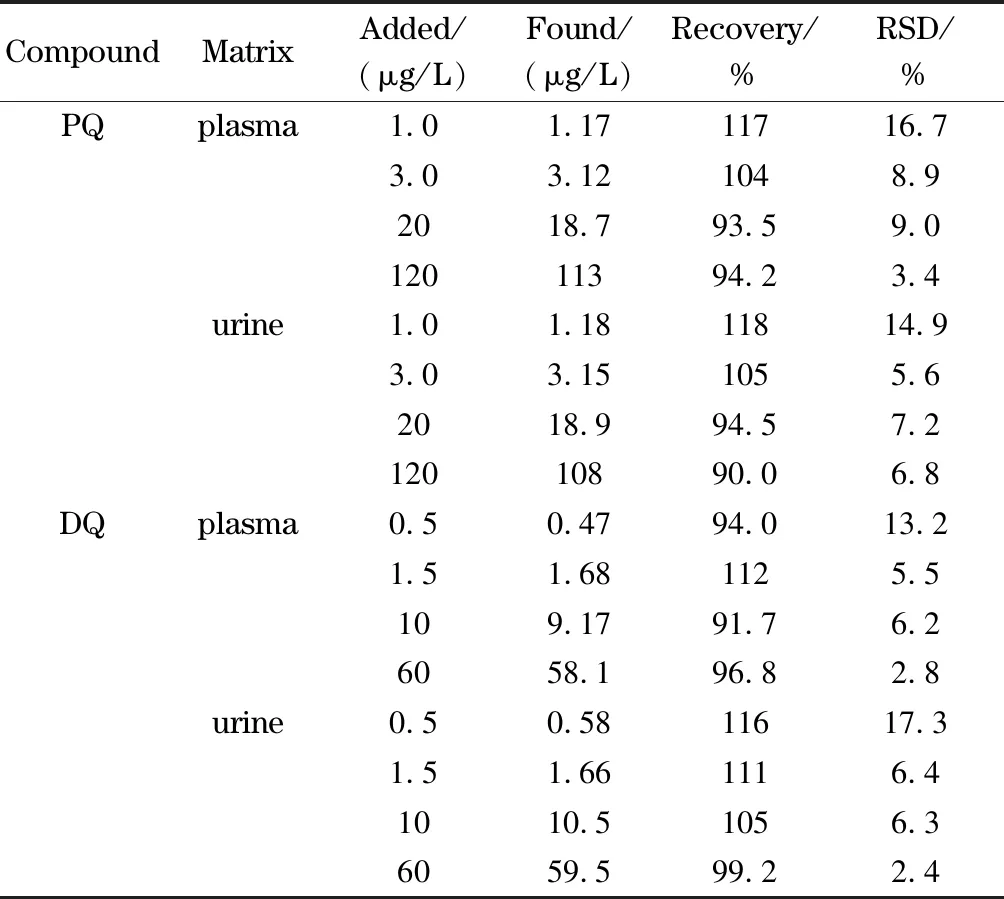
表 2 空白血浆和尿液样品中PQ和DQ的加标回收率
2.2.4稳定性试验
各取3份加标血浆和尿液样品,其中百草枯和敌草快质量浓度为10 μg/L和5 μg/L,将样品处理液在自动进样器上室温放置72 h,每间隔24 h测定1次,与标称值比较,结果显示百草枯和敌草快的相对偏差均在±10%之间。
取低水平(百草枯3.0 μg/L和敌草快1.5 μg/L)和高水平(百草枯130 μg/L和敌草快65 μg/L)的血浆和尿液样品,储藏于具塞聚丙烯离心管中,分别在经过3个冷冻(-20 ℃)与室温融化过程、冷藏(2~6 ℃)保存5 d和-20 ℃冷冻保存1个月后再测定,与标称值比较,测得百草枯和敌草快的相对偏差均在15%以内,符合要求。
3 结论
本文建立了测定血浆和尿液中百草枯和敌草快的离子色谱-三重四极杆质谱检测方法,通过对精密度、准确度和灵敏度等方法学考察,验证了方法的有效性,结果表明该方法可用于百草枯和敌草快的中毒检测。