血清CRP与肿瘤标志物的联合检测对原发性肝癌诊断中的应用价值
熊晓波 杨 柳 李 艳
原发性肝癌(primary hepatocellular carcinoma,PLC)是常见的恶性肿瘤之一。寻找和研究除甲胎蛋白(alpha-fetoprotein,AFP)以外的肝癌诊断、疗效观察的肿瘤标志物,是近年来研究的目标之一[1-2]。肿瘤标志物是肿瘤细胞直接产生或非肿瘤细胞在肿瘤细胞的诱导下合成的1种物质,其可释放后入血;CRP是1种炎症以及组织损伤时出现的1种非特异性标志物,且均可在血液中检测。C反应蛋白CRP近年来在诊断胃肠道恶性肿瘤方面也逐渐受到重视[3]。本文主要通过CRP及血清肿瘤标志物癌胚抗原CEA甲胎蛋白AFP糖类抗原CA-125和CA19-9联合检测来探讨这些原发性肝癌患者治疗前后血清CRP以及肿瘤标志物阳性检出率血清学指标对原发性肝癌诊断中的应用价值。现报告如下。
1 材料与方法
1.1 一般资料
2017年5月至2018年6月本院住院的PLC患者80例为PLC组,男性65例,女性15例;年龄28~64岁(平均53.9岁);临床Ⅰ期18例,Ⅱ期 27例、Ⅲ期35例;均经病理诊断确诊,肝组织损害程度检测均采用超声引导下肝穿刺活检或肝组织常规病理切片诊断。同期良性肝病组36例为肝血管瘤、肝硬化、慢性肝炎患者,其中男性27例,女性9例;年龄18~75岁(平均41岁);所有患者均经临床、螺旋 CT、B超和血清学检验确诊。同期健康体检者30例为对照组,男性23例,女性7例;年龄 20~60岁(平均46岁)。3组年龄、性别差异无统计学意义(P>0.05)。
1.2 方法
所有研究对象均有完整的病历资料,采血前未进行放疗、化疗等治疗。患者于入院时、治疗后及复发时,禁食过夜,次日清晨抽取空腹静脉血3 ml,3 000 rmin离心5 min。采用免疫速率散射浊度法测定血清CRP,检测仪器为SIEMENS ADVIA2400生化分析仪,试剂来源为SIEMENS公司原装配套试剂;化学发光免疫技术双抗体夹心法测定血清肿瘤标志物(CEA、AFP、CA125、CA19-9)。仪器为ADVIA CENTUAR XP全自动化学发光免疫分析仪,试剂来源为 SIEMENS公司原装配套试剂盒。阳性结果判断标准 CEA≥3.4 μg/l,AFP≥11.3 IU/ml,CA125≥35 U/ml,CA19-9≥39 U/ml,血清CRP规定范围在0~10 mg/l[4]。
1.3 观察项目
肿瘤标志物阳性:CEA≥3.4 μg/l,AFP≥11.3 IU/ml,CA125≥35 U/ml,CA19-9≥39 U/ml;血清CRP阳性:CRP>8 mg/l。对比研究对象肿瘤标志物以及血清CRP水平,对比治疗前后患者肿瘤标志物以及血清CRP水平[5]。
1.4 统计学处理
2 结果
2.1 各组入院时血清CRP及肿瘤标志物测定结果比较
良性组和恶性组入院时血清CRP及肿瘤标志物水平均高于对照组,恶性组入院时血清CRP及肿瘤标志物水平均高于良性组,差异均存在显著统计学意义(P<0.05),见表1。

表1 各组入院时血清CRP以及肿瘤标志物测定结果
2.2 恶性组各亚组与良性组入院及治疗后血清CRP及肿瘤标志物阳性结果比较
治疗后恶性组各亚组血清CRP及肿瘤标志物阳性率明显下降。与治疗前比较差异有统计学意义(P<0.05),见表2。恶性组CRP及肿瘤标志物水平在治疗后较入院时明显降低,差异有统计学意义(P<0.05)。随访35例复发患者,复发时CRP及肿瘤标志物水平明显升高,差异有统计学意义(P<0.05)。

表2 原发性肝癌患者治疗前后血清CRP以及肿瘤标志物阳性检出率(例,%)
2.3 CRP单独及联合肿瘤标志物检测原发性肝癌的ROC曲线下面积(AUC)分析
血清CRP单独诊断原发性肝癌的ROC曲线下面积(AUC)为(0.732;95%CI:0.613~0.827),CRP联合肿瘤标志物诊断原发性肝癌的检测水平高于CRP(AUC:0.860;95%CI:0.769~0.914),见表3。
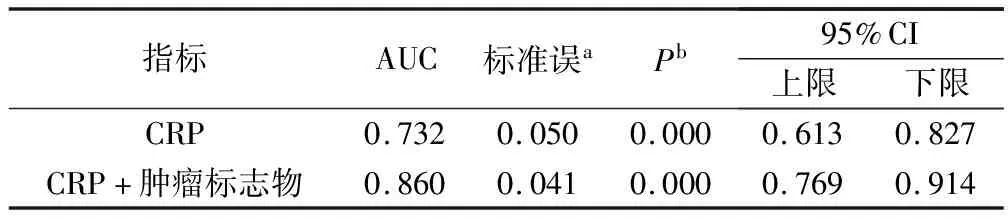
表3 单个指标及联合肿瘤标志物检测的ROC曲线下面积(AUC)分析
2.4 单独及联合检测对原发性肝癌诊断的效能
当CRP取24.32 mg/l为最佳截断点时,区分输尿管软镜术后尿源性脓毒血症及原发性肝癌良性与恶性的灵敏度为79.68%、特异性83.99%、准确度88.52%、阳性预测值74.92%、阴性预测值69.48%;CRP和肿瘤标志物联合检测灵敏度为85.92%、特异性为88.49%、准确度90.36%、阳性预测值80.13%、阴性预测值75.45%,差异有统计学意(P<0.05)。
3 讨论
3.1 原发性肝癌及肿瘤标志物检测
原发性肝癌(以下简称肝癌)是我国第四位的常见恶性肿瘤和第三位的肿瘤致死病因,对我国人民的健康造成了极大威胁[6-8]。考虑到肝癌肿瘤生物学的复杂性和各种治疗手段的局限性,应用多学科协作、多种治疗方法共存的综合治疗已成为肝癌治疗领域的共识。近年来,高水平的临床研究证据层出不穷,肝癌综合治疗策略仍在不断发展和细化中[9-10]。
血清CRP(C反应蛋白),是1种能和肺炎球菌C多糖体反应继而形成符合物的急性时相反应蛋白,其在炎症、感染以及组织损伤时浓度迅速上升。其可通过激活补体继而消耗补体,释放炎性介质,进一步活化淋巴细胞,激活血小板,是反应各种炎症和创伤的敏感指标[11]。血清肿瘤标志物是1种肿瘤细胞直接产生或者通过肿瘤细胞诱导合成的物质,其主要包括CRP、CAl 9-9、CAl25、CEA及AFP等[12]。肿瘤标志物可释放后入血或存在于其他的体液中,所以可通过血液检测检出,其可对肿瘤的发生发展以及临床预后等进行评估。近几年随着医疗技术的不断进步,肿瘤标志物检测已经作为肿瘤检测的重要指标,但作为单一的肿瘤诊断指标还不具强有力的说服力。但是肿瘤标志物检测存在特异性较差以及阳性率较低等缺点,导致肿瘤标志物单独检测应用受限[13-14]。C反应蛋白为急性时相蛋白,一旦机体出现组织损伤、炎症以及感染时,CRP 水平明显升高,作为组织损伤以及炎症反应的非特异性标志物在临床上有着广泛应用,而且随着医疗水平的不断进步,CRP检测灵敏度也不断获得提高[15]。大量临床研究表示,血清CRP联合肿瘤标志物检测对于原发性肝癌的诊断和临床预后评估具有重要价值。
3.2 各组入院时血清CRP以及肿瘤标志物测定结果分析
原发性肝癌转移过程中常伴有癌栓形成,肝癌血管侵犯的机制十分复杂,其中炎症反应、抗肿瘤免疫力、凝血功能和肿瘤特征等均发挥重要作用。影响原发性肝癌血管侵犯的因素很多,如肿瘤直径大小、Fb、NLR 和PLR 等[16-17]。多因素共同作用导致原发性肝癌血管侵犯,影响肝癌患者预后。原发性肝癌对血清 CRP反应极为敏感,人院时其测定值明显高于恶性组及对照组,提示血清 CRP 在早期原发性肝癌疾病中的鉴别诊断价值不大,但是联合其他肿瘤标志物检测可能会提高原发性肝癌的检出率,为临床起到预警作用[18-19]。原发性肝癌患者存在程度各异的炎性反应,因此,机体内C反应蛋白水平存在升高现象,恶性肿瘤的发生以及发展与慢性感染、炎症等具有密切关联[20]。治疗后恶性组各亚组血清CRP及肿瘤标志物阳性率明显下降。
3.3 原发性肝癌患者治疗前后血清CRP以及肿瘤标志物阳性检出率分析
治疗后恶性组各亚组血清CRP及肿瘤标志物阳性率明显下降。恶性组CRP及肿瘤标志物水平在治疗后较入院时明显降低,差异有统计学意义(P<0.05)。随访35例复发患者复发时CRP及肿瘤标志物水平明显升高,差异有统计学意义(P<0.05)。本次结果显示,原发性肝癌患者的血清CRP和肿瘤标志物水平明显较健康对照组高,恶性组血清CRP水平明显低于良性组,CEA、CAl9-9、CAl25以及AFP明显高于良性组,上述差异均存在显著性。此外,经过治疗后,原发性肝癌患者上述指标阳性检出率显著下降。由此可见,血清CRP、肿瘤标志物作为原发性肝癌诊断和治疗检测的观察指标,具有较高的敏感性。本研究联合血清传统指标CRP与肿瘤标志物对原发性肝癌的诊断进行效能评估,结果显示联合检测的灵敏度、特异性、准确度、阳性预测值及阴性预测值均高于单独CRP检测,以此为原发性肝癌的诊断提供了合理的诊断依据。
研究局限性本研究的不足之处 由于现代医疗手段的发达,肿瘤患者的术后复发率已经大大降低。5年生存率逐步延长,复发时各检测结果的留取及入组对象的选取上有一定的难度。导致样本量有些不足,应收集更多病例,完善随访资料,进一步加大研究。
肿瘤标志物与CRP的联合检测,可以为临床医生提供更多的疾病信息,降低高危人群恶性肿瘤病死率。在治疗后的疗效观察,病情判断中也有较好的应用价值。

