过表达本氏烟基因NbPAP2对转基因植物生长发育的影响
代庭伟,吕雪艳,陈 放,徐 莺
(四川大学生命科学学院 教育部生物资源与生态环境重点实验室,成都 610065)
1 引 言
磷是植物生长发育所必需的重要元素之一.作为核糖核酸和脱氧核糖核酸的重要组成部分,磷不仅影响细胞的分裂和分化,同时还参与光合作用过程中蔗糖的生物合成,促进植物生长发育,有利于种子的养分积累[1].酸性磷酸酶(APase)是酸性条件下(pH<7.0)能催化磷酸单酯或酸酐裂解从而释放无机磷酸根离子的水解酶类[2].其中的紫色酸性磷酸酶(Purple acid phosphatase,PAP)因其酶提取液呈紫色或粉色而得名.PAP除具有酸性磷酸酶都有的5个保守结构域和双金属离子催化中心外,其活性还不受酒石酸盐抑制[3-4].研究显示紫色酸性磷酸酶在植物应答低磷胁迫时,通过其水解磷化合物的能力来调节磷的获取和再分配[5].此外,一些PAPs除了参与磷代谢外,还具有其他的生物学功能.例如大豆GmPAP3[6]和拟南芥AtPAP17[7]具有过氧化物酶活性.烟草NtPAP12可以使载脂蛋白的磷酸化残基去磷酸化,可能参与细胞壁再生过程[8].通过C端疏水基序同时靶向叶绿体和线粒体的拟南芥AtPAP2则是参与植物的碳代谢过程,有报道指出,过表达AtPAP2的拟南芥蔗糖磷酸合成酶SPS活性和蔗糖含量均提高,生长发育加速并且种子产量增高[9].
茄科(Solanaceae)植物广泛分布于热带及温带地区,其中有多种重要的蔬菜、经济、观赏和药用植物,如马铃薯、番茄、辣椒、茄子、枸杞、烟草、天仙子、碧冬茄等.产量或生物量是农业生产上衡量茄科植物的重要经济指标之一,因此对于茄科植物磷元素吸收及利用机制的研究具有重要意义.本氏烟(Nicotianabenthamiana)是茄科植物的一员,也是常见的模式植物,对其磷利用机制的研究有助于茄科植物的品种改良.因此本文利用生物信息学、分子生物学及生理学相关技术对AtPAP2同源基因NbPAP2功能的初步研究,了解其在蔗糖代谢和增加植物产量相关途径中可能发挥的作用,为茄科植物产量的增加提供新的思路和方法.
2 材料和方法
2.1 材 料
2.1.1 植物材料 本氏烟(Nicotianabenthamiana)由四川大学生命科学学院植物发育与生殖实验室保存.
2.1.2 PCR引物 见表1.

表1 PCR扩增引物Tab.1 Primers for PCR assays
2.2 方 法
2.2.1NbPAP2基因的克隆 以拟南芥AtPAP2基因序列为模板,在本氏烟基因组Nicotianabenthamianadraft genome sequence v1.0.1数据库(https://solgenomics.net/organism/Nicotiana_benthamiana/genome)中进行序列比对,选择同源性最高的基因序列,根据所得基因序列设计引物NbPAP2-F和NbPAP2-R(表1),通过PCR扩增获得.
2.2.2 生物信息学分析 序列同源性比较采用BLASTn/BLASTp(https://blast.ncbi.nlm.nih.gov/ Blast. cgi)和CLC sequence Viewer6 (本地);信号肽预测采用SignalP 4.1 Server(http:// www.cbs.dtu.dk/services/SignalP/);疏水性预测采用ExPASy-ProtScale(https:// web. expasy.org/protscale/);亚细胞定位采用PredictProtein(https://www. predictprotein.org/).
2.2.3 荧光定量PCR分析 利用RNAPrep Pure Plant Kit试剂盒(天根)提取本氏烟各个不同组织:根、茎、幼叶、成熟叶、花瓣、花萼、幼果、成熟果的总RNA,使用PrimeScriptTMRT reagent Kit (Perfect Real Time)将所提取RNA反转录成cDNA,然后用SYBR© Premix Ex TaqTMII试剂盒(Bio-Rad)在Bio-Rad IQ5 PCR仪进行qRT-PCR反应,引物序列见表1.
2.2.4 过表达转基因植株的获得及鉴定 通过同源重组方法将NbPAP2基因插入pKSE-35S载体XbaⅠ和SacⅠ之间(图1),测序鉴定后导入根癌农杆菌,使用叶圆盘法转化本氏烟叶片外植体,对获得的卡纳霉素抗性植株进行PCR筛选,然后用q-PCR方法对PCR阳性植株NbPAP2的转录水平进行定量分析.所用引物见表1.

图1 重组载体pKSE-NbPAP2线性图谱及引物位置Fig.1 Linear map of the recombinant vector pKSE-NbPAP2 and primer positions
2.2.5 光合速率和气孔导度的测定 于上午8:30~11:00间,选取株龄90 d植株的完全展开叶片,每一株系选取三株,每株选取三片,使用CIRAS-2便携式光合/荧光测定系统(英国PP Systems公司),分别测定光合有效辐射(Photosynthetically active radiation,PAR)为200、400、600、800、1000μmol/m2/s时的光合速率(Pn)和气孔导度(Gs)的值,每个叶片测定三次.
2.2.6 转基因烟草蔗糖含量测定 蔗糖含量采用蒽酮比色法[10]测定新鲜成熟烟草叶片(避开主叶脉).
2.2.7 转基因烟草SPS酶活性测定 蔗糖磷酸合成酶SPS的活性采用间二苯酚法测定[11].
3 结果与分析
3.1 本氏烟紫色酸性磷酸酶家族成员NbPAP2主要在成熟组织表达
以拟南芥AtPAP2基因序列为模板,通过序列比对,在本氏烟基因组数据库(Nicotianabenthamianadraft genome sequence v1.0.1)中获得与其同源性最高的同源基因序列信息(登录号Niben101Scf04400g02005.1),然后以本氏烟植株的总RNA反转录得到的cDNA为模板扩增得到该基因,命名为NbPAP2.NbPAP2基因开放读码框全长1959bp,推测的蛋白质含652个氨基酸残基.与普通烟草(Nicotianatabacum)、辣椒(Capsicumannuum)、马铃薯(Solanumtuberosum)、番茄(Solanumlycopersicum)中同源基因(XM_016654955.1、XM_016717209.1、XM_006344186.2、XM_004237004.4)的核酸序列相似性分别达到96%、88%、87%、86%,而与拟南芥(Arabidopsisthaliana)AtPAP2(NM_101256.3)核酸序列的相似性为68%,氨基酸序列同源性则为64.2%.SignalP 4.1 Server预测出NbPAP2在N端存在信号肽(图2A),在线ProtScale模块预测出多肽链第622位氨基酸处疏水性最强(图2B),Protein Predict预测的结果显示NbPAP2蛋白可能定位于叶绿体(图2C),这与AtPAP2蛋白预测结果一致从而或许与其他植物PAP蛋白存在差异.
为了了解NbPAP2是否属于紫色磷酸酶家族成员,对本氏烟草、普通烟草、辣椒、马铃薯和拟南芥共五个PAP2成员和一个AtPAP9进行氨基酸序列比对分析后,发现它们都具有紫色酸性磷酸酶家族的特征基序,即由五个保守基序(DXG/ GDXXY/ GNH(D/E))/VXXH/GHXH)构成的双核金属离子中心[12],同时与金属离子结合的七个关键氨基酸残基也非常保守(图1D).这似乎说明茄科植物的PAP成员与十字花科的拟南芥PAP具有一定程度上相似的功能.
提取野生型本氏烟植株的根、茎、幼叶、成熟叶、幼果、成熟果、花萼以及花瓣等不同组织的总RNA,反转录后使用qRT-PCR方法测定NbPAP2的转录水平,结果显示,NbPAP2在各个组织中均有不同程度的表达,其在花瓣中表达量最高,显著高于其他生物组织.在叶片和茎中的表达量次之,在根和果实中表达量最低.除此之外,NbPAP2在成熟叶和成熟果中的表达量略高于幼叶和幼果 (图1E).
3.2 NbPAP2过表达促进植物生长和种子发育
为了探究过表达NbPAP2对烟草生长发育的影响,通过农杆菌介导的转化方法获得4个表达稳定且表达量相对较高的转基因株系(OE-1、OE-2、OE-3和OE-4),对4个株系的T1代卡那霉素抗性植株的表型进行观察及统计.观察发现,转基因植株生长速度较野生型明显加快,株型更加高大,并且这些改变与NbPAP2的表达水平呈正相关性(图3A、B).过表达NbPAP2还导致转基因植株花期提前(表2).在过表达株系OE-1和OE-2中NbPAP2的表达水平比野生型均高了10倍以上,花期比野生型植株提前了9~14 d.OE-3与OE-4株系中NbPAP2的表达水平分别是野生型的4到7倍,其花期改变就没有前两个株系显著,与对照相比,差异仅为2~3 d.
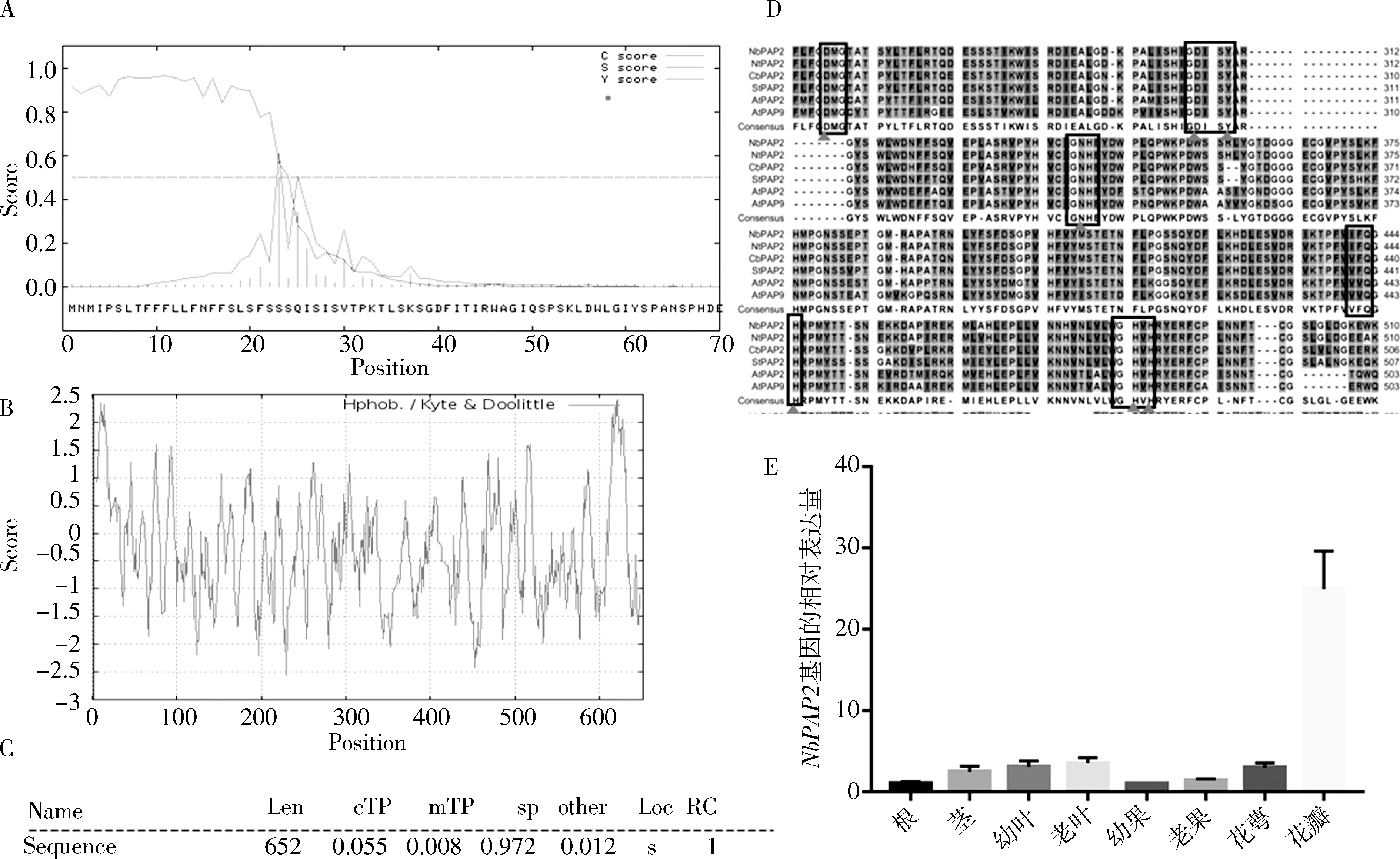
图2 NbPAP2的生物信息学分析和表达时空性分析Fig.2 Bioinformatics analysis and spatiotemporal expression profile of NbPAP2A.信号肽预测;B. 疏水性分析;C. 亚细胞定位预测;D. 氨基酸序列比对(矩形所标注的为5个氨基酸保守基序;三角所标注的为7个不变氨基酸残基);E. 组织表达特异性的定量PCR分析.A. Signal peptide prediction; B. hydrophobicity analysis; C. subcellular localization prediction; D. amino acid sequence alignment (5 amino acid conserved motifs marked by rectangle; 7 invariant amino acid residues marked by triangle); e. quantitative PCR analysis of tissue expression specificity.

图3 转基因烟草植株的表型Fig. 3 Phenotype of transgenic tobacco plantsA. 野生型(WT)和过表达(OE-1、OE-2)植株;B.NtPAP2在野生型(WT)和过表达(OE-1、OE-2、OE-3、OE-4)植株中的相对转录水平;C. 野生型(WT)和过表达(OE-1、OE-2、OE-3、OE-4)植株的种子;D. 野生型(WT)和过表达(OE-1、OE-2、OE-3、OE-4)植株种子的质量.A. Wild type (WT) and NbPAP2 over expression (OE-1,OE-2) plants; B. relative transcription level of NbPAP2in WT and over expression (OE-1,OE-2,OE-3,OE-4) plants; C. seeds of WT and over expression (OE-1,OE-2,OE-3,OE-4) plants; D. seed quality of WT and over expression (OE-1,OE-2,OE-3,OE-4) plants.

表2 野生型植株与转基因植株的开花时间Tab.2 Flowering time of wild type plants and transgenicplants
不仅如此,我们还观察到,与野生型植株相比,OE-1、OE-2两个过表达株系的种子更为饱满,种子的宽度和长度都有所增加,但其他两个过表达株系种子变化不明显(图3C).进一步测定各株系种子的百粒重(图3D),OE-1、OE-2两个过表达株系的种子质量显著高于野生型种子,提高了约23%~25%(图2D).尽管如此,野生型植株和转基因株系每个果实中的种子数量没有明显变化.
3.3 NbPAP2过表达影响植物光合作用和碳代谢
选取完全展开的成熟叶片测定光合速率和气孔导度发现.与野生型相比,OE-1和OE-2株系净光合速率分别增强了26%和20%.其他两个株系OE-3和OE-4,虽然净光合速率改变的幅度较小,但其净光合速率相较于野生型也增强了5%左右(图4A).在光合植物的叶片中,气孔导度与叶肉细胞对CO2的需求相一致[13],气孔导度越大,植物的净光合速率就越大.测定结果显示,转基因株系OE-1和OE-2的气孔导度增加了33%和28%,OE-3和OE-4也有明显增加(图4B).与野生型植株相比,过表达NbPAP2烟草的气孔导度与光合速率的变化具有一致性,同时也与基因表达水平有明显的相关性.
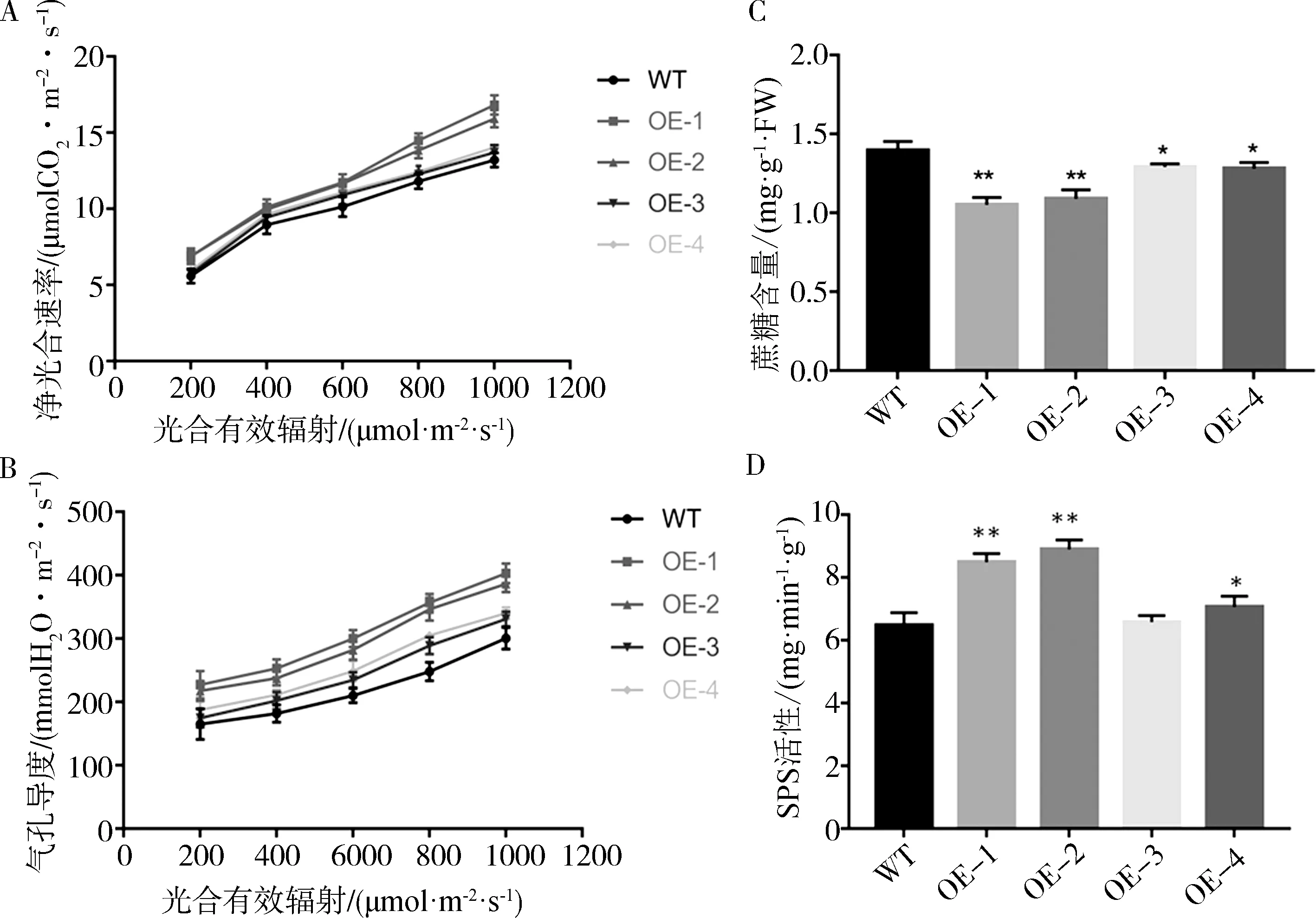
图4 过表达NbPAP2影响转基因植物的光合作用和碳代谢Fig.4 Overexpression of NbPAP2 affects photosynthesis and carbon metabolism in transgenic plantsA.野生型植株与转基因植株的净光合速率;B.野生型植株与转基因植株的气孔导度;C.野生型植株与转基因植株叶片的蔗糖含量;D.野生型植株与转基因植株叶片SPS活性.A. Net photosynthetic rate of wild type plants and transgenic plants; B.stomatal conductance of wild type plants and transgenic plants; C. sucrose content of wild type plants and transgenic plants; D. SPS activity of wild type plants and transgenic plants.
糖和糖原代谢信号影响植物的源库平衡和碳分配,也影响光合基因的转录[14].分析显示所有过表达NbPAP2株系的蔗糖含量均低于野生型烟草的蔗糖含量.OE-1和OE-2过表达NbPAP2株系的差异更为显著,蔗糖含量分别降低了25%和17%(图4C).蔗糖磷酸合成酶(SPS)是蔗糖合成途径中的关键酶之一,它不可逆地催化F6P和UDPG合成S6P,从而促进蔗糖的合成.为了了解导致转基因植株蔗糖水平下降的原因,我们进一步测定了转基因植株和野生型植株叶片中的SPS活性.出乎意料的是,与野生型相比,过表达植株的SPS活性均有不同程度的增强,而且OE-1与OE-2株系与野生型的差异较其他两个株系更为显著,其SPS酶活性分别增强了30%和33%(图4D).
4 讨 论
功能多样的紫色磷酸酶广泛分布在各种生物中.与拟南芥AtPAP2相比,本氏烟NbPAP2基因的表达产物的结构特征、组织表达特异性和过表达植株的表型,既有相似之处,但也有不一样的地方.
在结构方面,虽然NbPAP2与AtPAP2的氨基酸序列同源性为64.2%,但预测的结构特征与AtPAP2极为相似,如N端的信号肽、C端的强疏水性基序和叶绿体靶向.当然,研究显示AtPAP2实际上是叶绿体和线粒体双定位[15],NbPAP2是否同样靶向线粒体则还有待进一步证实.
在组织表达特异性方面,虽然NbPAP2在各组织中都被检测到表达,成熟组织中的表达略高于幼嫩组织,但表达丰度最高的组织却是花瓣,这与AtPAP2的表达模式存在差异.同时,考虑到通常情况下花瓣并非植物进行光合作用的器官,因此这暗示NbPAP2可能还有促进光合作用之外的其它功能.Guo等人的研究显示,充足的糖分对花色素的合成有促进作用[16-17],因此NbPAP2很可能在本氏烟花色的形成中发挥着重要的作用.
在过表达转基因植株表型方面,过表达AtPAP2和NbPAP2均促进花期提前,同时种产量增加.不过值得注意的是,前者产量的增加是种子数量和质量共同增加的结果,但过表达NbPAP2并没有增加转基因植株的种子数量,产量增加仅仅是由于种子质量增加所致.同样,过表达NbPAP2虽然促进了转基因植株的光合作用以及蔗糖合成关键酶基因的表达,但叶片中蔗糖的含量反而降低,并且降低的程度与基因表达的水平呈负相关关系.类似的结果在亚麻芥中有相关报道[18].一般来说,叶片中蔗糖的含量是由SPS控制下的蔗糖合成速率、叶片输出速率和光合作用速率共同决定的[19-20].较高的光合速率和SPS数量及活性导致蔗糖的增加,高效的蔗糖输出速率则会降低蔗糖的水平.因此在过表达AtPAP2的亚麻芥和过表达NbPAP2的本氏烟中,叶蔗糖含量降低可能是蔗糖高效运输大于光合速率及蔗糖合成速率的结果.蔗糖含量的降低可以减轻高浓度蔗糖对光合作用和SPS活性的反馈抑制,进一步促进碳固定,并进而导致转基因植株生长速率提升、早花及种子产量提高.
还需要指出的是,过表达PAP2类的基因都促进了转基因植物种子体积和质量的增加,这对于以种子为目标产品的植物无疑是有益的.但是对于茄科的番茄、辣椒、茄子、枸杞等这些以整个果实而非种子为产品的植物,在应用该策略时需要考虑到种子过大对食物口感的影响.

