牛乳、羊乳和人乳中的蛋白质组成及消化特性研究
杨博睿,张富新,邵玉宇,蔡俊娜,刘坤钰
(陕西师范大学食品工程与营养科学学院,西安710119)
0 引 言
乳中富含蛋白质、脂肪、乳糖、矿物质、维生素和多种生物活性成分,是人体摄取营养物质的主要来源[1]。目前人们可利用的乳类已有10 多种[2],其中牛乳由于营养全面、产量大,已成为人们消费的主要乳类,约占乳类消费的85%[3]。随着人们对乳类需求的多元化及营养保健意识的提高,一些特种乳及乳制品越来越受到人们的关注,羊乳作为仅次于牛乳的第二大乳类,其独特的营养保健功能已被人们认识[4]。此外,人乳作为营养及功能最完美的乳类,其复杂的化学组成及独特的营养功能,已在人类营养界受到高度关注[5]。乳蛋白质是人们从乳中摄取的最主要的营养素,主要由酪蛋白和乳清蛋白组成,但其组成及含量在不同来源乳类之间有较大差别[6]。目前国内外对牛乳和人乳中蛋白质组成及消化利用研究较多[7-8],在羊乳的消化特性方面也有一些报道[9],但在系统比较牛乳、羊乳和人乳蛋白质组成及消化特性方面报道极少。因此本文在分析牛乳、羊乳和人乳中蛋白质组成的基础上,利用体外模拟胃肠消化,研究牛乳、羊乳和人乳的消化特性,为进一步开发牛乳、羊乳提供基础。
1 材料与方法
1.1 试验材料
羊乳采自西北农林科技大学试验农场350 只西农萨能奶山羊混合奶样;牛乳采自西安银桥乳业集团农场的300 头黑白花奶牛混合奶样;人乳采自西安市3名健康母亲3 个月内的乳汁,采样后混合均匀;乳样采集后在-40 °C 下贮存。
1.2 试剂
胃蛋白酶(活性 3 000~3 500 u),美国 Sigma 公司;胰酶(活性1 750 u),美国Sigma 公司;猪胆盐,北京奥博星生物技术有限责任公司;SDS-PAGE 凝胶制备试剂盒,Solarbio 公司;SDS-PAGE 蛋白上样缓冲液(4 X)、蛋白质分子量标准(14.4~116 ku),碧云天生物技术有限公司;三氯乙酸,上海山浦化工有限公司;溴甲酚绿指示剂、甲基红指示剂,天津市科密欧化学试剂有限公司;盐酸、浓硫酸、氢氧化钠,洛阳昊华化学试剂有限公司;乙醇、甲醇、冰乙酸,天津市富宇精细化工有限公司;氯化钠、无水氯化钙、硼酸、五水硫酸铜,天津市天力化学试剂有限公司。
1.3 仪器设备
Kjeltec 全自动凯式定氮仪,瑞典福斯(Foss)公司;BSA22025 型电子分析天平,赛多利斯科学仪器(北京)有限公司;FM 恒温水浴锅,上海福玛实验设备有限公司;VORTEX-5 旋涡混合器,海门市其林贝尔仪器制造有限公司;PHS-3C 型精密pH 计,上海精密科学仪器有限公司;TGL-16B 型高速离心机,上海安亭科学仪器厂;Power PacTM 基础电泳仪电源和Mini-Protean Tetra Cell 电泳槽,上海创萌生物科技有限公司;THZ-300/300C 型恒温培养摇床,上海一恒科学仪器有限公司;ChemiDoc-it System 510 Imager化学发光成像仪,美国UVP 公司;DN-12 氮吹仪,上海比朗仪器有限公司。
1.4 乳蛋白质的分离及测定
乳蛋白质的分离参照GB/T 21704-2008[10]的方法。取100 mL 冷冻乳样在室温下自然解冻,然后在3 000 g 下离心 15 min 脱脂,得到脱脂乳。取 10 mL 脱脂乳用1 mol/L HCI 调整 pH 至等电点(牛乳4.6[11],羊乳4.2[12],人乳4.6[13]),室温下静置30 min后,在10 000 g下离心20 min,重复两次,得到沉淀部分为酪蛋白部分,上清液为非酪蛋白部分。取10 mL 非酪蛋白部分,加入15%三氯乙酸(质量浓度),使三氯乙酸最终浓度为12%,在3 500 g 下离心20 min,沉淀为乳清蛋白部分,上清液为非蛋白氮部分。样品总氮、非蛋白氮、非酪蛋白氮分别用自动凯式定氮仪测定[14]。按下面公式计算:
总蛋白=(总氮-非蛋白氮)×6.38
酪蛋白=(总氮-非蛋白氮)×6.38
乳清蛋白=(非酪蛋白氮-非蛋白氮)×6.38
1.5 体外模拟消化
乳样在室温下自然解冻后在3 500 g 下离心脱脂。取脱脂乳进行体外模拟胃液消化、肠液消化、胃肠液消化。
体外模拟胃液消化参照Pan[15]和Alison[16]方法。取 10 mL 脱脂乳于 37 °C 下预热 5 min,添加 10 mL 人工胃液(2 g NaCI 和7 mL 2 mol/L HCI 配制成1 L),用2 mol/L HCI 将乳样的pH 调整为2.0,添加0.03 g胃蛋白酶混合均匀后于37 °C 恒温水浴中消化30 min、60 min、120 min,然后用1 mol/L NaOH 调整液消化pH 至7.0 终止反应,取消化液进行SDS-PAGE凝胶电泳。
体外模拟肠液消化参照Miriam[17]和Hyeong[18]方法。取10 mL脱脂乳于37 °C下预热5 min,添加0.1 mL人工肠液(68.3 mL NaHCO3(84.7 g/L)、10 mL CaCl2·2H2O(22.2 g/L)和30 g胆盐配制成500 mL),用1 mol/L NaOH 将乳样的 pH 调整为 7.0,添加 0.005 g 胰酶(活性1750 U/mg)混合均匀后于37°C 恒温水浴中分别消化 2 min、10 min、30 min,取消化液进行 SDS-PAGE凝胶电泳。
体外模拟胃肠液消化参照体Alison[16]和Miriam[17]方法。取 10 mL 脱脂乳于 37 °C 下预热 5 min,添加10 mL 人工胃液(2 g NaCI 和 7 mL2 mol/L HCI 配制成1 L),用2 mol/L HCI 将乳样的pH 调整为2.0,添加0.03 g 胃蛋白酶混合均匀后于37 °C 恒温水浴中消化30 min,然后取出乳样添加0.1 mL 人工肠液[68.3 mL NaHCO3(84.7 g/L)、10 mL CaCl2·2H2O(22.2 g/L)和30 g 胆盐配制成 500 mL],用 1mol/L NaOH 将乳样的pH 调整为7.0,添加0.005 g 胰酶(1750 U/mg)混合均匀后于37 °C恒温水浴中分别消化2 min、10 min、30 min,在沸水浴中煮沸5 min 终止反应,取消化液进行SDS-PAGE凝胶电泳。
1.6 SDS-PAGE凝胶电泳
参照Neuhoff[19]的方法。将13.5%的分离胶(2.25 mL 30%丙烯酰胺、1.25 mL pH 8.8 三(羟甲基)氨基甲烷(tris-HCl)、50 μL 10%十二烷基硫酸钠(SDS)、50 μL 10%-过硫酸铵(APS)、5 μL 四甲基乙二胺(TEMED)和1.4 mL超纯水)注入凝胶板中凝胶40 min,再将3.75%浓缩胶(0.313 mL 30%丙烯酰胺、0.313 mL pH 6.8 tris-HCl、25 μL 10% SDS、37.5 μL 10% APS、3.75 μL TEMED和1.813 mL 超纯水)注入凝胶板凝胶40 min,完成制胶阶段。在电泳槽内加入电极缓冲液(3.03 g tris、18.7 g 甘氨酸、1 g SDS 定容至 1 L)。将牛乳和羊乳样品用超纯水稀释10 倍,人乳样品用超纯水稀释5 倍,取 30 μL 乳样稀释液加入 10 μL 蛋白上样缓冲液(上样缓冲液∶乳样稀释液=1∶3),在沸水浴中加热5 min 使蛋白质变性。取7 μL 处理后的样品上样,开始电泳电压为75 V,当样品进入分离胶后将电压调至200 V,电泳40 min。将凝胶从凝胶板上取下,在水平摇床中用染色液(1 g 考马斯亮蓝 R-250、450 mL 甲醇、100 mL 冰乙酸定容至1 L)染色2 h。然后用脱色液(甲醇∶冰乙酸∶超纯水的比例为1∶1∶8)摇床脱色至蛋白条带清晰为止,最后用Chemi Doc-It 化学成像系统扫描进行灰度分析。
1.7 乳蛋白残留率和消化率
用化学发光成像仪对SDS-PAGE电泳条带的灰度值进行测定,然后按下列公式计算蛋白质的残留率[16]和消化率[20]:

1.8 数据处理
采用Origin9.1 对试验数据进行整理和图表编辑;采用DPS 9.50 统计分析软件对试验数据进行显著性分析。
2 结果与分析
2.1 牛乳、羊乳和人乳中含氮物质和蛋白质组成
2.1.1 牛乳、羊乳和人乳中含氮物质
牛乳、羊乳和人乳中含氮物质主要由酪蛋白氮(Casein Protein Nitrogen,CPN)、乳清蛋白氮(Whey Protein Nitrogen,WPN)和非蛋白氮(Non-Protein Nitrogen,NPN)组成,其含量见表1。
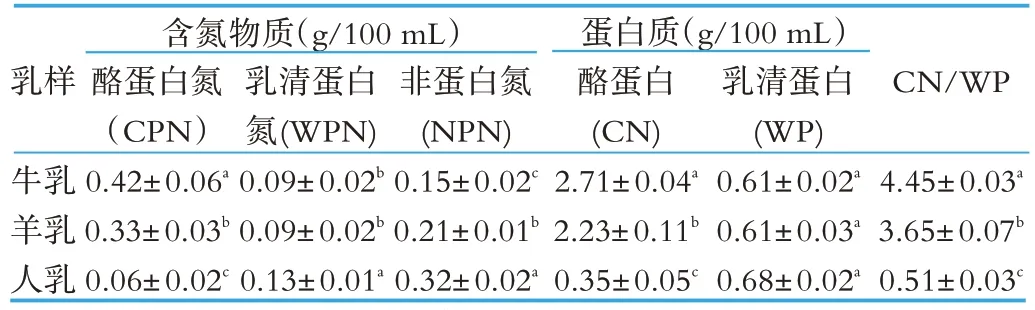
表1 牛乳、羊乳和人乳的含氮物质组成
由表1 可以看出,牛乳、羊乳和人乳中酪蛋白氮有显著差别(P<0.05),牛乳中酪蛋白氮含量最高,而人乳中含量最低;牛乳与羊乳中乳清蛋白氮无显著性差异(P>0.05),而人乳中含有较高的乳清蛋白氮;牛乳、羊乳和人乳中非蛋白氮也有较大差别,牛乳中非蛋白氮含量最低,而人乳中非蛋白氮含量最高。同时,从牛乳、羊乳和人乳中酪蛋白和乳清蛋白含量也可以看出,牛乳中酪蛋白含量最高,人乳中酪蛋白含量最低,牛乳、羊乳和人乳中酪蛋白与乳清蛋白的比值分别为4.45,3.65 和0.51,这表明牛乳中蛋白质主要由酪蛋白组成,人乳中蛋白质主要由乳清蛋白组成,羊乳中酪蛋白与乳清蛋白之比更接近于人乳。
2.1.2 牛乳、羊乳和人乳中蛋白质组成
乳中的蛋白质主要由酪蛋白和乳清蛋白组成。酪蛋白主要由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白4 种酪蛋白组成,乳清蛋白主要由α-乳白蛋白和β-乳球蛋白组成。

图1 牛乳、羊乳和人乳的蛋白质电泳图
由图1 可见,牛乳、羊乳和人乳中蛋白质在SDS-PAGE 电泳中条带分离清晰,牛乳和羊乳中酪蛋白可清晰观察到αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白4 种酪蛋白条带,而人乳中仅可观察到β-酪蛋白和κ-酪蛋白条带,没有发现αs1-酪蛋白和αs2-酪蛋白条带,这与Maria 的报道一致[21]。同时,牛乳和羊乳中还可以观察到α-乳白蛋白和β-乳球蛋白2 种乳清蛋白条带,而在人乳中仅含有α-乳白蛋白条带,无β-乳球蛋白条带。除了4 种酪蛋白和2 种乳清蛋白外,电泳中还可观察到乳铁蛋白、血清白蛋白及免疫球蛋白条带,尤其是人乳中含有较高的乳铁蛋白和血清白蛋白。通过对SDS-PAGE 凝胶电泳条带灰度分析(见表2),发现牛乳、羊乳和人乳中4 种酪蛋白和2 种乳清蛋白含量有明显差别,在酪蛋白组成方面,牛乳中αs1-酪蛋白含量显著高于羊乳(P<0.05),而羊乳中αs2-酪蛋白含量高于牛乳(P<0.05),人乳中β-酪蛋白含量最高,显著高于牛乳和羊乳(P<0.05),同时人乳中的κ-酪蛋白也显著高于牛乳和羊乳(P<0.05)。这表明牛乳中酪蛋白主要由αs1-酪蛋白和β-酪蛋白组成,羊乳中酪蛋白主要由αs2-酪蛋白和β-酪蛋白组成,而人乳中酪蛋白主要由β-酪蛋白和κ-酪蛋白组成。从乳清蛋白组成看,人乳中α-乳白蛋白含量显著高于牛乳和羊乳(P<0.05),牛乳中β-乳球蛋白含量显著高于羊乳和人乳(P<0.05),表明牛乳中乳清蛋白主要由β-乳球蛋白组成,人乳中乳清蛋白主要由α-乳白蛋白组成,而羊乳中β-乳球蛋白含量低于牛乳。大量研究表明,乳中的αs1-酪蛋白和β-乳球蛋白是引起蛋白质过敏反应的来源[22],人乳中几乎不含αs1-酪蛋白和β-乳球蛋白,与牛乳相比,羊乳中含有较低的αs1-酪蛋白和β-乳球蛋白,这也是羊乳不易引起蛋白质过敏的主要原因。

表2 牛乳、羊乳和人乳的蛋白质组成
2.2 牛乳、羊乳和人乳中蛋白质的消化特性
2.2.1 牛乳、羊乳和人乳中蛋白质的胃液消化
牛乳、羊乳和人乳中的蛋白质在胃液中消化电泳图见图2。由图2 可见,牛乳、羊乳和人乳在整个胃液消化期间,酪蛋白(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)条带逐渐变暗,尤其在胃液消化120 min 时,牛乳酪蛋白条带逐渐消失,羊乳仅有少量的酪蛋白条带,人乳在消化60 min 时,酪蛋白条带也逐渐消失。由于降解产物的形成,使乳清蛋白(α-乳白蛋白和β-乳球蛋白)条带亮度有逐渐增加的趋势。通过对电泳条带灰度扫描发现,牛乳、羊乳和人乳中的蛋白质在整个胃液消化期间,随着消化时间的延长,高分子量蛋白(MW>40)和酪蛋白的残留率逐渐减少,而低分子量蛋白(MW<20)的残留率逐渐增大(见表3),表明随着胃液消化时间的延长,蛋白质的消化率逐渐提高。通过对牛乳、羊乳和人乳比较发现,在消化120 min 时牛乳高分子量蛋白(MW>40)残留率最低,羊乳和人乳无显著性差异(P>0.05),表明牛乳中高分子量蛋白(MW>40)比羊乳和人乳更易消化。从酪蛋白残留率看,整个消化期间,牛乳中酪蛋白残留率最高(P<0.05),人乳中酪蛋白残留率最低(P<0.05),表明人乳中酪蛋白在胃液中最易消化,羊乳中酪蛋白比牛乳中酪蛋白更易消化。从牛乳、羊乳和人乳中酪蛋白组分消化可以看出(见表4),牛乳和羊乳中αs1-酪蛋白在胃液消化120 min 时消化率无显著差别(P>0.05),而αs2-酪蛋白在整个消化期间牛乳消化率显著高于羊乳(P<0.05),β-酪蛋白和κ-酪蛋白在整个消化期间人乳显著高于牛乳和羊乳(P<0.05),而羊乳高于牛乳(P<0.05),这表明人乳中仅有的β-酪蛋白和κ-酪蛋白在胃液消化中最易消化,与牛乳相比,羊乳中酪蛋白在胃液消化中更易消化。

图2 牛乳、羊乳和人乳中的蛋白质模拟胃消化电泳图
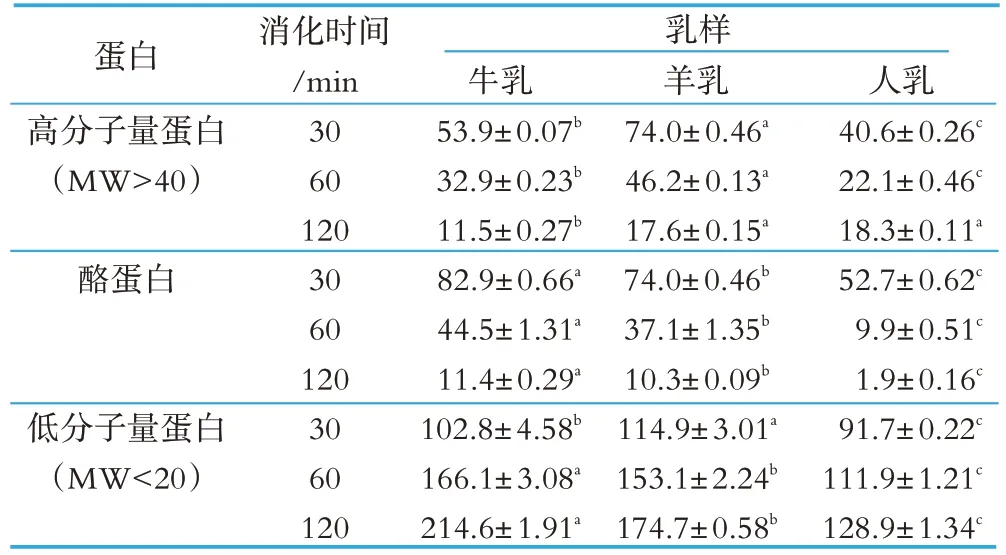
表3 牛乳、羊乳和人乳在胃液消化中蛋白质的残留率 %

表4 牛乳、羊乳和人乳在胃液消化中酪蛋白的消化率 %
2.2.2 牛乳、羊乳和人乳中蛋白质的的肠液消化
牛乳、羊乳和人乳中的蛋白质在肠液中消化电泳图见图3。由图3 可见,牛乳、羊乳和人乳在整个肠液消化期间,酪蛋白(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白)条带逐渐变暗,人乳在消化2 min 时,酪蛋白条带也逐渐消失,牛乳和羊乳在肠液消化10 min时,酪蛋白条带也逐渐消失,表明人乳酪蛋白在肠液中比牛羊乳更易消化。通过对电泳条带灰度扫描发现,牛乳、羊乳和人乳中的蛋白质在整个肠液消化期间,随着消化时间的延长,高分子量蛋白(MW>40)和酪蛋白的残留率逐渐减少,而低分子量蛋白(MW<20)的残留率有逐渐增加的趋势(见表5),这表明随着肠液消化时间的延长,蛋白质的消化率逐渐提高。通过对牛乳、羊乳和人乳比较发现,在肠液消化30 min时牛乳高分子量蛋白(MW>40)残留率最低,羊乳和人乳无显著性差异(P>0.05),表明牛乳中高分子量蛋白(MW>40)比羊乳和人乳更易消化。从酪蛋白残留率看,整个消化期间,牛乳中酪蛋白残留率最高(P<0.05),人乳中酪蛋白残留率高于羊乳(P<0.05),表明人乳中酪蛋白在肠液中最易消化,羊乳中酪蛋白比牛乳中酪蛋白更易消化。从低分子量蛋白(MW<20)残留率来看,牛乳、羊乳和人乳的低分子量蛋白(MW<20)残留率随着消化时间的延长出现了先增高后降低的趋势,这表明高分子量蛋白和酪蛋白基本消化完全后,低分子量蛋白也逐渐被消化。除此之外,与胃液消化相比,牛乳、羊乳和人乳在肠液中消化10 min 时,90%以上的酪蛋白已消化,消化30 min时,酪蛋白几乎完全消化,表明乳蛋白主要在小肠内消化吸收,这与Alison[16]、Jasinska[23]等的报道基本一致。
2.2.3 牛乳、羊乳、人乳中蛋白质的胃肠液消化

图3 牛乳、羊乳和人乳中的蛋白质模拟肠消化电泳图

表5 牛乳、羊乳和人乳在肠液消化中蛋白质的残留率 %
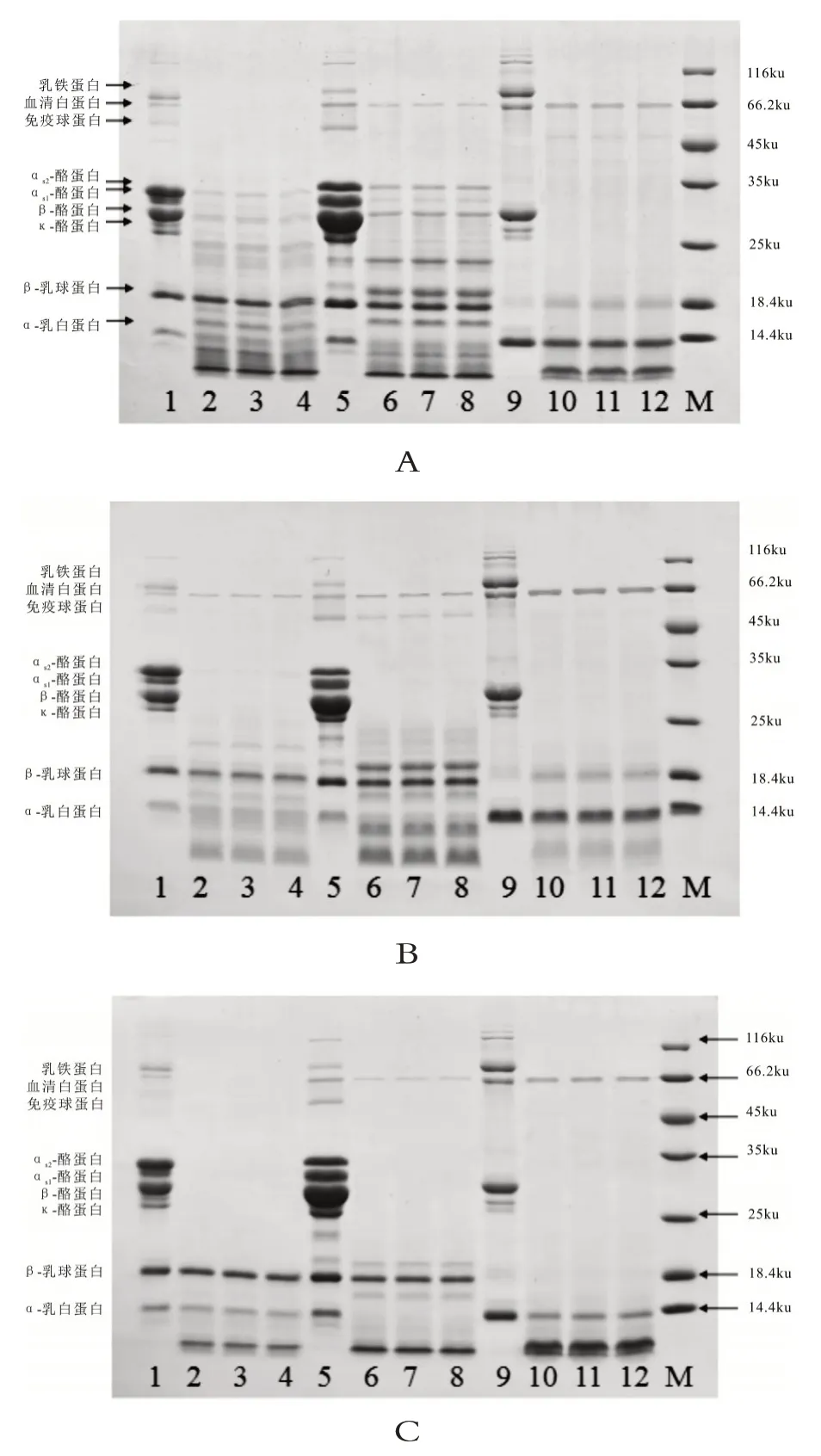
图4 牛乳、羊乳和人乳中的蛋白质模拟胃肠消化电泳图
牛乳、羊乳和人乳中的蛋白质在胃肠液中消化电泳图见图4。由图4可见,牛乳、羊乳和人乳在整个胃肠液消化期间,酪蛋白条带逐渐变暗,尤其在消化10 min时,牛乳和羊乳酪蛋白条带逐渐消失,人乳在消化2 min 时,酪蛋白条带也逐渐消失。随着降解产物的形成和消化时间的延长,乳清蛋白条带亮度也逐渐减少。通过对电泳条带灰度扫描发现,牛乳、羊乳和人乳中的蛋白质在整个消化期间,随着消化时间的延长,高分子量蛋白(MW>40)、酪蛋白和低分子量蛋白(MW<20)的残留率逐渐减少(见表6),表明随着胃肠液消化时间的延长,蛋白质的消化率逐渐提高。通过对牛乳、羊乳和人乳比较发现,在消化30 min 时牛乳高分子量蛋白(MW>40)残留率最低,羊乳和人乳无显著性差异(P>0.05),表明牛乳中高分子量蛋白(MW>40)比羊乳和人乳更易消化。从酪蛋白残留率看,整个消化期间,牛乳中酪蛋白残留率最高(P<0.05),人乳中酪蛋白残留率最低(P<0.05),表明人乳中酪蛋白在胃肠液中最易消化,羊乳中酪蛋白比牛乳中酪蛋白更易消化。
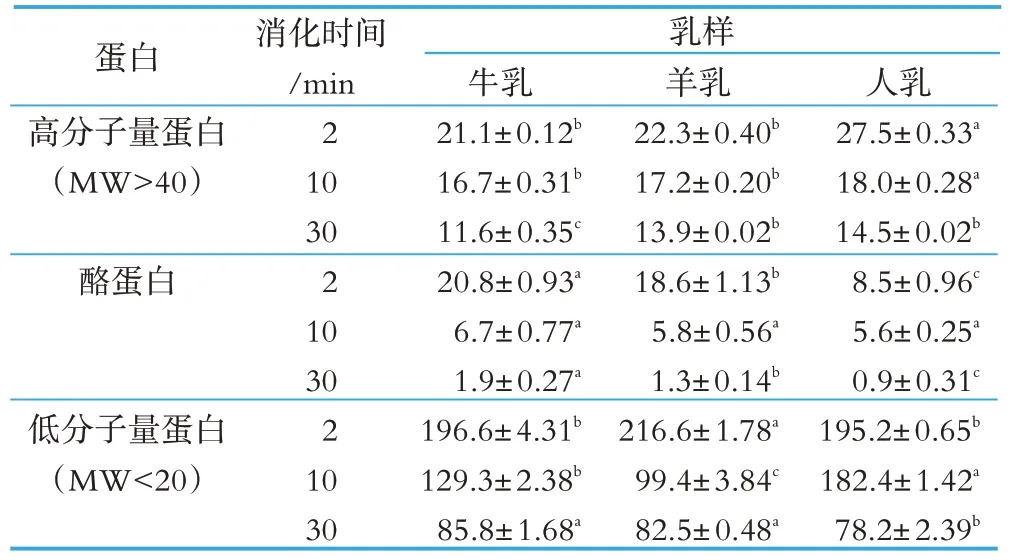
表6 牛乳、羊乳和人乳在胃肠液消化中蛋白质的残留率 %
3 结 论
通过对牛乳、羊乳和人乳中的蛋白质组成及消化特性研究发现,牛乳、羊乳和人乳中的蛋白质有较大差别,牛乳中酪蛋白质主要由αs1-酪蛋白和β-酪蛋白组成,羊乳中酪蛋白主要由αs2-酪蛋白和β-酪蛋白组成,人乳中酪蛋白主要由β-酪蛋白组成。牛乳和羊乳中乳清蛋白主要是β-乳球蛋白,而人乳中乳清蛋白主要是α-乳白蛋白。模拟成人胃肠消化表明,乳蛋白主要在肠中消化,人乳中蛋白质在胃肠中最易消化,而羊乳比牛乳更易消化,这为进一步开发利用牛乳和羊乳提供基础。

