白藜芦醇抑制胃癌细胞株MKN45增殖的机制研究*
朱理辉,罗勇,邓萍萍,陈宏辉,陈汶,李国庆,王正根,张琍
(南华大学附属第二医院 1.消化内科,2.重症医学科,湖南 衡阳 421001)
胃癌是我国常见的消化道恶性肿瘤之一,大多数患者就诊时为中晚期,无手术治疗机会,目前中晚期胃癌的治疗主要采用以化疗为主的综合治疗[1]。白藜芦醇又称为芪三酚属天然多酚类化合物,是药食作物(如桑椹、虎杖、葡萄、花生等)的主要成分,具有很强的抗氧化活性[2],属于植物源性药物,具有毒副作用少和植物衍生成分广泛靶标的特点。其在抗肿瘤治疗中的作用已有许多研究,包括结肠癌、皮肤恶性黑色素瘤、子宫内膜癌等[3-5],但其对胃癌细胞增殖的影响及相关作用机制尚不清楚。本研究通过观察不同浓度白藜芦醇对胃癌细胞株MKN45 增殖及丝裂原活化蛋白激酶(MEK)/细胞外信号调节激酶(ERK)信号通路相关蛋白表达的影响,为临床治疗及新药研发提供参考。
1 材料与方法
1.1 材料与仪器
胃癌细胞株MKN45(中国科学科院上海细胞研究所),白藜芦醇和PD98059(美国Sigma Aldrich 公司),四甲基偶氮唑蓝(MTT)检测试剂盒(武汉博士德生物工程有限公司),胎牛血清及RPMI 1640 培养基(美国Hyclone 公司),二甲亚砜(DMSO)(中国医药集团有限公司),胰蛋白酶(美国Sigma Aldrich 公司),兔抗Ras 及Raf 一抗(美国Cell Signaling 公司),兔抗MEK 及ERK1/2 一抗(美国Santa Cruz 公司),二氧化碳CO2恒温培养箱(上海新苗医疗器械制造有限公司),超净工作台(江苏苏净集团有限公司),荧光显微镜(德国莱卡公司),低温高速离心机(美国贝克曼库尔特公司),凝胶成像仪(美国Bio Rad 公司)。
1.2 实验方法
1.2.1 细胞培养人胃癌MKN45 细胞为贴壁生长细胞,常规培养于含10%小牛血清、100 u/ml 青霉素的RPMI 1640 培养基,置于37℃、5% CO2培养箱内培养。每日光学显微镜下观察,细胞呈单层生长,铺满培养瓶时传代。传代时常规吸去培养液,PBS 洗2 ~3 遍,以0.25%胰酶消化适度,吸去胰酶,加适量培养液吹打成单细胞悬液,分瓶继续培养,取对数生长期细胞制成细胞悬液。
1.2.2 实验分组实验分为对照组(DMSO,100 μg/ml,100 μl)、MEK/ERK 信号通路抑制剂PD98059 组(20 mg/L,100 μl)(PD98059 组)、白藜芦醇低剂量组(100 μmol/L)、白藜芦醇高剂量组(400 μmol/L)。将228.2 mg 白藜芦醇加入10 ml DMSO 溶解,配置成浓度为100 mmol/L 的储存液,应用微孔滤膜滤过后将白藜芦醇母液-20℃避光保存备用。参考杨洪秋[6]的研究结果,进行预试验,最终设置白藜芦醇组的浓度为100 和400 μmol/L,临用前取白藜芦醇母液用细胞培养基稀释成100 和400 μmol/L 的终浓度,使DMSO的最终浓度低于0.2%。
1.2.3 MTT 法检测细胞增殖抑制率取对数生长期细胞用0.25%胰酶消化,制成单细胞悬液,吹打重悬细胞至浓度为5×104个/ml的细胞悬液,平行接种于96孔培养板中,待细胞接近70%融合时,将MKN45 按照1.2.2 分组方法随机分为4 组: 对照组、PD98059 组、白藜芦醇低剂量组、白藜芦醇高剂量组。于1、2 和4 h 轻轻弃去各组细胞培养孔内的培养液,加入20 μl的MTT 继续于37℃、5% CO2培养箱中培养。无菌PBS 冲洗后在各组细胞中加入150 μl DMSO,震荡处理。用酶标仪检测培养后细胞培养板各个培养孔光密度(OD)值,并计算抑制率。细胞的增殖抑制率=(对照组OD 值-实验组OD 值)/对照组OD 值×100%。IC50 计算方法(寇式法): IC50=lg-1 [Xm-I(P-0.5)],其中 Xm: 最大浓度对数值;I: 最大浓度/相邻浓度的对数值;P: 各组生长抑制率之和;0.5 为经验常数。每组重复6 次。
1.2.4 Western blotting 法 检 测Ras、Raf、MEK、ERK1/2 蛋白的表达4 组细胞相应处理4 h 后,PBS洗涤细胞,适量的裂解液冰上裂解30 min,收集细胞,4℃、14 000 r/min 离心15 min,收集上清液。BCA 试剂盒测定蛋白浓度,将蛋白样品与上样缓冲液充分混合,SDS-PAGE 电泳分离,4℃转膜过夜。取出PVDF膜进行小冲洗。用纯化水配置5%胎牛血清进行封闭(10 min)。在20℃的室温条件下将PVDF 膜分别与Ras、Raf、MEK、ERK1/2 第一抗体(稀释倍数为200)培养60 min,无菌PBS 冲洗(5 min/次,共冲洗3 次)后,与二抗(稀释倍数为500)共培养50 min。PBS 冲洗3 次后DAB 显色,拍照。每组重复6 次。
1.2.5 免疫细胞化学法检测MEK、ERK1/2 蛋白荧光强度的变化将在无菌盖玻片上生长良好并经相应处理后的MKN45 用无菌PBS 冲洗3 次并用冰丙酮(-20℃)固定。并将其在无菌净化工作台上吹干,用1.0%体积分数的Triton-100 增加各组细胞通透性。用5.0%胎牛血清白蛋白溶液封闭。分别用相应浓度的MEK、ERK1/2 第一抗体稀释液于20℃条件下处理细胞3 h,无菌PBS 漂洗3 次。将漂洗后的细胞载玻片与FITC 标记二抗避光37℃孵育2 h,无菌PBS 漂洗3 次后用荧光显微镜拍照(二抗孵育完毕至拍照时间控制在90 min)。每组重复6 次。
1.3 统计学方法
数据分析采用SPSS 21.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 白藜芦醇对MKN45 细胞增殖的抑制作用
各组在0、1、2 及4 h 时MKN45 细胞增殖抑制率的比较,采用重复测量设计的方差分析,结果: ①不同时间点MKN45 细胞的增殖抑制率有差异(F=449.928,P=0.000)。②组间MKN45 细胞的增殖抑制率有差异(F=242.550,P=0.000),与对照组比较,PD98059 组、白藜芦醇低剂量组、白藜芦醇高剂量组对MKN45 细胞的增殖抑制率升高(P<0.05),以白藜芦醇高剂量组最高。③各组MKN45 细胞的增殖抑制率的变化趋势有差异(F=258.470,P=0.000)。见表1。
2.2 白藜芦醇对癌细胞株MEK/ERK 信号通路中Ras、Raf、MEK 和ERK1/2 蛋白表达的影响
细胞处理4 h 后,各组细胞Ras、Raf、MEK 和ERK1/2 蛋白的相对表达量比较,差异有统计学意义(P<0.05)。PD98059 组、白藜芦醇低剂量组和白藜芦醇高剂量组均低于对照组,且白藜芦醇高剂量组低于低剂量组。见表2和图1。
同时,免疫细胞化学法检测结果显示,MEK 及ERK1/2 蛋白主要定位于细胞质,且PD98059 组、白藜芦醇低剂量组和白藜芦醇高剂量组细胞MEK 及ERK1/2 的荧光强度均减弱,见图2、3。
表1 白藜芦醇对MKN45 细胞株增殖的抑制作用 (n =6,±s)

表1 白藜芦醇对MKN45 细胞株增殖的抑制作用 (n =6,±s)
组别 0 h 1 h 2 h 4 h对照组 0.010±0.000 0.010±0.000 0.010±0.000 0.010±0.000 PD98059 组 0.053±0.010 0.193±0.078 0.290±0.033 0.398±0.104白藜芦醇低剂量组 0.042±0.019 0.123±0.025 0.188±0.026 0.262±0.035白藜芦醇高剂量组 0.035±0.019 0.255±0.054 0.425±0.040 0.540±0.047
表2 各组MKN45 细胞Ras、Raf、MEK 和ERK1/2 蛋白的相对灰度值 (n=6,±s)
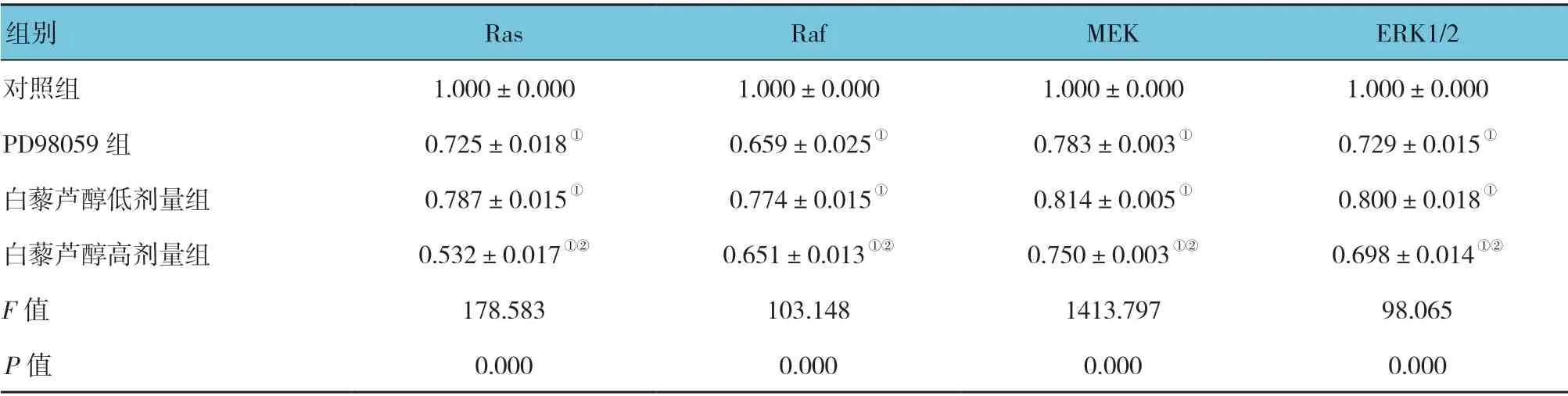
表2 各组MKN45 细胞Ras、Raf、MEK 和ERK1/2 蛋白的相对灰度值 (n=6,±s)
注: ①与对照组比较,P <0.05;②与白藜芦醇低剂量组比较,P <0.05。
组别 Ras Raf MEK ERK1/2对照组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 PD98059 组 0.725±0.018① 0.659±0.025① 0.783±0.003① 0.729±0.015①白藜芦醇低剂量组 0.787±0.015① 0.774±0.015① 0.814±0.005① 0.800±0.018①白藜芦醇高剂量组 0.532±0.017①② 0.651±0.013①② 0.750±0.003①② 0.698±0.014①②F 值 178.583 103.148 1413.797 98.065 P 值 0.000 0.000 0.000 0.000

图1 白藜芦醇对MKN45 细胞株Ras、Raf、MEK和ERK1/2 表达的影响

图2 白藜芦醇对MKN45 细胞株MEK 蛋白表达的影响(×400)
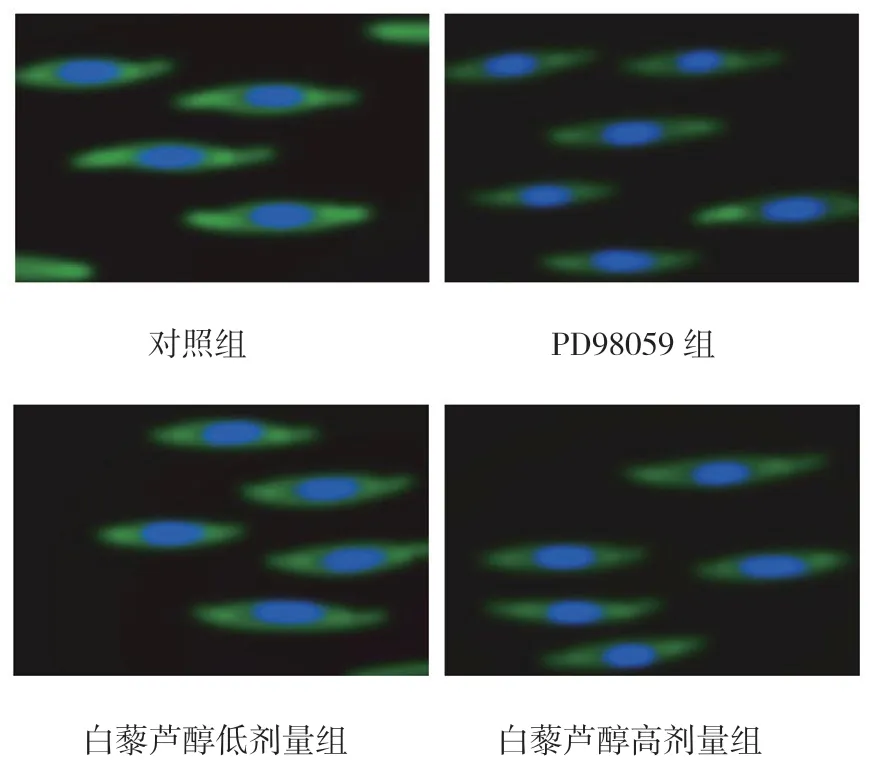
图3 白藜芦醇对MKN45 细胞株ERK1/2 蛋白表达的影响(×400)
3 讨论
白藜芦醇属于多酚类化合物,是恶性肿瘤的化学预防物质,对癌细胞有促凋亡、抗增殖作用,以及抑制动物肿瘤生长的能力。已有研究发现,白藜芦醇可能通过抑制COX-2 的表达和活性诱导细胞凋亡[7]、阻断TNF-α/TNF-β 受体诱导的NF-κB 活化抑制肿瘤细胞的增殖[8]、干扰葡萄糖发酵和促进呼吸来减缓肿瘤细胞的生长[9]、抑制类花生酸合成、阻滞细胞周期进展等多种途径发挥抗肿瘤作用[10]。白藜芦醇抗肿瘤的另一个作用可能是与化疗药物的相互作用,降低顺铂肾毒性[11]。本研究显示,MKN45 细胞在经PD98059、100 μmol/L 白藜芦醇和400 μmol/L 白藜芦醇处理后,与对照组比较,表现出不同程度的抑制作用,且随着时间的延长和剂量增加,细胞增殖抑制率升高,呈时间剂量依赖性,PD98059 阻断MEK/ERK 信号通路同样可抑制胃癌细胞增殖,提示白藜芦醇对MKN45 增殖的抑制作用,可能与阻断MEK/ERK 信号通路有关。
MEK/ERK 信号转导通路是细胞外信号刺激向细胞内转导进而诱发细胞发生生理或病理过程的主要途径,其参与调控细胞的增殖、分化、凋亡、转移及癌变等多种生理或病理学过程[12-13],且已有证据显示其与恶性肿瘤的发生、发展有相关性[14]。白藜芦醇可以通过下调ERK1/2 和糖原合成酶激酶-3 信号级联作用抑制钒酸钠(Na3VO4)诱导的神经来源外泌体表达蛋白p-S396-tau 的表达水平,白藜芦醇减少长期暴露于Na3VO4或FeCl2后细胞外活性氧产生和海马毒性的增加,而此过程与其影响ERK 信号转导通路有关[15]。提示MEK/ERK 信号通路可能是药物干预治疗的潜在靶点。本研究发现,经白藜芦醇处理后胃癌细胞的MEK/ERK 信号通路蛋白Ras、Raf、MEK 和ERK1/2 表达水平降低,经PD98059 阻断MEK/ERK 信号通路后同样可使Ras、Raf、MEK 和ERK1/2 表达水平降低。CHEN 等[3]研究证实,白藜芦醇可能通过抑制MEK/ERK 信号通路来促进人结肠癌SW620 细胞凋亡。提示白藜芦醇可能是通过抑制MEK/ERK 信号通路中Ras、Raf、MEK 和ERK1/2 蛋白表达发挥抑制胃癌细胞增殖的作用。
本研究虽然检测了白藜芦醇抑制胃癌细胞株MKN45 的增殖效果,且发现MEK/ERK 信号通路蛋白参与其中。但尚未对MEK/ERK 信号通路中关键蛋白磷酸化形式的表达变化进行检测。下一步将对此进行研究,为更准确地阐明其相关抗肿瘤机制提供参考。

