IgG及IgM对活动期溃疡性结肠炎患者病情的预测价值
金圣博, 丁雪丽, 刘爱玲, 武 军, 胡晓飞, 赵显芝, 田字彬
青岛大学附属医院消化内科,山东 青岛 266003
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性肠道炎症性疾病,病变多自直肠开始,可逆行发展。该病反复复发、迁延不愈,严重影响患者的生活质量[1-2]。临床医师根据患者的症状、血清学指标及结肠镜等评估疾病的严重程度和病变范围,从而指导诊疗。其中,结肠镜为有创性检查,可能给患者带来一定的痛苦,因此部分患者拒绝结肠镜检查,使得疾病评估受限,耽误治疗。目前认为,UC的发病机制不明,其中遗传、免疫、环境等发挥一定的作用。免疫功能紊乱是UC的主要发病机制之一,在疾病的发生发展中发挥着重要作用,因此UC也被认为是免疫介导的肠道疾病。免疫球蛋白指具有抗体活性或化学结构,与抗体分子相似的球蛋白,参与体液免疫。免疫球蛋白分为五类,即免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。其主要通过Fc片段(Fc)与不同的Fc受体(FcR)结合激活抗炎活性[3-4]。有研究[5]发现,难治性炎症性肠病患者通过静脉免疫球蛋白(intravenous immunoglobulin,IVIG)治疗后达到临床症状缓解。既往的临床研究也发现低水平的免疫球蛋白往往预示着疾病可能进展至重度UC。Hawkins等[6]发现,急性暴发性UC存在低水平的血清IgG,而术后UC患者血清IgG水平的恢复可作为康复的评估指标之一,并认为IgG水平下降可能与严重腹泻导致IgG丢失有关;王征等[7]研究则发现,低水平的IgG(<7 g/L)UC患者重型比例明显升高,伴发巨细胞病毒感染及糖皮质激素抵抗的患者明显增多;王艳等[8-9]研究则发现,重症UC患者与轻症UC患者比较血清IgM水平明显下降。上述研究均提示低水平的免疫球蛋白有助于重度UC的诊断,但免疫球蛋白水平与UC的严重程度及肠道累及范围的关系尚未建立。本研究旨在探讨IgG及IgM水平与UC患者疾病严重程度及肠道病变范围的相关性及预测价值,为UC患者的临床评估提供参考。
1 资料与方法
1.1 研究对象纳入2012年1月至2019年4月青岛大学附属医院住院确诊的UC患者共135例,符合纳入标准,排除资料不完整的患者后共纳入106例。纳入标准:(1)诊断为活动期UC;(2)入院后在我院至少检测过一次IgG、IgM、C-反应蛋白(C-reactive protein,CRP)及血细胞沉降率(erythrocyte sedimentation rate,ESR)。诊断标准参考2018年中华医学会消化病学分会炎症性肠病学组制订的《炎症性肠病诊断与治疗的共识意见》[10]。排除标准:(1)原发性免疫缺陷疾病及继发于人类免疫缺陷病毒(HIV)感染所致免疫缺陷疾病的患者;(2)患有其他自身免疫性疾病,如类风湿性关节炎、系统性红斑狼疮等;(3)患有过敏性荨麻疹、哮喘等过敏性疾病;(4)妊娠、哺乳期等。本次研究经我院伦理委员会批准。
1.2 方法记录患者的姓名、年龄、性别等人口统计学资料并详细记录患者入院时的临床症状(腹痛、发热、大便次数、血便)、体征、既往史等,收集入院后首次的血常规、血凝、肝功、肾功、IgG、IgM、CRP、ESR、结肠镜检查及病理报告结果等临床数据;根据改良Truelove和Witts疾病严重程度分型标准将UC患者分为轻中度组及重度组;根据蒙特利尔分型分为左半结肠组(包括直肠型及左半结肠型)及广泛结肠组。
1.3 IgG及IgM检测采用西门子特殊蛋白BNII通过免疫散射比浊法应用随机配套的试剂检测IgG及IgM外周血水平,IgG及IgM界值参考我院检验科实验室建立的参考范围,即IgG:7~16 g/L、IgM:0.4~2.3 g/L。

2 结果
2.1 UC患者的临床资料106例UC患者中,男59例(53.8%),女47例(46.2%),年龄(49.67±15.13)岁(16~77岁)。轻中度组61例(57.5%),重度组45例(42.5%);左半结肠组38例(35.8%),其中6例为重度UC患者,广泛结肠组68例(64.2%),其中39例为重度UC患者;各亚组间性别、年龄、临床类型差异无统计学意义(P>0.05,见表1)。
2.2 各组IgG、IgM、CRP及ESR比较分析重度组患者的IgG与IgM水平明显低于轻中度组(P<0.001,P=0.036);广泛结肠组的IgG水平明显低于左半结肠组(P<0.001)。重度组患者CRP及ESR均明显高于轻中度组(P<0.001,P=0.037);广泛结肠组CRP高于左半结肠组,差异有统计学意义(P=0.003,见表2)。

表1 106例UC患者一般临床资料Tab 1 General clinical data of 106 UC patients

表2 UC患者各组间IgG、IgM、CRP及ESR结果Tab 2 Results of IgG, IgM, CRP and ESR among UC patients
2.3 IgG、IgM、CRP及ESR与疾病严重程度及病变范围的相关性在疾病严重程度方面,CRP及IgG水平与UC疾病严重程度分别呈高度及中度相关(r=0.540,P<0.001;r=-0.426,P<0.001),IgM及ESR均呈低度相关(r=-0.233,P=0.016;r=0.288,P=0.003)。在病变范围方面,IgG及CRP与UC病变范围呈中度相关(r=-0.384,P<0.001;r=0.314,P=0.002)(见表3)。
2.4 IgG、IgM、CRP及ESR对UC患者疾病严重程度及病变范围的预测价值ROC曲线分析结果显示,IgG(AUC=0.772,P<0.001)、IgM(AUC=0.636,P=0.003)、CRP(AUC=0.798,P<0.001)及ESR(AUC=0.664,P=0.011)对UC患者疾病严重程度均有预测价值,其中CRP的预测价值最高,IgG次之,IgG预测价值明显优于IgM(Z=2.098,P=0.035)。IgG(AUC=0.731,P<0.001)及CRP(AUC=0.655,P=0.024)对UC的病变范围有预测价值,IgG对于病变范围的预测价值优于CRP(见表4、图1~4)。

表3 UC患者各组间IgG、IgM、CRP及ESR与疾病 严重程度相关性分析Tab 3 Relationship between IgG, IgM, CRP, ERS with severity of disease among UC patients
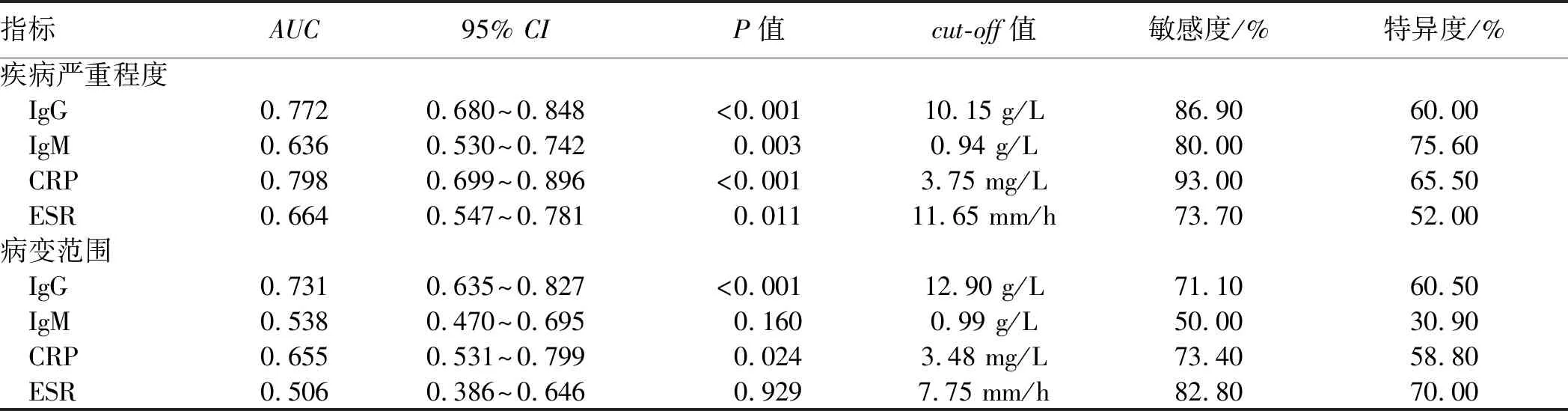
表4 IgG、IgM、CRP及ESR预测UC病情严重程度及病变范围的敏感度及特异度结果Tab 4 The sensitivity and specificity of IgG, IgM, CRP and ESR in predicting severity of disease and the extent of intestinal lesion
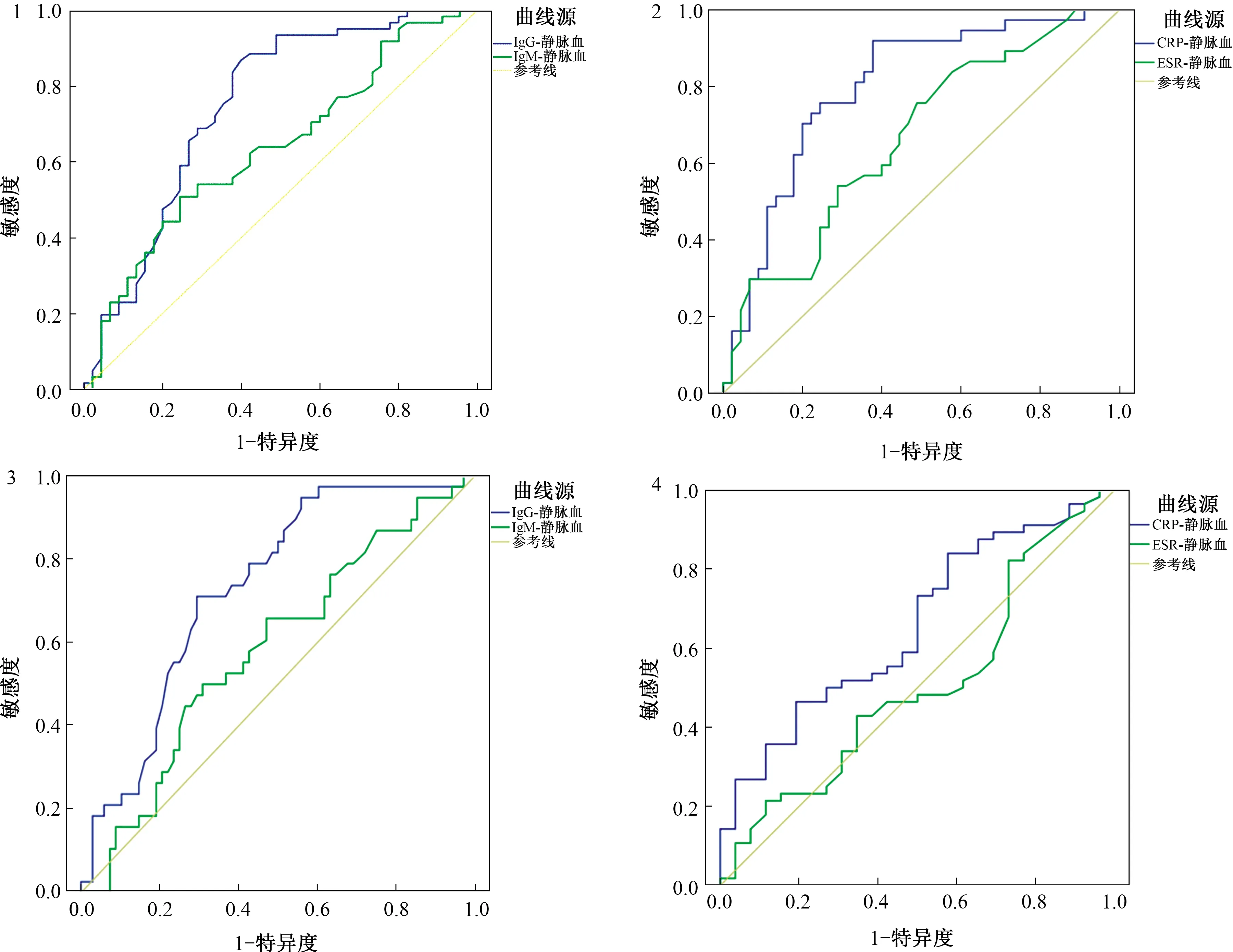
图1 IgG及IgM预测患者疾病严重程度的ROC曲线;图2 CRP及ESR预测患者疾病严重程度的ROC曲线;图3 IgG及IgM预测患者病变范围的ROC曲线;图4 CRP及ESR预测患者病变范围的ROC曲线
3 讨论
UC是一种慢性非特异性肠道炎症性疾病,其发病率逐年升高。该病具有反复发作的特点,多数患者在病程中出现疾病严重程度或病变范围的改变。病情评估的准确性与治疗策略及预后密切相关。因此,寻找简单、有效的临床指标对评估和预测UC患者病情的严重程度及病变范围、调整治疗方案、诱导疾病缓解尤为重要。
免疫因素是该病的重要发病机制之一,主要分为固有免疫细胞和适应免疫细胞参与的免疫调控,其中免疫球蛋白是适应免疫细胞中B细胞免疫的重要组成部分,但与炎症性肠病的关系并不十分明确。有研究[11]通过分析423例炎症性肠病患者,发现65例(22.7%)患者中IgG水平降低,24例(10.9%)IgM水平降低,可见低水平的免疫球蛋白在UC患者中并不少见,但其水平的变化于临床诊治是否有意义尚未明确。本研究通过回顾性分析106例活动期UC患者的临床资料,发现重度组UC患者的IgG与IgM水平明显低于轻中度组,广泛结肠型UC患者的IgG水平明显低于左半结肠组,IgG、IgM、CRP及ESR等炎症指标对UC疾病严重程度均具有预测价值,其中CRP预测价值最高,IgG及IgM略逊于CRP,但IgG预测价值优于IgM;在病变范围方面,IgG与CRP均具有预测价值,其中IgG预测价值更优。
免疫球蛋白是体液免疫的经典代表,其在抗炎及免疫调节中扮演重要的作用,是与特异性抗原结合的具有免疫功能的糖蛋白;与Fc受体结合促进巨噬细胞的吞噬作用,清除体内免疫复合物,从而达到抗炎作用。免疫球蛋白水平的降低(包括原发性及继发性)代表了体液免疫系统的缺失,即抗炎能力下降。王征等[7]发现低水平IgG(<7 g/L)的UC患者重型比例明显增加;王艳等[8]研究发现中重度的UC患者IgM水平较低。以上研究均提示低水平IgG或IgM的UC患者重症比例较高。可能的机制为IgG可以终止炎症过程并开始恢复免疫系统稳态[12],IgG是与特异性抗原结合的具有免疫功能的球蛋白,与Fc受体结合促进巨噬细胞的吞噬作用,清除体内免疫复合物,从而达到抗炎作用;另外,IgG主要通过Fc唾液酸化后获得抗炎特性,在诱导抗原特异性免疫反应后会降低[3],因此IgG水平下降可能使机体抗炎能力下降,从而加快疾病进展。而有关IgM与炎症性肠病的研究较少,究其原因,人体内IgM较IgG含量少,两者抗炎机制基本相似。肠道炎症反应影响黏膜免疫细胞的发育及内环境稳态也可能导致免疫球蛋白水平下降[13]。但也有相关文献报道与本研究结论并不一致。如Lin等[14]研究发现,免疫球蛋白的水平与UC的疾病活动无显著相关;而Wang等[15]研究发现,随着疾病严重程度加重,免疫球蛋白的水平也随之升高。这可能与对照组样本选取有关。现今有关于免疫球蛋白与炎症性肠病间关系的研究仍较少,但两者之间临床相关性却不容忽视,有研究[16]指出低水平的IgG/G1是发生炎症性肠病相关住院及手术治疗的独立危险因素,在克罗恩病中尤为显著,说明免疫球蛋白水平可作为预测炎症性肠病患者预后指标,同时也表明了增强体液免疫可能改善患者预后,但具体原因仍有待进一步研究。
目前鲜有研究评价IgG、IgM水平与UC患者肠道病变范围之间的相关性。本研究也显示,广泛结肠组的患者IgG水平更低,在预测效能方面高于CRP。本研究中,左半结肠组共38例,重度UC患者6例,广泛结肠组共68例,重度UC患者39例,广泛结肠组IgG水平较左半结肠组降低,考虑可能与广泛结肠组中重型患者较多有关,但具体原因仍需进一步探索。
本研究存在一定的局限性:(1)为回顾性的单中心研究;(2)样本量较少,并剔除了部分因病例不全或免疫球蛋白检测>1周的患者,可能导致数据偏倚;(3)轻症患者较少,未纳入缓解期UC患者;(4)未动态随访活动期及缓解期IgG及IgM的浓度变化。
综上,IgG及IgM水平与UC患者的病情严重程度呈负相关,IgG水平越低其肠道累及的范围越广,具有一定预测价值,对UC患者的临床诊治具有参考意义。课题组下一步拟对UC患者开展前瞻性研究,并动态观察活动期及缓解期时的变化,进一步评估其对疾病复发的预测价值。

