前列腺素D2在小鼠溃疡性结肠炎癌变模型中的作用探讨
林艺娟,陈金通,黄循铷,庄则豪,丁 健,王承党
福建医科大学附属第一医院消化内科,福建 福州 350005
溃疡性结肠炎(ulcerative colitis,UC)是一种病因不明、慢性复发性的非特异性结直肠炎症性疾病,以腹痛、腹泻、黏液血便为主要临床表现,可伴肠外表现[1]。UC的结直肠癌变风险比普通人群高60%,晚期预后差。目前多数认为UC相关癌变(ulcerative colitis associated carcinogenesis,UCAC)的发生经历了“炎症-不典型增生-癌症”模式发病[2]。已有研究发现,非甾体类消炎药(non-steroidal anti-inflammatory drugs,NSAIDs)对结直肠癌的发生及发展具有化学预防作用[3],但不良反应大。前列腺素D2(prostaglandin D2,PGD2)是环氧合酶2(cyclooxygenase 2,COX-2)的下游产物,以其受体作为防治靶点可能不良反应更低。本实验应用经典的氧化偶氮甲烷/葡聚糖硫酸钠(Azoxymethane/Dextran sodium sulfate,AOM/DSS)法模拟小鼠UC癌变模型[4-5],旨在探讨PGD2在实验性小鼠UC癌变过程中的可能作用及其D类前列腺素受体1(D prostanoid receptor 1,DP1)拮抗剂(BWA868c)作为预防UC癌变的可能应用前景。
1 材料与方法
1.1 材料
1.1.1 实验动物:8~10周龄SPF级雄性C57BL/6J小鼠40只,体质量18~22 g,购自湖南斯莱克景达实验动物有限公司[许可证号SCXK(湘)2016-0002]。用混合配方饲料喂养,自由进食饮水,每日更换饮水、饲料,定期更换垫料,保持小鼠生活环境通风和清洁卫生。本研究经福建医科大学附属第一医院伦理委员会批准,课题中所用的动物严格按照批准的研究方案开展研究工作。
1.1.2 主要实验试剂与器材:Azoxymethane(氧化偶氮甲烷,AOM,SLBV4860,SIGMA);BWA868c(0411898-75,Cayman Chemical Company);塞来昔布(R77190,Pfizer Pharmaceuticals LLC);葡聚糖硫酸钠(Dextran Sodium Sulfate Salt Colitis Grade,DSS,Q1733,MP Biomedicals);Rabbit Polyclonal Anti-COX-2(ab62331,Abcam);Rabbit Anti-β-catenin(bs-1165R,Bioss);Rabbit聚合HRP标记抗兔IgG(SV0002,博士德);5% BSA封闭液(SW3015,Solarbio);Mouse PGD2 ELISA检测试剂盒(MM-4372MI,酶免);数字电子称(GS-100,深圳市昊天网络科技有限公司);BCA蛋白定量试剂盒(BCA Protein Assay Kit)(CW0014S,康为世纪);精密电子称(FA2104N,上海菁海仪器有限公司);酶标仪(RT-6100,Rayto);数字显微摄像系统(Olympus公司)等。
1.2 方法
1.2.1 动物分组及处理:40只8~10周龄SPF级雄性C57BL/6J小鼠,体质量18~22 g,适应性喂养7 d。(1)在第8天时根据体质量按照1∶3随机分为空白对照组(Con组,10只)和实验组(30只),其中,实验组小鼠腹腔注射(ip)AOM溶液(10 mg/kg)1次,Con组小鼠等量质量浓度为9 g/L的NaCl溶液ip,均正常饮水喂食7 d。(2)在第15天时,将实验组小鼠按体质量再随机分为3个亚组:模型对照组(AOM-Con组)、COX-2抑制剂组(COX-2组)和DP1拮抗剂组(DP1组),其中,AOM-Con组小鼠自由饮用无菌蒸馏水;COX-2组小鼠接受塞来昔布(10 mg/kg[6])灌胃、1次/d;DP1组小鼠接受BWA868c(100 μg/kg[7-8])ip、2次/d。上述处理措施直至第84天(第12周末),实验结束。(3)从第22天(第4周第1天)开始,上述3个亚组的小鼠开始自由饮用质量浓度为20 g/L的DSS水溶液7 d,然后恢复正常饮水14 d,3周为1个DSS周期,总共3个周期的DSS循环;整个实验过程Con组小鼠自由饮用无菌蒸馏水。
1.2.2 一般情况:自实验开始,每3~4 d观察小鼠的摄食量、毛发、体质量、便血及死亡等情况的变化。计算疾病活动指数(DAI值)[9]。
1.2.3 病理学:第85天,麻醉处死小鼠,取全段结肠、直肠标本,称重,沿纵轴切开,用放大镜观察黏膜的损伤程度(炎症、溃疡及肿瘤等)并评分:(1)腺瘤样占位:无计0分;1处计2分;>2处计4分;(2)溃疡形成及炎症:无计0分;局部充血无溃疡计1分;1处溃疡不伴充血或肠壁增厚计2分;1处溃疡伴炎症计3分;≥2处溃疡伴炎症计4分;≥2处溃疡伴和/或炎症≥1 cm计5分;溃疡和/或炎症≥2 cm,病变范围每增加1 cm计分加1分,共6~8分;(3)黏连:无计0分;轻度计1分;重度计2分[10]。
取结直肠组织病变严重处置于10%甲醛溶液内固定,组织石蜡包埋,连续切片(厚4 μm),行HE染色,光镜下观察结肠黏膜组织形态学改变并评分:(1)炎症:无计0分;轻度计1分;重度计2分;(2)肉芽肿:无计0分;有计1分;(3)溃疡:无计0分;小溃疡<3 cm计1分;大溃疡≥3 cm计2分;(4)纤维化:无计0分;轻度计1分;重度计2分;(5)病变深度:无计0分;黏膜下层计1分;肌层计2分;浆膜层计3分;(6)上皮内瘤变:无计0分;低级别上皮内瘤变计1分;高级别上皮内瘤变计2分[11](备注:低级别上皮内瘤变指结构和细胞学异常限于上皮的下半部,相当于轻度和中度异型增生;高级别上皮内瘤变指结构和细胞学异常扩展到上皮的上半部,乃至全层,相当于重度异型增生和原位癌)。
1.2.4 结肠组织PGD2测定:切取部分结肠组织制成匀浆,离心获取上清液,参照ELISA试剂盒按说明书测定PGD2含量。
1.2.5 Western blotting检测结肠组织COX-2、β-catenin的表达:取结肠组织提取总蛋白,利用BCA试剂盒进行蛋白浓度测定。蛋白变性、上样、电泳1~2 h,湿法转膜30~50 min,4 ℃孵育一抗溶液过夜;室温孵育二抗1~2 h。GAPDH作为内参照,在膜上滴加ECL曝光液,曝光。用“Quantity One”软件分析各抗体条带灰度值,以目的蛋白与GAPDH的密度比值作为目的蛋白的相对含量。

2 结果
2.1 一般情况和DAI评分实验过程中无小鼠死亡。Con组小鼠毛色光整,反应灵活,活动、进食、排便均正常,体质量增加;实验组小鼠前4周出现精神萎靡、腹泻、体质量下降、肉眼血便等症状。经非参数检验各组DAI评分均服从正态分布。经ANOVA法分析,各组小鼠DAI评分差异有统计学意义(F=19.693,P=0.000)。经Levene法检验,方差齐(F=1.995,P=0.132),故组间两两比较采用LSD-t法:与Con组相比,AOM-Con组、COX-2组、DP1组的DAI评分均明显升高(P均=0.000),而这三组之间两两比较,差异均无统计学意义(P=0.942、0.926、0.984);第29天之后,各组DAI评分较前均降低,体质量有所回升。AOM-Con组仍有部分小鼠明显黏液血便,COX-2组和DP1组小鼠稀便转为糊状乃至成形便,肉眼看不到血便,个别小鼠粪OB阳性。经非参数检验各组DAI评分均服从正态分布。经ANOVA法分析,各组小鼠DAI评分差异有统计学意义(F=42.289,P=0.000)。经Levene法检验,方差齐(F=2.669,P=0.062),故组间两两比较采用LSD-t法:与AOM-Con组相比,Con组、COX-2组、DP1组的DAI评分明显升高,差异有统计学意义(P=0.000),但COX-2组、DP1组与Con组相比,差异均无统计学意义(P=0.065、0.271)(见表1)。

表1 各组小鼠DAI评分Tab 1 DAI scores of mice in each group
2.2 病理学
2.2.1 结肠形态学改变:Con组小鼠结肠黏膜光滑,血管纹理清晰,未见充血、水肿及糜烂溃疡改变;AOM-Con组结肠黏膜苍白,表面凹凸不平,部分小鼠结肠周围出现黏连现象,不易与其他组织分开,同时肠内可见多发息肉状隆起性病变;COX-2组、DP1组小鼠结肠黏膜欠光滑,表面潮红、充血、水肿,其中COX-2组、DP1组个别小鼠的结肠组织见散在浅小溃疡、小息肉样增生(见图1)。经非参数检验各组数据均服从正态分布。经ANOVA法分析,各组小鼠解剖学评分差异有统计学意义(F=74.361,P=0.000)。经Levene法检验,方差齐(F=0.583,P=0.630),故组间两两比较采用LSD-t法:Con组与AOM-Con组、COX-2组、DP1组比较,差异均有统计学意义(P均=0.000),COX-2组和DP1组与AOM-Con组比较,差异均有统计学意义(P均=0.000),而COX-2组和DP1组比较,差异无统计学意义(P=0.689,见表2)。

图1 小鼠结肠形态学表现 A: Con组; B: AOM-Con组; C: COX-2组; D: DP1组Fig 1 Morphological manifestation of mice colon A: Con group; B: AOM-Con group; C: COX-2 group; D: DP1 group
2.2.2 结肠组织HE染色病理学观察:Con组黏膜上皮结构完整、清晰,黏膜固有层个别炎症细胞浸润;AOM-Con组可观察到中重度炎症,炎症细胞浸润至黏膜固有层,腺体大小不等,排列紊乱,部分腺体出现异常增生细胞,大小不等,形态多样,核大深染,核分裂相增多,呈低级别上皮内瘤变,局灶呈高级别上皮内瘤变,无溃疡形成,纤维化不明显;COX-2组和DP1组均可见结肠轻度炎症,炎症细胞浸润至黏膜固有层,其中COX-2组浆膜下层纤维化明显(见图2)。经非参数检验各组数据均服从正态分布。经ANOVA法分析,各组小鼠光镜下评分差异有统计学意义(F=49.899,P=0.000)。经Levene法检验,方差齐(F=0.552,P=0.650),故组间两两比较采用LSD-t法:与Con组比较,COX-2组、DP1组光镜下评分均升高,差异有统计学意义(P=0.001、0.005),但较AOM-Con组下降,说明结肠黏膜炎症均有明显改善,差异有统计学意义(P均=0.000),COX-2组与DP1组比较,差异无统计学意义(P=0.463)(见表2)。
2.3 结肠组织PGD2的表达变化经非参数检验各组数据均服从正态分布。经ANOVA法分析,各组小鼠PGD2的表达差异有统计学意义(F=79.193,P=0.000)。经Levene法检验,不满足方差齐性(F=5.402,P=0.004),用Tamhane法进行组间两两分析:AOM-Con组PGD2水平较Con组、COX-2组、DP1组明显上升,差异有统计学意义(P均=0.000);COX-2组、DP1组的PGD2水平与Con组比较,差异无统计学意义(P=0.691、0.230)(见表3)。
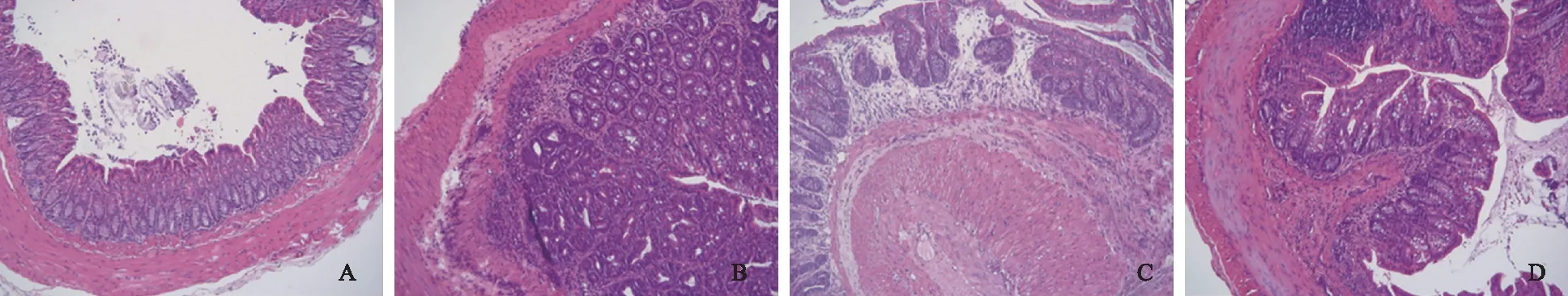
图2 结肠组织病理学结果(HE染色,放大100倍) A: Con组; B: AOM-Con组; C: COX-2组; D: DP1组Fig 2 Histopathology results of colon tissues A: Con group; B: AOM-Con group; C: COX-2 group; D: DP1 group

表2 各组小鼠结肠病理学评分Tab 2 Colon pathology scores of mice in each group

表3 各组小鼠结肠组织PGD2的表达Tab 3 Expression of PGD2 in colon tissue of mice in each
2.4 结肠组织COX-2、β-catenin的表达变化
2.4.1 结肠组织COX-2的表达变化:经非参数检验各组数据均服从正态分布。经ANOVA法分析,各组小鼠结肠组织COX-2的表达差异有统计学意义(F=29.642,P=0.000)。经Levene法检验,方差齐(F=2.494,P=0.075),故组间两两比较采用LSD-t法:DP1组与Con组、COX-2组相比均明显升高,差异有统计学意义(P均=0.000),而与AOM-Con组比较,差异无统计学意义(P=0.282);COX-2组与Con组比较,差异无统计学意义(P=0.588)。提示塞来昔布可显著抑制结肠组织中COX-2的表达,而DP1拮抗剂对COX-2的表达无抑制作用(见图3、表4)。
2.4.2 结肠组织β-catenin的表达变化:经非参数检验各组数据均服从正态分布。经ANOVA法分析,各组小鼠结肠组织β-catenin的表达差异有统计学意义(F=85.396,P=0.000)。经Levene法检验,方差齐(F=2.077,P=0.121),故组间两两比较采用LSD-t法:COX-2组、DP1组与Con组相比仍有所升高,差异有统计学意义(P=0.029、0.004),但二者与AOM-Con组相比均明显下降,差异有统计学意义(P均=0.000),提示DP1拮抗剂和塞来昔布均可使结肠组织中的β-catenin明显下降(见图3、表4)。
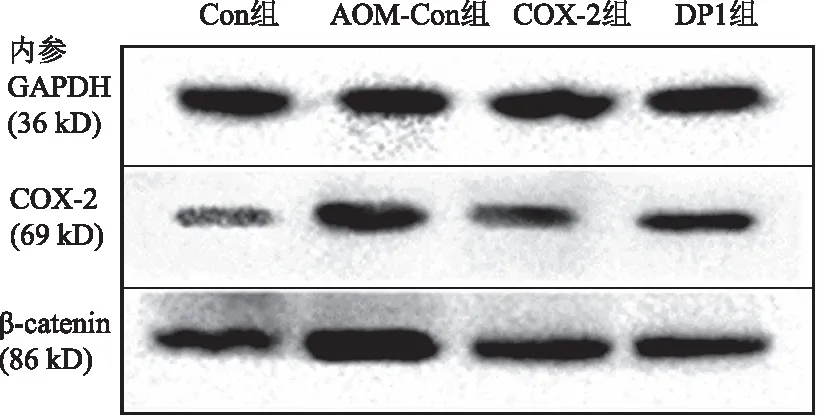
图3 Western blotting检测各组小鼠结肠组织COX-2、β- catenin的表达Fig 3 Expressions of COX-2 and β-catenin in colon tissue of mice in each group detected by Western blotting

表4 各组小鼠结肠组织COX-2、β-catenin的表达Tab 4 Expressions of COX-2 and β-catenin in colon tissue of mice in each group
3 讨论
本实验应用经典AOM/DSS模拟小鼠UC癌变模型,通过研究PGD2在实验性小鼠UC癌变过程中的表达变化,探讨PGD2在UCAC中的作用。我们发现,在小鼠UC癌变模型中结肠组织异型增生病灶与COX-2、PGD2的表达均上调,而在COX-2组和DP1组β-catenin的表达及结肠组织中异型增生病灶均相应减少,但COX-2组小鼠结肠组织纤维化明显。PGD2的DP1拮抗剂BWA868c可能具有预防结肠炎癌变的作用。
与人类结肠癌发病机制相似,在人类和动物结肠炎缓解期的结肠上皮中均发现β-catenin表达显著增加[12]。β-catenin是细胞黏附的重要蛋白,是介导Wnt信号传导的转录激活因子。Wnt/β-catenin信号通路在进化过程中高度保守,该通路任何成分的变化均会导致信号传导的异常,引起细胞恶变,最终导致恶性肿瘤的发生[13]。AOM/DSS小鼠模型是目前研究UC炎癌转化的主要模型,成瘤率高,AOM可通过诱导K-ras、β-catenin等基因的突变诱发早期癌前病变的异常隐窝灶(aberrant crypt foci,ACF)形成,进而促进结肠癌的发生、发展。不同品系的小鼠对AOM/DSS的耐受性、敏感性存在差异。研究发现,C57BL/6J小鼠是构建该模型的首选品系,可以保证遗传背景上的高度稳定性和实验数据的一致性[14]。目前动物雌雄对研究结果的影响尚不明确,但Son等[15]研究发现,雌性较雄性肿瘤数量减少,肿瘤发生率降低,肿瘤多样性减少;在早期炎症阶段,雌二醇干预能抑制炎症程度,减少肿瘤的发生。故本研究应用经典的AOM/DSS模拟UC慢性炎症期癌变的过程,且选用雄性C57BL/6J小鼠作为动物模型。结果提示,模型组结肠黏膜β-catenin水平显著升高,经选择性COX-2抑制剂(塞来昔布)或DP1拮抗剂(BWA868c)预防性治疗后,小鼠结肠组织中β-catenin的表达明显下降。提示COX-2和PGD2参与结肠上皮中β-catenin的上调,这也增加了在其他情况下β-catenin途径失调时,抑制COX-2或阻断DP1具有治疗益处的可能性。
COX-2是前列腺素合成有关的诱导酶,在正常组织中检出率低,而在白介素-1(IL-1)、氧自由基、表皮生长因子(EGF)、肿瘤坏死因子(TNF)等刺激下,可产生一系列前列腺素。COX-2及由其活化产生的前列腺素在炎症中占有重要地位,可调节靶基因的转录,改变细胞某些增殖和凋亡相关基因的表达,刺激细胞增殖、促进血管生成、抑制细胞介导的免疫反应,促进肿瘤形成,在UC癌变中发挥作用。因此,通过抑制COX-2或相关前列腺素可以预防肿瘤的发生、发展,同时也可以作为判断炎症、异型增生、原位癌、浸润癌等各种生理病理变化预后的参考指标之一[16-17]。目前多数认为UCAC的发生经历了“炎症-不典型增生-癌症”模式发病,癌变的风险与炎症反应持续的时间和严重程度呈正比。已有研究发现,阿司匹林和其他NSAIDs,尤其是以COX-2抑制剂为主的抗炎药塞来昔布对包括结直肠癌在内的多种肿瘤的发生及发展具有一定的化学预防作用。本实验结果提示,至实验结束,各组小鼠DAI评分、解剖学评分及光镜下评分均有所下降,结肠炎症均有所缓解,提示UC进入缓解期。与此同时,模型组结肠黏膜COX-2、PGD2水平及异型增生病灶均较其他组增多,而塞来昔布预防给药组小鼠结肠组织中COX-2、PGD2的表达及异型增生病灶均明显下调,对UC癌变可以起到预防作用。但COX-2及其诸多前列腺素产物在结肠炎的背景下起着重要的消炎和促愈等积极作用[18],使用该类药物可能导致UC患者产生很多不良反应,如肝肾功能异常、心血管不良事件、加重结肠炎或诱发缓解期的结肠炎复发、增加机体感染性疾病的易感性、消化道出血或导致组织修复不良等[19]。本实验中观察到COX-2组结肠组织浆膜下层纤维化明显。因此,进一步了解其下游的前列腺素产物的病理生理作用,并以其下游产物及相应受体作为防治靶点(如PGD2、H-PGDS、DP1),不良反应可能降低。
PGD2是COX-2的主要产物之一,由脂质运载蛋白型PGD合成酶(LPGDS)和造血型PGD合成酶(HPGDS)活性产生,由Hamberg于1973年鉴定,近20年来人们才逐渐揭开它的病理生理作用[18]。PGD2通过刺激两个不同的G蛋白偶联受体,即DP1和Th2细胞上表达的趋化性受体同源分子(CRTH2/DP2)发挥其生理作用。在过敏反应、炎症的不同阶段及癌变过程中扮演重要角色,但存在争议[18,20]。目前大部分研究认为,PGD2在UC急性期起抗炎作用[21],有研究认为,由DP1介导的是抗炎作用,而由CRTH2介导的是促炎作用[22-23];在不同的组织器官中,有研究认为PGD2有抑癌作用,而有的研究则认为是促癌作用[18];我们推测之所以不同的研究结果不一致,可能与不同的组织器官或在疾病的不同阶段,PGD2、相应受体的表达及下游产物存在差异有关。在人类及动物UC急性期观察到PGE2明显升高[24-25],但炎症消退后,结肠组织COX-2、PGD2(而不是PGE2)、其受体DP1表达明显上调并持续存在,同时伴随着ACF的增多[8,25]。因此我们推测,PGD2通过作用于DP1在UC慢性期有促进癌变的作用。以PGD2受体作为调控靶点具有对其他前列腺素家族的生理作用影响小、对局部结肠组织或其他组织器官影响较小等优点,有良好的开发前景。本研究通过预防性使用DP1拮抗剂(BWA868c)阻断PGD2的作用,结果显示,小鼠结肠组织肉眼损伤评分及病理组织学评分均明显下降,PGD2及β-catenin的表达显著下调,异型增生情况明显改善,但结肠组织中COX-2水平并无下降。提示高水平的PGD2很可能会促进UC癌变,DP1拮抗剂通过阻断PGD2的作用可预防结肠癌的发生;另外DP1拮抗剂对上游COX-2的表达影响不大,提示该药相对塞来昔布不良反应可能更少。当然本实验还有诸多问题尚待明确,如PGD2的其他受体(如CRTH2)或其下游产物(15-脱氧-△12,14-前列腺素J2,15d-PGJ2)[21]也很可能参与UC炎症、癌变的病理生理的调节过程,仍有待进一步研究。
综上所述,本实验提示在小鼠UC癌变模型中,结肠黏膜异型增生病灶的增多很可能与PGD2的表达上调相关;COX-2抑制剂及DP1拮抗剂均可改善AOM/DSS诱导的小鼠慢性结肠炎异型增生,起到预防癌变的作用,但DP1拮抗剂较COX-2不良反应小,有良好的开发前景,为将来的治疗提供了实验基础。

