白酒糟与菊芋渣混合青贮发酵品质及微生物菌群多样性
任海伟,王 莉,朱朝华,孙安琪,王治业,李金平,李志忠
白酒糟与菊芋渣混合青贮发酵品质及微生物菌群多样性
任海伟1,3,4,王 莉1,朱朝华1,孙安琪1,王治业2,李金平1,3,4,李志忠1※
(1. 兰州理工大学生命科学与工程学院/西部能源与环境研究中心,兰州 730050;2. 甘肃省科学院生物研究所,兰州 730050;3.甘肃省生物质能与太阳能互补供能系统重点实验室,兰州 730050;4. 西北低碳城镇支撑技术协同创新中心,兰州 730050)
利用青贮原理将白酒糟和菊芋渣混合进行固态发酵,二者按照不同鲜质量比发酵10、30、60 d时,分别考察营养成分、木质纤维含量和发酵特性的动态变化,并通过高通量测序技术解析发酵微生物菌群多样性。结果表明,当白酒糟和菊芋渣以1.2:1和1:1.5比例发酵时,可溶性碳水化合物含量显著高于其他处理组(<0.05),中性洗涤纤维、酸性洗涤纤维和木质素含量均显著低于其他处理组(<0.05),相对饲用价值和生物降解潜力较高。发酵过程中pH值、乳酸和氨氮含量等特性参数均处于优良青贮品质范围,-score评分均为优等。白酒糟或菊芋渣单独发酵期间主要以变形菌和厚壁菌门细菌为主,混合发酵时则演变为以厚壁菌门、乳杆菌属细菌为主。总之,白酒糟与菊芋渣能通过生化互补特性发挥协同效应实现优质青贮,综合考虑糟渣生物质资源的利用价值和处理效率等因素,实际生产中建议以1.2:1比例混合青贮发酵30 d为宜,可获得良好发酵品质。
废弃物;发酵;菌群;白酒糟;菊芋渣
0 引 言
中国是农产品生产加工大国,每年有大量的酒糟、薯渣、果渣等加工副产物产生。据不完全统计,2019年全国各类糟渣副产物的产量超过1.8亿t,其中白酒酿造、蒸馏后的酒糟量高达2 600万t。这些废弃物资源富含蛋白质和碳水化合物(纤维素、半纤维素)等组分,可用于生产动物饲料、生物肥料、生物能源、化工产品,利用潜力巨大[1]。但因其产量大、含水率高、营养丰富、季节性加工等特点,短期内处理不及时或露天放置极易发生腐败变质,从而造成环境污染和资源浪费。若采用干燥或冷冻方式保存则能耗较高,既不经济也不现实,如何短时间有效处置这些废物资源(尤其夏秋高温季节)已成为农产品加工业循环发展的难题。
青贮作为一种微生态保存技术,是在含水率为65%~75%的厌氧环境中,通过附着(或外源添加)的有益乳酸菌繁殖代谢产生乳酸、乙酸等有机酸,使pH值快速下降并抑制酵母菌、霉菌等腐败微生物,从而有效保存有机组分,已被广泛用于酒糟、马铃薯渣、苹果渣、甘蔗渣等副产物的加工贮存[2-4]。研究表明,青贮发酵是复杂的生物质生化转化和微生物菌群活动过程,原料组分特性(如水分、糖分)和微生物菌群都会影响发酵品质。酒糟一般可采用直接青贮、添加剂青贮和混合青贮等方式实现保存[5-6],而对于含水率较低的干酒糟而言,单独青贮无法成功启动,只有与水分、糖分含量较高的特定原料混合发酵才能获得良好青贮品质。菊粉提取加工后的菊芋渣中含水率约80%~85%[7],且富含可溶性碳水化合物,与干酒糟进行混合固态发酵,可以通过特性互补来实现良好青贮,但这方面的研究还鲜有文献报道。另一方面,青贮发酵品质与发酵过程的微生态演变密切相关。高通量测序技术已被证实是探索复杂环境微生物和跟踪发酵过程的有效研究手段,能动态揭示发酵过程中微生物菌群变化,在解析传统食品发酵及其副产物青贮过程中的微生物菌群方面发挥着重要作用[8-10]。
基于此,本文选取白酒糟和菊芋渣为研究对象,利用青贮原理将二者进行混合固态发酵,从营养成分、木质纤维组分、发酵特性等角度探讨混合发酵过程中主要有机物质和微生物代谢产物的变化规律,并通过HiSeq2500高通量测序平台对发酵过程中的细菌群落动态演绎进行跟踪分析,从而确定适宜的混合发酵比例和周期,为农产品加工副产物的及时处理与可持续利用奠定基础。
1 材料与方法
1.1 试验材料
自然风干后的白酒糟取自甘肃金徽酒股份有限公司,含水率为15.83%;鲜湿菊芋渣来源于甘肃白银熙瑞生物工程有限公司,含水率为89.30%。2种原料的有机组分含量如表1所示。
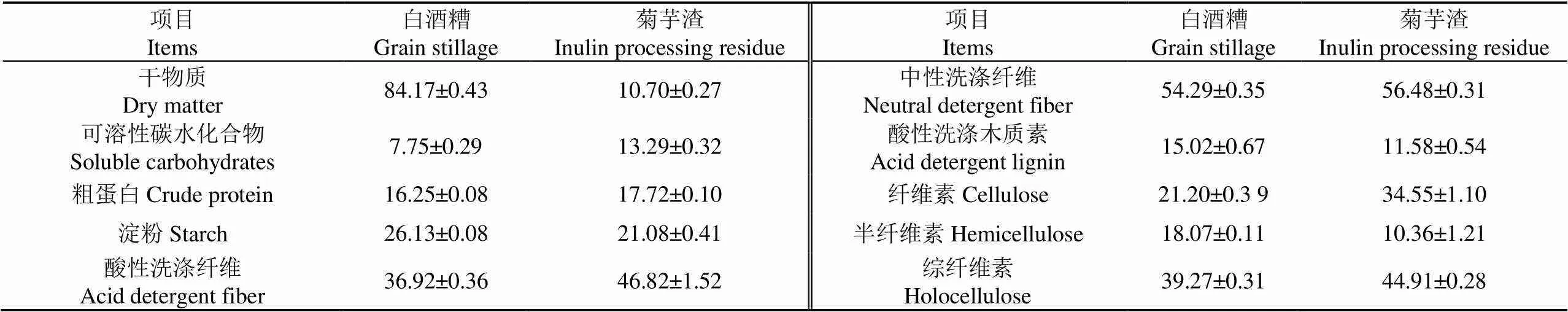
表1 白酒糟和菊芋渣的主要有机组分
1.2 试验方法
1.2.1 混合青贮发酵的试验设计
依据青贮发酵原理,将白酒糟与菊芋渣按不同鲜质量比(1:0,4:1,2:1,1.2:1,1:1.5,1:2.7,1:7和0:1)混合,总质量均为1 kg。混合体系的含水率分别为15.83%、30%、40%、50%、60%、70%、80%、89.30%,依次命名为SJ、M3、M4、M5、M6、M7、M8、SY,合计8个处理组,每个处理组3个平行,(20±1)℃恒温发酵10、30和60 d时取样分析,考察营养成分、木质纤维组分、发酵特性的动态变化和微生物菌群演绎。
1.2.2 取样与预处理
称取3份有代表性发酵样品,一份用于测定干物质和主要有机组分。另一份按照1:9料液比(质量体积比)加入蒸馏水混合打浆,依次经过4层纱布和定性滤纸过滤后离心(3 900 r/min,10 min),上清液抽滤获得发酵浸提液,用于测定pH值和微生物代谢产物(乳酸、乙酸等微生物代谢物)。第三份样品于−20 ℃冻存用于微生物菌群分析。
1.2.3 分析方法
1)有机组分分析
干物质(Dry Matter,DM)含量测定采用105 ℃烘干恒质量法;可溶性碳水化合物(Water Soluble Carbohydrates,WSC)含量采用蒽酮-硫酸比色法测定;总氮(Total Nitrogen,TN)含量采用K9840凯氏定氮仪测定,粗蛋白含量=总氮×6.25;淀粉(Starch,ST)含量采用酸水解法测定;酸性洗涤纤维(Acid Detergent Fiber,ADF)、中性洗涤纤维(Neutral Detergent Fiber,NDF)和酸性洗涤木质素(Acid Detergent Lignin,ADL)含量采用F800纤维测定仪测定,纤维素(Cellulose,CL)、半纤维素(Hemicellulose,HC)、综纤维素(Holocellulose,HoC)含量按照公式(1)~(3)计算[11]:
CL=ADF−ADL (1)
HC=NDF−ADF (2)
HoC=CL+HC (3)
生物降解潜力(Biodegradation Potential,BDP)计算公式为式(4):
BDP= HoC/ADL (4)
相对饲用价值(Relative Feed Value,RFV)计算公式为式(5)[12]:
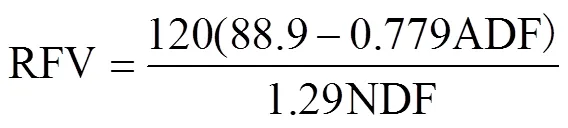
2)发酵特性分析
pH值采用丹佛UB-7型酸度计测定;氨氮采用苯酚-次氯酸比色法测定;有机酸分析采用安捷伦1200高效液相色谱仪(配置KC-811离子柱和DAD检测器),柱温50 ℃,流动相为3 mmol/L HCLO4溶液,进样量5L。发酵品质评价采用-score评分法[13],分为优(-score≥80)、中(60≤-score<80)和差(-score<60)三等。
3)高通量微生物菌群分析
无菌环境下取20 g青贮样品与200 mL无菌生理盐水混合,37 ℃振荡2 h制得菌悬液,无菌滤膜过滤获得微生物菌体。依Water DNA试剂盒步骤提取微生物总DNA。PCR扩增区域为16SrDNA V3-V4区,选择的引物为带有barcode的515F(5'-ACTCCTACGGGAGGCAGCA-3')和907R(5'-GGACTACH VGG GTWTCTAAT-3')。采用PCR仪对细菌16SrDNA基因进行PCR扩增。每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;最后采用氢氧化钠对PCR产物变性,产生单链DNA片段,用Illumina MiSeq平台进行测序。将测序结果与NCBI基因库比对,然后按照97%相似性水平划分操作分类单元(OTU),选取最优序列作为代表性序列。利用QIIME软件计算Alpha多样性指数(Shannon和Chao1指数等),并选取相对丰度高于0.1%的细菌类群进行门、属水平分析[14]。
1.2.4 数据分析
基础数据经Excel 2007软件整理并用SPSS 20.0软件统计分析,结果用平均值±标准差表示。对不同处理组数据进行单因素和一般线性模型分析,<0.05代表差异显著,<0.01代表差异极显著,>0.05代表差异不显著。
2 结果分析与讨论
2.1 发酵过程中的营养成分变化
粗蛋白、可溶性碳水化合物和淀粉是重要的营养物质,能直观反映青贮发酵前后的营养价值高低。由图1a可知,与发酵前原料相比,除SY组外,SJ组及6个混合发酵组(M3~M8)中的粗蛋白含量均显著下降(<0.05),这可能是由于发酵初期原料附着的某些好氧蛋白降解菌未能被及时抑制,在残氧存在状态下依然有一定活性,促进了蛋白分解消耗。另一方面,发酵10、30、60 d时,粗蛋白含量随菊芋渣比例的增加而显著升高(<0.05),说明添加菊芋渣有利于粗蛋白含量的保存和营养价值提升。
可溶性碳水化合物(WSC)是发酵微生物菌群繁殖代谢的重要底物,较高的初始WSC含量(>5% 干物质质量)才能保证发酵成功[15]。试验中2种原料的WSC含量均高于青贮发酵必要条件,为微生物菌群繁殖提供了良好底物。发酵10 d时,8个处理组的WSC被微生物消耗代谢转化生成有机酸等中间产物,含量均显著下降(<0.05);发酵30和60 d时,WSC含量又有所增加(图1b),这可能是由于长时间发酵和酸性青贮环境,使纤维素、半纤维素等结构性碳水化合物发生分解,产生可溶性糖所致[16]。从混合比例角度来看,发酵60 d期间M5和M6组的WSC含量显著高于其他处理组(<0.05),说明适宜的混合比例(1.2:1和1:1.5)能减少WSC组分损失。
淀粉也是青贮发酵过程中一种重要的非结构性碳水化合物和能量物质。由图1c可知,SJ和SY 2个单独发酵处理组的淀粉含量随时间变化呈波动变化,规律不明显。对6个混合发酵处理组而言,当菊芋渣比例较低(4:1和2:1)时淀粉含量随时间延长呈增加趋势;当菊芋渣比例较高(1.2:1、1:1.5和1:2.7)时淀粉含量呈先增加后减少趋势,且5个处理组(M3~M7)的淀粉含量均显著高于发酵前。这是因为,常见的青贮乳酸菌群并不具备分解淀粉的能力,WSC 是厌氧青贮发酵过程中乳酸菌群的主要发酵底物,乳酸菌优先将WSC作为能量来源转化为乳酸等有机酸,从而抑制好氧微生物菌群对淀粉的分解,导致其相对含量增加[17]。当菊芋渣比例进一步增至1:7(M8组),发酵10 d时的淀粉含量显著下降,30d后变化差异不显著(>0.05)。另一方面,随着菊芋渣比例的提高,混合发酵处理组的淀粉含量呈整体下降趋势,这不仅与原料本底的淀粉含量有关,还与发酵过程中降解淀粉的微生物及其分解酶相关[18]。总之,发酵时间、混合比例及其交互作用对粗蛋白、可溶性碳水化合物和淀粉含量均有显著影响。
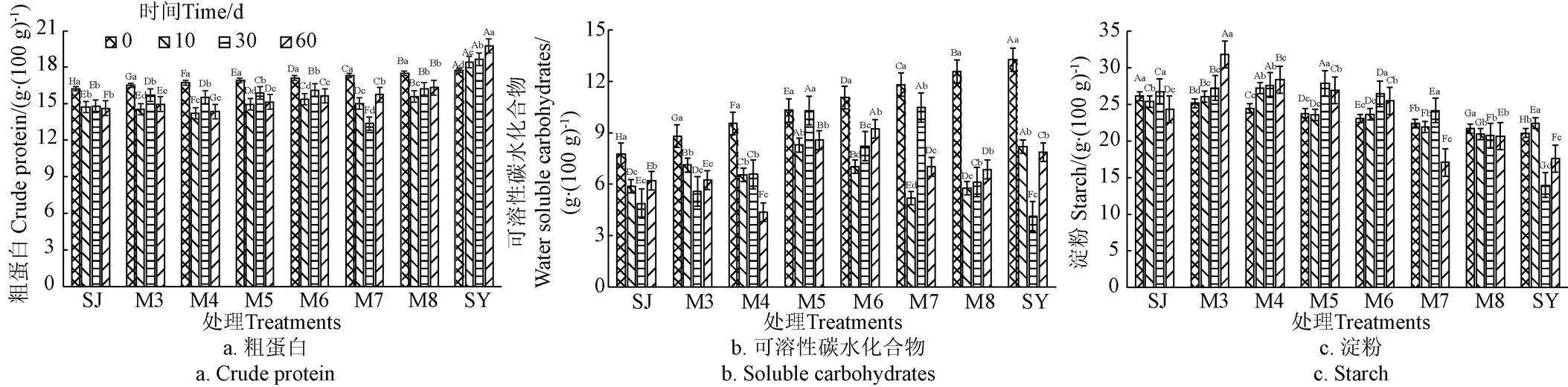
注:SJ-白酒糟单独青贮组;SY-菊芋渣单独青贮组;M3、M4、M5、M6、M7和M8依次表示白酒糟与菊芋渣的鲜质量比为4:1;2:1;1.2:1;1:1.5;1:2.7和1:7;不同大写字母表示相同时间不同处理组之间差异显著(P<0.05),不同小写字母表示相同处理组不同时间差异显著(P<0.05),下同。
2.2 发酵过程中的木质纤维组分变化
酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)和酸性洗涤木质素(ADL)是影响生物质消化降解性的主要组分,较低的NDF、ADL和一定含量的ADF有利于提高消化降解率[19]。由图2a可知,当菊芋渣比例过高或者过低时,随着发酵时间的延长ADF含量呈现升高趋势;当二者混合比例为1:1.5和1:2.7时ADF含量呈下降趋势,说明该混合比例范围有助于提高青贮降解性。另一方面,ADF含量随着菊芋渣比例的升高而呈上升趋势。NDF由不溶性纤维素、半纤维素等非淀粉多糖和木质素组成。发酵10和30 d时,随着菊芋渣比例的提高NDF含量总体呈现“升高-下降”趋势,而发酵60 d时呈下降趋势(图2b)。这是因为较高比例菊芋渣能提供丰富的营养物质使纤维分解菌变得旺盛;另一方面,随着发酵时间的延长,发酵体系中WSC组分含量不足以供给微生物菌群代谢利用,需要分解部分结构碳水化合物来补充碳源。再者,青贮过程中产生的乳酸等有机酸也会对结构碳水化合物产生一定分解作用[20-21]。ADL是影响纤维素和半纤维素等结构性碳水化合物降解的主要屏障,较高的ADL含量会导致生物降解率降低[19]。如图2c所示,除M7和M8组外,其余处理组(除M3)在青贮发酵30 d时的ADL含量显著低于其他时间段(<0.05);过高或过低的菊芋渣比例都使得ADL含量随发酵时间延长而呈现升高趋势;适宜的混合比例(如1.2:1)能促进ADL分解,使其含量显著降低。可见,适宜的青贮发酵时间和混合比例有助于减少ADL含量。
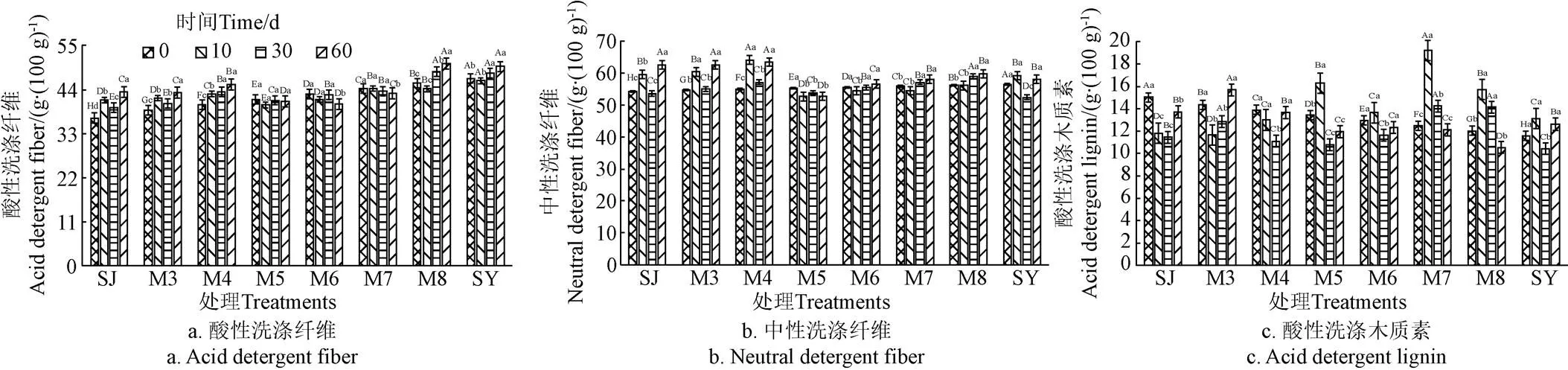
图2 发酵过程中木质纤维组分含量的变化
相对饲用价值是衡量动物摄入量和能量价值的重要指标,其值越高说明营养价值越高。由图3可知,当混合比例为1.2:1和1:1.5时青贮发酵物的相对饲用价值显著高于其他处理组,因为适宜的青贮发酵比例有助木质纤维组分含量的降低,从而使其饲用价值升高。生物降解潜力也是衡量青贮前后生物质可降解性能的重要指标。试验中,无论单独发酵还是混合青贮处理组,生物降解潜力均随着青贮发酵时间的延长而呈现增加趋势,说明较长时间的青贮有助于提升降解性能。

图3 发酵过程中相对饲用价值的变化
2.3 发酵特性变化
2.3.1 pH值
pH值是衡量青贮发酵品质的重要指标,优良青贮发酵pH值一般处于3.8~4.2范围,当pH值低于4.2时能有效抑制丁酸梭菌等有害微生物[22]。pH在4.4~4.7时发酵质量一般;pH值高于4.7时质量劣等。如图4所示,发酵10 d时,8个处理组的pH值均快速下降至3.78以下,且随着菊芋渣比例的提升pH值呈现增加趋势。发酵30和60 d时各处理组pH值处于3.8~4.2范围,且随时间延长和菊芋渣比例的增加也呈显著升高趋势(<0.05)。可见,不同比例酒糟和菊芋渣混合发酵或2种原料单独青贮发酵均能获得优良青贮品质,但菊芋渣比重过高的M8组和SY组在发酵60 d时pH值濒临临界阈值4.5或超出此范围,有腐败变质倾向,这可能是由于过高的含水率易导致腐败菌滋生所致[22]。
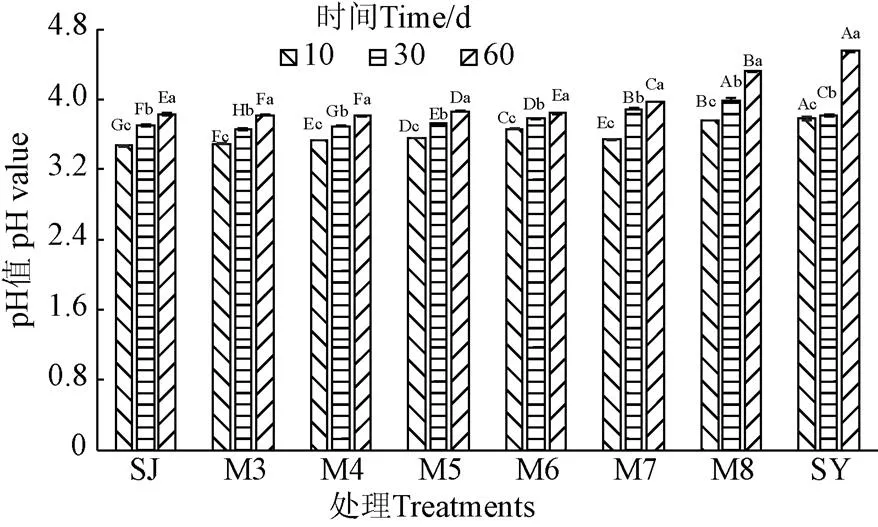
图4 发酵过程中pH值的变化
2.3.2 氨氮含量
氨氮(占总氮比值)含量反映了发酵过程中的蛋白质和氨基酸分解程度,氨氮含量越高说明氨基酸和蛋白质分解越多,意味着发酵品质变差,当氨氮含量超出7%时即认为腐败变质[23]。如图5所示,发酵10和30 d时,8个处理组的氨氮含量均随菊芋渣比重的增加而总体呈现先升高后下降趋势;发酵60 d时总体呈现增加趋势。但另一方面,8个处理组的氨氮含量均低于不良发酵阈值(7%TN),且最高值仅为5.38%,说明发酵期间蛋白质分解相对较低,这是因为青贮pH值的快速降低能有效抑制酶或微生物引发的蛋白质降解,从而降低氨氮含量[24]。另一方面,当菊芋渣比例较低时,由于微生物细胞渗透压增高引起的生理抑制作用使蛋白分解微生物受到抑制;当菊芋渣比例较高时,乳酸菌等有益菌群生长繁殖具备良好营养环境,能代谢利用碳水化合物产生乳酸、乙酸等有机酸,使pH值下降,进而抑制腐败微生物对蛋白质分解利用。这与姜富贵等[25]报道的降低含水率能有效抑制梭菌生长,进而降低蛋白质降解及氨生成相一致。
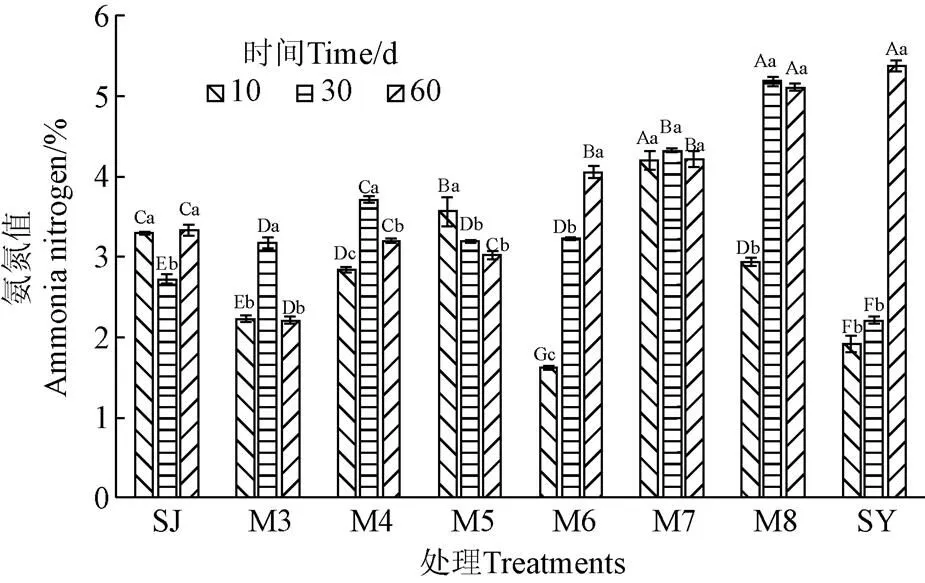
图5 发酵过程中氨氮含量的变化
2.3.3 微生物代谢产物
发酵过程中微生物菌群的代谢活动产生了乳酸、乙酸等小分子有机酸或醇类物质。研究表明,良好青贮体系的乳酸含量应占总有机酸(Lactic Acid/ Total Organic Acids,LA/TOA)60%以上,并占到干物质含量的3%~8%;乙酸应占到干物质含量的1%~4%[26]。另一方面,LA/TOA比值越大,丁酸含量越小,或不含丁酸,则青贮发酵品质越高。如表2所示,随着发酵时间的延长和菊芋渣比例增加,8个处理组的乳酸含量均呈现先升高后下降趋势,乙酸含量则呈显著升高趋势,这是因为发酵初期的可溶性糖底物相对充足,能为乳酸菌生长繁殖提供良好条件,代谢旺盛的乳酸菌产生大量乳酸(酸度系数pKa=3.86),使发酵体系pH值迅速下降,图4中10 d时的pH值变化趋势也印证了这一点。随着时间的延长,大量发酵底物被消耗,加之较低的pH值酸性环境等因素,使乳酸菌繁殖速率放缓,乳酸累积量呈现下降趋势(表2)。另一方面,发酵体系中的乙酸含量呈增加趋势,这可能是因为少量异型发酵乳酸菌能生成具有抗真菌作用的乙酸,从而提高有氧稳定性[27-28]。这与Ranathunga、Mjoun等报道的酒糟与甜菜、酒糟与玉米秸秆混合青贮发酵过程中乙酸含量随时间延长而增加的趋势相吻合[29-30]。有机酸组分的联动变化使乳酸/乙酸比值(乳/乙比)整体呈下降趋势,但仍高于2:1,且多数处理组的乳/乙比始终高于3,说明混合青贮发酵过程主要以同型乳酸发酵为主;同时LA/TOA在发酵60 d期间均高于0.6(除60 d时SY组),显示出良好的乳酸发酵强度。另外,发酵60 d期间,部分处理组检测出少量甲酸。甲酸在常规青贮发酵中相对少见,但它是一种常用的青贮添加剂。据报道,甲酸能使青贮物料快速酸化,进而抑制有害微生物,减少蛋白质损失,并对结构性碳水化合物具有酸解作用[20]。有学者在银杏叶青贮中发现有益微小杆菌()能发酵葡萄糖产生甲酸[28];本试验中的微生物菌群分析结果(图7)也显示有少量丰度的存在,这可能是甲酸存在的重要原因。此外,青贮发酵过程中丙酸、丁酸、戊酸等有机酸均未检出。丁酸菌是青贮腐败菌,未检出丁酸说明青贮发酵过程未发生腐败变质。总体而言,8个处理组的乳酸含量在发酵60 d期间均符合良好青贮范围,-score评分均为优等(≥88),尤其酒糟与菊芋渣混合青贮的乳酸含量相对较高,这与Yuan等[31]报道的燕麦秸秆青贮时添加白酒糟能显著增加乳酸含量结果一致。可见,酒糟与菊芋渣混合青贮发酵品质相对较好,发酵时间、混合比例及其交互作用对青贮发酵代谢产物均有极显著影响(<0.001)。
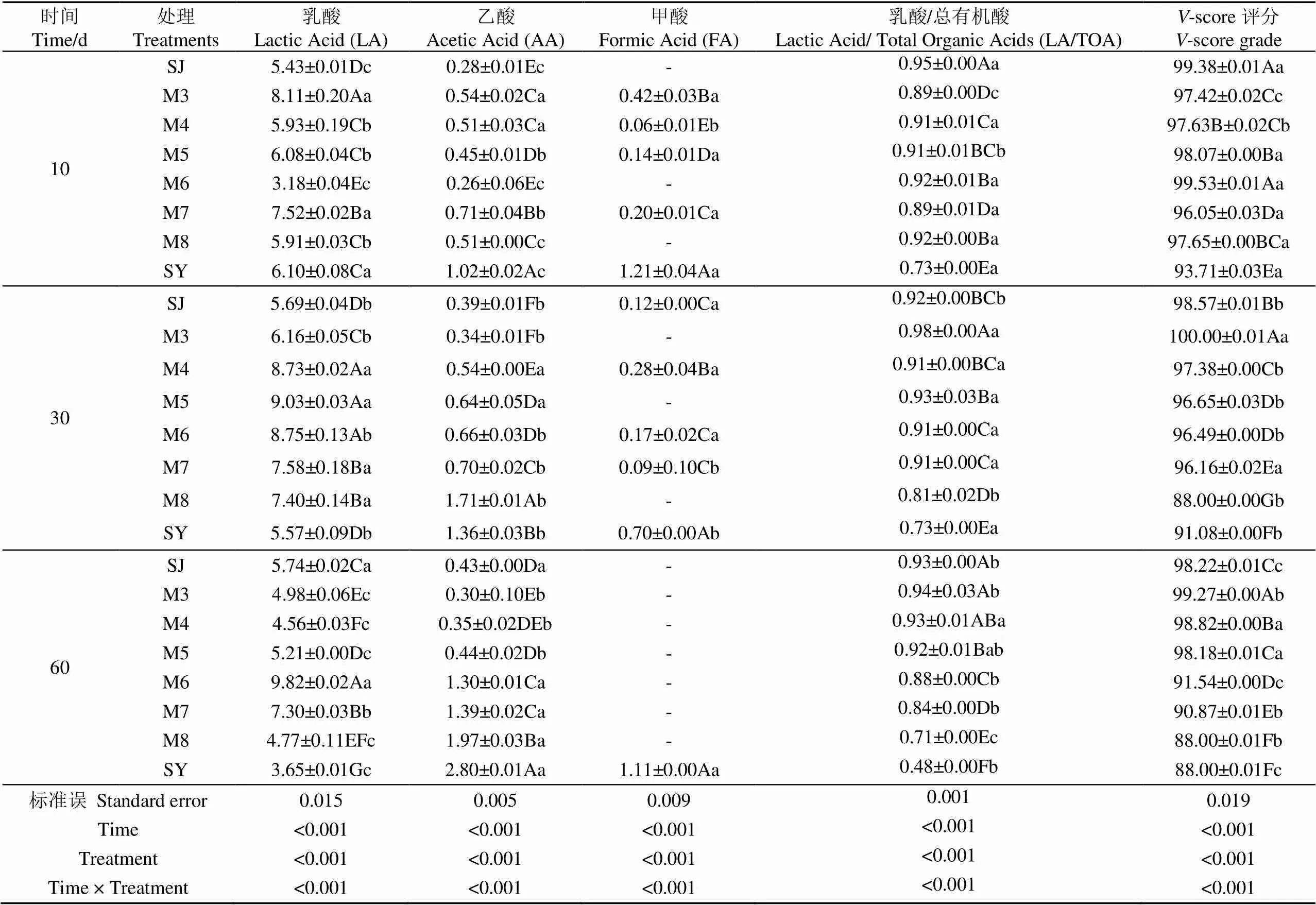
表2 发酵过程中微生物代谢产物的变化
2.4 发酵过程中的微生物菌群分析
2.4.1 Alpha多样性
青贮过程中微生物组成变化与发酵产物的生成和有机组分变化息息相关,特别是优势微生物的种类将直接影响青贮品质。基于Alpha多样性分析的Chao1指数和ACE指数用于表示群落物种的丰富度,其值随着群落物种丰富度的升高而增大;Shannon指数和Simpson指数用于表示群落物种的多样性,Shannon指数随着群落多样性的升高而增大,Simpson指数则与之相反。由表3可知,随着发酵时间的延长,除SJ组(下降)和M5组(先升后降)外,其余6个处理组的Chao1和ACE指数均呈现先下降后升高趋势,发酵期间的细菌群落丰富程度在30 d时最低。另一方面,8个处理组的Shannon指数和Simpson指数变化趋势恰好相反。当菊芋渣比例较低时,Shannon指数呈先降后升趋势,而Simpson指数则呈先升后降趋势;当菊芋渣比例超过一半以上时,Simpson指数呈下降趋势,Shannon指数呈增加趋势。说明当菊芋渣比例较高时,发酵时间愈长细菌群落多样性愈丰富,这与OUT数量变化趋势基本一致。因为提高菊芋渣比例能使发酵体系中的水分和糖分含量有效增加,进而为乳酸菌等有益微生物发酵代谢提供良好营养环境。
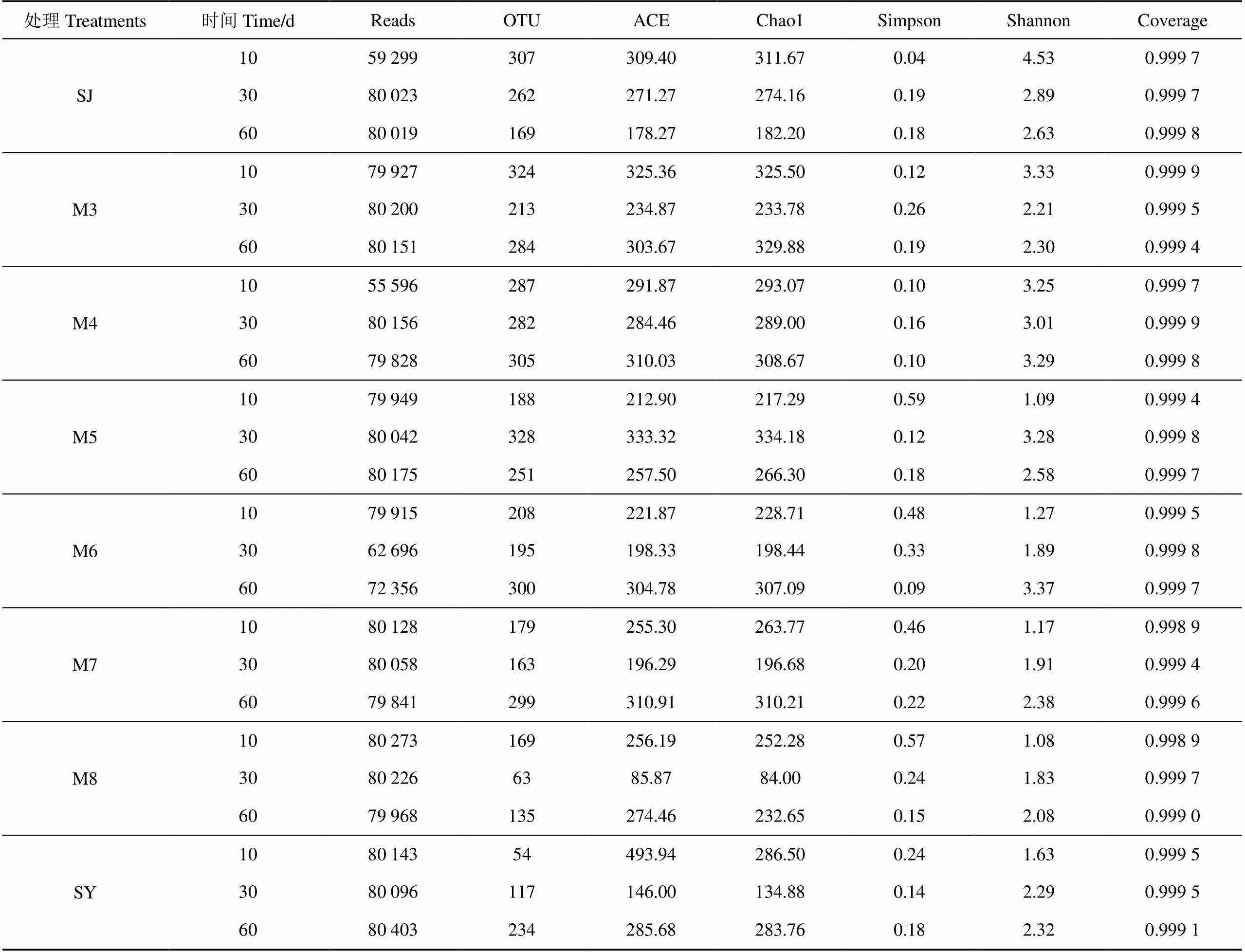
表3 发酵过程中的微生物菌群Alpha多样性
2.4.2 门水平细菌多样性
如图6所示,白酒糟原料的门水平优势细菌为变形菌(,62.41%)和厚壁菌(,19.24%),此外还有少量拟杆菌(,9.30%)、蓝藻细菌(,3.86%)和放线菌(,3.07%)。单独发酵后SJ组的变形菌门丰度从10 d时53.04%降至60 d时9.37%,而厚壁菌门丰度则从10 d 时12.45%上升至60 d 时47.78%。菊芋渣原料的门水平优势细菌主要为厚壁菌(97.84%),单独青贮发酵10 d时仍以厚壁菌为主,但也出现少量变形菌,且随发酵时间延长厚壁菌相对丰度从98.73%(10 d)降至89.35%(60 d),变形菌丰度反而从10 d时0.36%增加至7.29%(30 d)和6.83%(60 d)。
二者混合发酵10 d时演变为以厚壁菌门(>62.07%)为主、含有少量变形菌门(<20.24%)、蓝藻门(<6.77%)和拟杆菌门(<7.59%)的细菌微生态群落结构;发酵30和60 d时仍保持类似菌群结构,且均以厚壁菌门(相对丰度>54.00%)为主,但各门水平细菌的相对丰度随时间变化趋势不尽相同。另一方面,随着菊芋渣比例的增加,混贮发酵体系中的厚壁菌门细菌逐步占据优势主导地位。乔江涛等[32]认为厚壁菌门和变形菌门细菌在厌氧环境中能有效降解纤维类物质,为微生物活动提供更多能量物质,这也是发酵过程中木质纤维组分变化的重要原因之一。
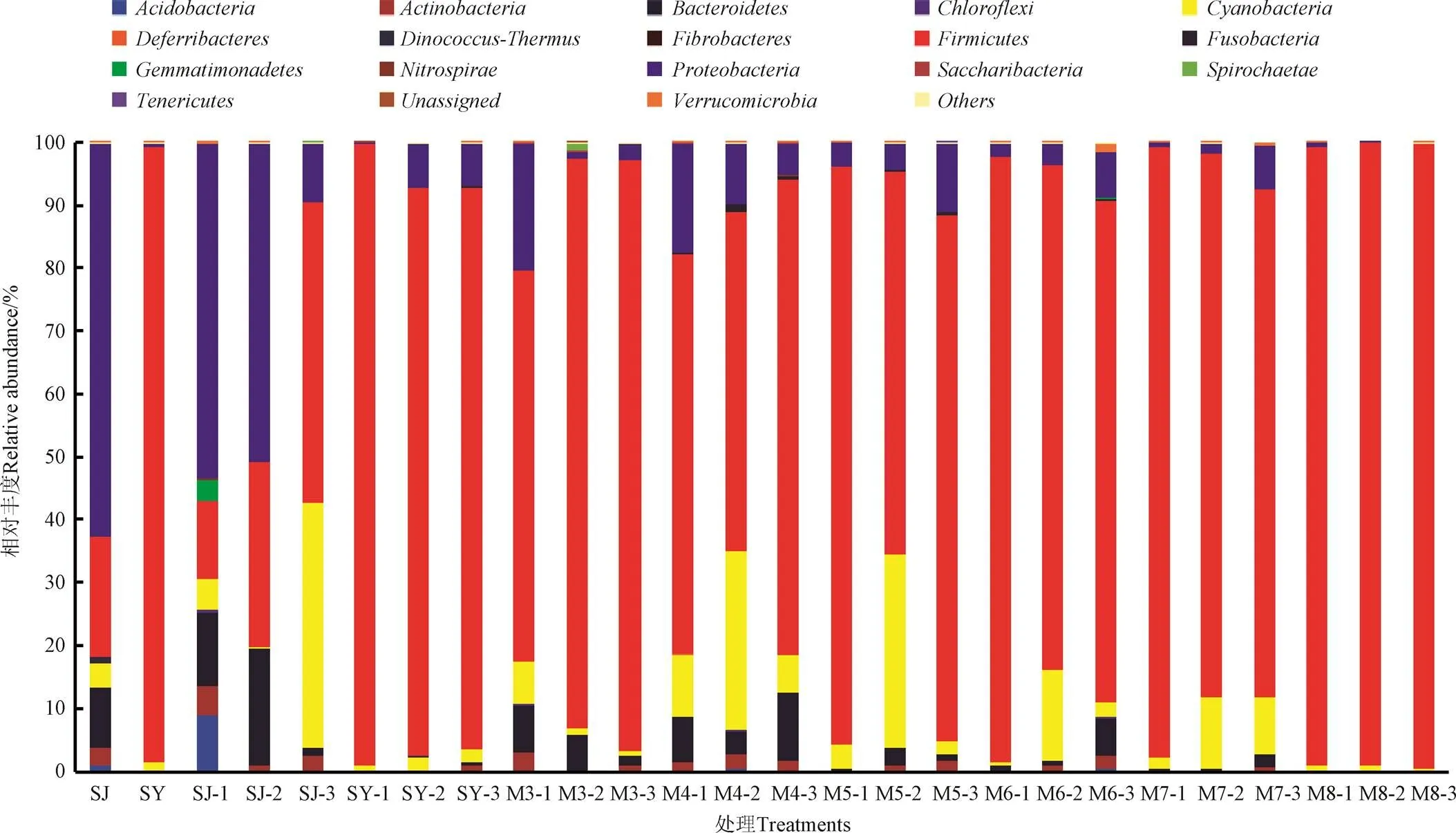
注:SJ、SY及M3~M8的后缀1、2、3分别表示发酵时间为10、30、60 d。下同。
2.4.3 属水平细菌多样性
如图7所示,白酒糟原料附着的乳酸细菌主要有乳杆菌(,11.29%)和少量肠球菌(,0.45%)、链球菌(,0.09%),附着的非乳酸细菌有伯克氏菌(,25.04%)、不动杆菌(,15.45%)、志贺氏菌(,3.12%)等。单独发酵10和30 d时SJ组的属水平优势细菌分别为不动杆菌(18.42%)和志贺氏菌(42.12%),乳杆菌属丰度相对较低,分别为5.53%和0.27%;60d时优势细菌演变为乳杆菌(45.14%)、拟杆菌(,15.66%)、鞘鞍醇单胞菌(,8.09%)、粪杆菌(,7.98%)、柠檬酸杆菌(,5.96%)和乳球菌(,2.44%)等,此时乳酸细菌总丰度达到47.58%以上。菊芋渣原料附着的有益乳杆菌含量丰富,相对丰度高达94.51%。单独青贮(SY组)发酵60 d期间的优势菌属始终以乳杆菌为主,10、30、60 d时的相对丰度分别为98.25%、89.45%和87.52%。
2种原料混合发酵后的属水平优势细菌同样以乳杆菌为主。发酵10 d时,随着菊芋渣比例的增加,6个混合发酵处理组(M3~M8)的乳杆菌相对丰度逐渐升高,说明菊芋渣不仅能为发酵体系提供丰富的营养物质,还能引入关键的有益发酵乳酸菌并为其提供良好生长环境。发酵30 d时M3组中乳杆菌丰度升至86.87%,M4组~M7组的乳杆菌丰度分别为44.47%、41.22%、73.44%、85.21%;当发酵时间延至60 d时,6个混合发酵处理组的乳杆菌丰度仍处于优势地位,相对丰度维持在70.06%~99.44%范围。这与Tohno等[33]报道的青贮有关乳酸菌属主要有乳杆菌、片球菌()、明串珠菌()和肠球菌相一致。另外,混合发酵期间还有少量芽孢杆菌、志贺氏菌、不动杆菌等细菌属(丰度均低于10%),这些腐败细菌不仅会消耗蛋白质等营养物质,还会通过氧化还原反应使青贮料腐败变质[25]。正是由于发酵过程中有益乳酸菌群占据优势主导地位,生成一定量的乳酸从而使pH值快速下降,才使得上述腐败菌被有效抑制,从而更好地保存发酵原料的营养物质。当然,发酵生成的乙酸也具有较强的抑菌作用,这也是青贮腐败菌群较少的重要因素[34]。此外,某些乳酸菌还能生产除乙酸之外的其他抗真菌化合物,这对提高青贮发酵品质和改善青贮有氧稳定性至关重要。
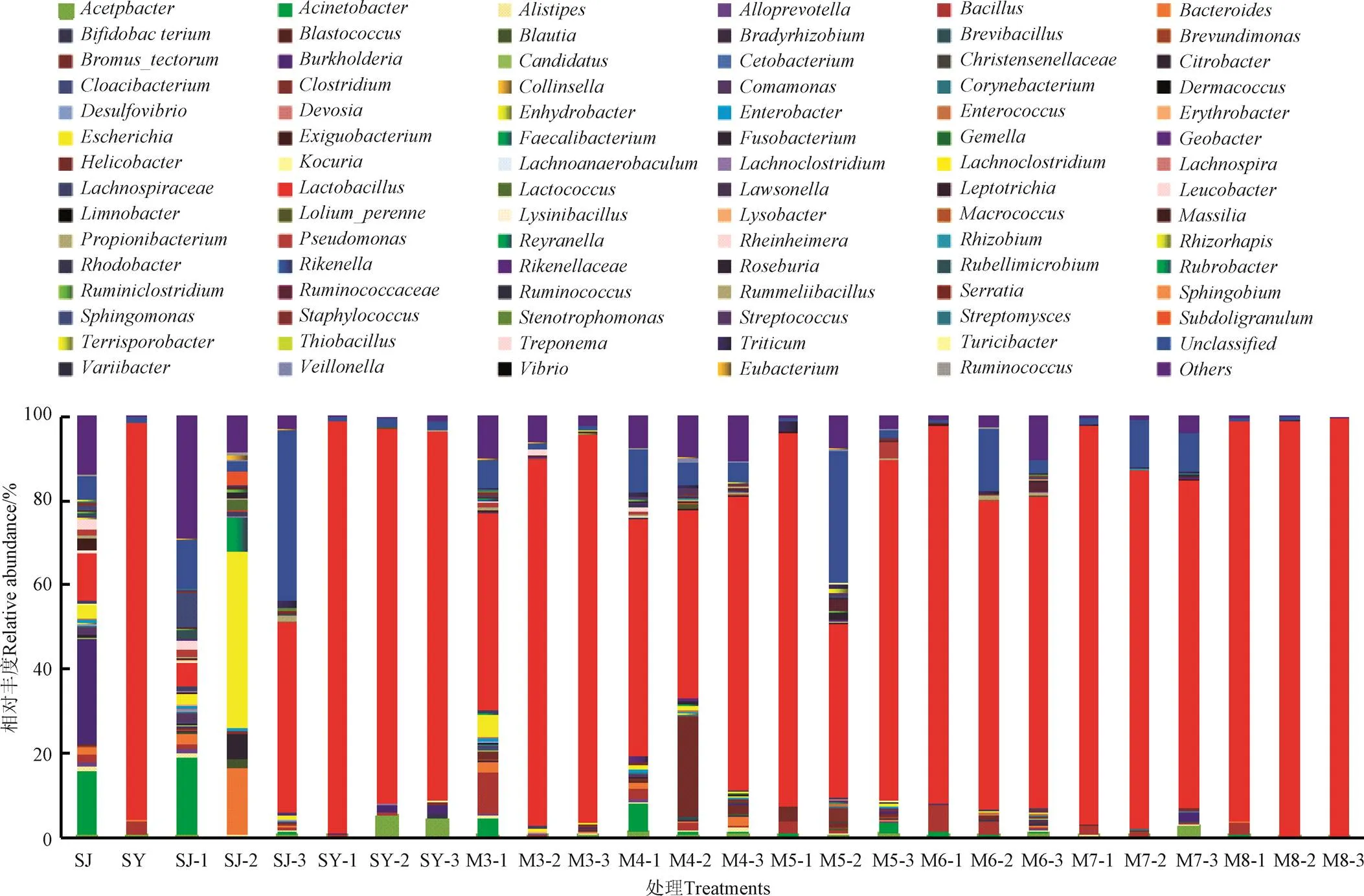
图7 发酵过程中属水平细菌群落组成变化
3 结 论
白酒糟与菊芋渣混合能通过水分和营养组分调节、乳酸菌群互补等方式来优化青贮发酵品质,二者在1.2:1和1:1.5比例条件下的木质纤维组分含量较低,能有效保存可溶性碳水化合物、蛋白质和淀粉等营养物质,实现有机组分的优化重组,进而提高相对饲用价值和生物降解潜力。发酵过程中,以厚壁菌门、乳杆菌属为主的微生物菌群对优良发酵品质和组分重组变化起到关键作用。建议在实际生产过程中,可以将干酒糟和菊芋渣以1.2:1比例混合青贮发酵30 d,既能及时、高效地保存和转化利用糟渣类生物质资源,又能获得低木质素、高含量碳水化合物、高含量乳酸、高生物降解性能的良好青贮品质,为农产品加工副产物的循环利用奠定基础。
[1] Sharma S K, Bansal S, Mangal M, et al. Utilization of food processing by-products as dietary, functional, and novel fiber: A review[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(10): 1647-1661.
[2] Ranathunga S D, Kalscheur K F, Garcia P A D, et al. Fermentation characteristics and feeding value of ensiled wet corn distillers grains in combination with wet beet pulp for lactating dairy cows[J]. The Professional Animal Scientist, 2018, 34(4): 346-355.
[3] Joo Y H, Kim D H, Paradhipta D H V, et al. Effect of microbial inoculants on fermentation quality and aerobic stability of sweet potato vine silage[J]. Asian-Australasian Journal of Animal Sciences,2018, 31(12): 1897-1902.
[4] Bernardes A P, Tremblay G F, Bélanger G, et al. Bagasse silage from sweet pearl millet and sweet sorghum as influenced by harvest dates and delays between biomass chopping and pressing[J]. Bioenergy Research, 2016, 9(1): 88-97.
[5] 贾春旺,原现军,李君风,等. 青稞酒糟对紫花苜蓿和多年生黑麦草混合青贮发酵品质的影响[J]. 南京农业大学学报,2016,39(2):275-280.
Jia Chunwang, Yuan Xianjun, Li Junfeng, et al. Effect of adding wet hulless barley distillers' grains on fermentation quality of mixed ensilage of alfalfa and perennial ryegrass[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 275-280. (in Chinese with English abstract)
[6] 王鸣刚,李梦玉,任海伟,等. 纤维素酶对鲜酒糟青贮饲料营养价值的影响[J]. 酿酒科技,2017(8):116-120,123.
Wang Minggang, Li Mengyu, Ren Haiwei, et al. Effects of cellulase on the nutritive value of silage produced by fresh distillers grains[J]. Liquor-Making Science & Technology, 2017(8):116-120, 123. (in Chinese with English abstract)
[7] 任海伟,邢军梅,刘晓风,等. 菊芋渣的组分分析及其酶解糖化条件研究[J]. 食品工业科技,2016,37(21):139-143.
Ren Haiwei, Xing Junmei, Liu Xiaofeng, et al. Composition analysis and enzymatic hydrolysis saccharification of Jerusalem artichoke residues[J]. Science and Technology of Food Industry, 2016, 37(21): 139-143. (in Chinese with English abstract)
[8] He G Q, Liu T J, Sadiq F A, et al. Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J].Journal of Zhejiang University-Science B (Biomedicine & Biotechnology), 2017, 18(4): 289-302.
[9] 曹荣,刘淇,赵玲,等. 基于高通量测序的牡蛎冷藏过程中微生物群落分析[J]. 农业工程学报,2016,32(20):275-280.
Cao Rong, Liu Qi, Zhao Ling, et al. Microbial flora analysis of oyster during refrigerated storage by high throughput sequencing technology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(20): 275-280. (in Chinese with English abstract)
[10] Wang X H, Zhang Y L, Ren H Y, et al. Comparison of bacterial diversity profiles and microbial safety assessment of salami, Chinese dry-cured sausage and Chinese smoked-cured sausage by high-throughput sequencing[J]. LWT-Food Science and Technology, 2018, 90: 108-115.
[11] 陶莲,刁其玉. 青贮发酵对玉米秸秆品质及菌群构成的影响[J]. 动物营养学报,2016,28(1):198-207.
Tao Lian, Diao Qiyu. Effects of ensiling on quality and bacteria composition of corn stalk[J]. Chinese Journal of Animal Nutrition, 2016, 28(1): 198-207. (in Chinese with English abstract)
[12] 李源,游永亮,赵海明,等. 种植密度对高丹草农艺性状及饲用品质的影响[J]. 草业科学,2017,34(8):1686-1693.
Li Yuan, You Yongliang, Zhao Haiming, et al. Effects of plant density on agronomic traits and forage quality for×[J]. Pratacultural Science, 2017, 34(8): 1686-1693. (in Chinese with English abstract)
[13] Liu Q H, Shao T, Bai Y F. The effect of fibrolytic enzyme,and two food antioxidants on the fermentation quality, alpha tocopherol and beta-carotene of high moisture napier grass silage ensiled at different temperatures[J]. Animal Feed Science and Technology, 2016, 221: 1-11.
[14] Elnaz M, Fakhri S, Seyed A M. 16S ribosomal DNA analysis and characterization of lactic acid bacteria associated[J]. Journal of Food Processing and Preservation, 2017, 41(4): 1-8.
[15] Ni K K, Wang F, Zhu B, et al. Effects of lactic acid bacteria and molasses additives on the microbial community and fermentation quality of soybean silage[J]. Bioresource Technology, 2017, 238: 706-715.
[16] Panks S, Jeong H Y, Kim H S, et al. Enhanced production ofendoinulinase inby using the SUC2-deletion mutation[J]. Enzyme and Microbial Technology, 2001, 29(2): 107-110.
[17] 申瑞瑞,孙晓玉,刘博,等. 不同复合微生物制剂对薯渣与大豆秸秆混贮发酵品质、营养成分及瘤胃降解率的影响[J]. 动物营养学报,2019,31(7):3319-3329.
Shen Ruirui, Sun Xiaoyu, Liu Bo, et al. Effects of different compound microorganism preparations on fermentation quality, nutritional components and rumen degradation rate of mixed silage of potato pulp and soybean straw[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3319-3329. (in Chinese with English abstract)
[18] 许能祥,董臣飞,顾洪如,等.-淀粉酶对不同NSC含量稻草青贮品质的影响[J]. 草业学报,2015,24(11):146-154.
Xu Nengxiang, Dong Chenfei, Gu Hongru, et al. Effect-amylase on fermentation of rice () straw[J]. Acta Prataculturae Sinica, 2015, 24(11): 146-154. (in Chinese with English abstract)
[19] 阴法庭,张凤华. 饲料油菜与玉米秸秆混合青贮营养品质[J]. 草业科学,2018,35(7):1790-1796.
Yin Fating, Zhang Fenghua. Nutritional quality of silage made with different ratios of forage rape and corn stalks[J]. Pratacultural Science, 2018, 35(7): 1790-1796. (in Chinese with English abstract)
[20] 赵金鹏,赵杰,李君风,等. 不同添加剂对水稻秸秆青贮发酵品质和结构性碳水化合物组分的影响[J]. 南京农业大学学报,2019,42(1):152-159.
Zhao Jinpeng, Zhao Jie, Li Junfeng, et al. Effect of different additives on fermentation quality and structural carbohydrates compositions of rice straw silage[J]. Journal of Nanjing Agricultural University, 2019, 42(1): 152-159. (in Chinese with English abstract)
[21] 张亚格,字学娟,李茂,等. 有机酸对柱花草青贮品质和营养成分的影响[J]. 动物营养学报,2016,28(5):1609-1614.
Zhang Yage, Zi Xuejuan, Li Mao, et al. Effects of organic acids on quality and nutrient composition ofSilage[J]. Chinese Journal of Animal Nutrition, 2016, 28(5): 1609-1614. (in Chinese with English abstract)
[22] 刘晶晶,高丽娟,师建芳,等. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果[J]. 农业工程学报,2015,31(9):295-302.
Liu Jingjing, Gao Lijuan, Shi Jianfang, et al. Lactic acid bacteria community andimproving silaging effect of switchgrass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(9): 295-302. (in Chinese with English abstract)
[23] 王旭哲,张凡凡,马春晖,等. 压实度对玉米青贮开窖后营养品质及有氧稳定性的影响[J]. 农业工程学报,2018,34(6):300-306.
Wang Xuzhe, Zhang Fanfan, Ma Chunhui, et al. Effect of compaction on nutritional quality and aerobic stability of silage corn after opening silos[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(6): 300-306. (in Chinese with English abstract)
[24] Desta S T, Yuan X J, Li J F, et al. Ensiling characteristics, structural and nonstructural carbohydrate composition and enzymatic digestibility of apier grass ensiled with additives[J]. Bioresource Technology, 2016, 221: 447-454.
[25] 姜富贵,成海建,刘栋,等. 不同收获期对全株玉米青贮营养价值、发酵品质和瘤胃降解率的影响[J]. 动物营养学报,2019,31(6):2807-2815.
Jiang Fugui, Cheng Haijian, Liu Dong, et al. Effects of different harvest stages on nutritional value, fermentation quality and rumen degradability of whole corn silage[J]. Chinese Journal of Animal Nutrition, 2019, 31(6): 2807-2815. (in Chinese with English abstract)
[26] McDonald P, Henderson A R, Heron S J E. The Biochemistry of Silage (Second Edition) [M]. England: Chalcombe Publications, 1991.
[27] 王旭哲,张凡凡,马春晖,等. 同/异型乳酸菌对青贮玉米开窖后品质及微生物的影响[J]. 农业工程学报,2018,34(10):296-304.
Wang Xuzhe, Zhang Fanfan, Ma Chunhui, et al. Corn silage fermentation quality and microbial populations as influenced by adding homo- and hetero-fermentative bacteria after silos opened[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(10): 296-304. (in Chinese with English abstract)
[28] He Liwen, Wang Cheng, Xing Yaqi, et al. Dynamics of proteolysis, protease activity and bacterial community ofleaves silage and the effects of formic acid and Lactobacillus farciminis[J]. Bioresource Technology, 2019, 294.
[29] Ranathunga S D, Kalscheur K F, Garcia A D, et al. Fermentation characteristics and feeding value of ensiled wet corn distillers grains in combination with wet beet pulp for lactating dairy cows[J]. The Professional Animal Scientist, 2018, 34(4): 346-355.
[30] Mjoun K, Kalscheur F K, Garcia A D. Fermentation characteristics and aerobic stability of wet corn distillers grains with solubles ensiled in combination with whole plant corn[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1336-1340.
[31] Yuan X, Dong Z, Desta S T, et al. Inclusion of wet hulless-barley distillers'grains in mixed silage enhances fermentation and in vitro degradability in Tibet[J]. Grassland Science, 2016, 62(4): 248-256.
[32] 乔江涛,郭荣波,袁宪正,等. 玉米秸秆厌氧降解复合菌系的微生物群落结构[J]. 环境科学,2013,34(4):1531-1539.
Qiao Jiangtao, Guo Rongbo, Yuan Xianzheng, et al. Phylogenetic analysis of methanogenic corn stalk degrading microbial communities[J]. Environmental Science, 2013, 34(4): 1531-1539. (in Chinese with English abstract)
[33] Tohno M, Kitahara M, Irisawa T, et al.. Isolated from orchardgrass silage[J]. International Journal of Systematic & Evolutionary Microbiology, 2013, 63(12): 4613-4618.
[34] Dunière L, Sindou J, Chaucheyras-Durand F, et al. Silage processing and strategies to prevent persistence of undesirable microorganisms[J]. Animal Feed Science and Technology, 2013, 182(1/2/3/4): 1-15.
Ensiling co-fermentation quality and microbial community diversity of grain stiller and inulin processing residue from
Ren Haiwei1,3,4,Wang Li1, Zhu Zhaohua1, Sun Anqi1, Wang Zhiye2, Li Jinping1,3,4, Li Zhizhong1※
(1.730050; 2.730050; 3.730050; 4.730050,)
Large amount of processing waste produced by the food industry is increasing every year, as the rising demands for crop production by growing human population. Currently, most of the waste is usually discarded, only part of which can be utilized to produce value-added products to some extent. The dispose of food processing waste has posed serious management problems on environmental protection. Alternatively, many of these residues with the nutritional value have the great potential to be reused into other production systems, in order to reduce a great loss of valuable materials, from the economic and environmental point of view. Specifically, most food wastes are rich in protein, starch, cellulose, and monosaccharides, mainly fructose and glucose. However, the high moisture content has been identified as a major obstacle to the management of biodegradable food processing waste. It is necessary to develop an upstream storage, and thereby to meet the requirement for a constant supply of utilization for bioenergy and ruminant feed. Ensiling can be an efficient way to preserve biomass with very low fermentation loss, particularly for the cyclic utilization of food processing waste. Using the silage theory, the present study aims to perform the co-ensiling of grain stillage and inulin processing residue from, and thereby to prepare the fermented forage with well-quality. Two by-products were co-fermented with eight mixing ratios of 1:0, 4:1, 2:1, 1.2:1, 1:1.5, 1:2.7, 1:7 and 0:1. The dynamic changes of nutritional components, lignocellulosic components and fermentation characteristics were investigated at 10, 30 and 60 days, respectively. A high throughput sequencing technique was used to analyze the microbial community diversity during ensiling. The results showed that the contents of neutral detergent fiber, acid detergent fiber and acid detergent lignin in silages at the ratio of grain stillage and inulin processing residue for 1.2:1 (M5) and 1:1.5 (M6) were significantly lower than that of other silages (<0.05), accompanied by the higher content of soluble carbohydrates, resulting in the relative superior feed value and biodegradation potential at 60 days. The fermentation characteristics, including pH, the content of ammonium nitrogen and lactic acid in all silages, were in the range of excellent fermentation quality, indicating the excellent-score scores (≥88). During the sole fermentation of grain stillage or inulin processing residue, the dominant bacteria at phylum level wereandThere was a remarkable change of bacterial community after co-ensiling fermentation.phylum and acid-tolerance lactic acid bacteriadominated in the co-silages of grain stillage and inulin processing residue, respectively. Ensiling fermentation can be considered as a competition process between lactic acid bacteria and undesirable microorganisms, whose result can largely determine the silage quality at the different mixing ratios. The fermentation quality at the ratio of 1.2:1 and 1:1.5 for silages at 60 days were excellent, indicating that the grain stillage and inulin processing residue can achieve the high-quality ensiling by the synergistic effect in terms of biochemical characteristics. Considering the utilization and efficiency of biomass, it is suggested that the co-ensiling fermentation of grain stillage and inulin processing residue was performed at the mixed ratio of 1.2:1 for 30 days in the actual production. It infers that the co-ensiling fermentationis an effective approach for food processing waste. The finding can offer new promising possibilities for the solution of environmental pollution that induced by processing waste in food industry.
wastes; fermentation; microbial community; grain stillage;residue
10.11975/j.issn.1002-6819.2020.15.029
TS209
A
1002-6819(2020)-15-0235-10
任海伟,王莉,朱朝华,等. 白酒糟与菊芋渣混合青贮发酵品质及微生物菌群多样性[J]. 农业工程学报,2020,36(15):235-244.doi:10.11975/j.issn.1002-6819.2020.15.029 http://www.tcsae.org
Ren Haiwei,Wang Li, Zhu Zhaohua, et al.Ensiling co-fermentation quality and microbial community diversity of grain stiller and inulin processing residue from[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(15): 235-244. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.15.029 http://www.tcsae.org
2020-04-07
2020-06-16
国家自然科学基金(51666010,51366009);中国博士后科学基金(2018M631217,2019T120961);甘肃省自然科学基金(18JR3RA150);兰州理工大学红柳杰出青年人才支持计划(JQ2020)和一流学科计划(0807J1)
任海伟,博士,副教授,研究方向:食品加工副产物利用。Email:rhw52571119@163.com
李志忠,教授,研究方向为食品生物化学。Email:zzli2004@lut.cn
中国农业工程学会高级会员:会员号(E041200735S)

