牛冷冻精液保存时间对精液品质及其受精能力的影响
崔艳颖,史秀杰,张美佳,杨 健,武占营,郝肖琼,*
(1.包头医学院生理学教研室,内蒙古包头 014040;2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518026;3.中国农业大学农业生物技术国家重点实验室,北京 100193)
精液冷冻保存技术对猪和牛等优良家畜的快速繁殖以及濒危动物的拯救具有重大实践意义,准确而客观地评价精子受精能力可使优良精子资源得到充分利用。精液质量的评价指标主要包括精子的直线运动状态、活率、质膜完整性、顶体完整率等[1],精子的运动状态可利用计算机辅助精子分析仪 (CASA) 来分析[2],该方法准确客观,但有些精子虽具有良好的运动能力,却无受精能力[3]。研究认为,精液冷冻-冻融过程中精子质膜最易受损,同时精子DNA 也会受到影响[4],这些都会导致精子的受精能力下降[5],因此,精子DNA 损伤程度也是评价精液品质的一个指标[6-7]。精子线粒体是维持精子活力的关键细胞器[8-10],精子直线运动能力和线粒体活性密切相关;线粒体膜通道孔的开放能够显著改变线粒体的通透性[11],也是评价精液品质的依据。此外,线粒体耗氧量也是检测精子线粒体功能的一个指标[12-13]。
冷冻精液不同保存时间会导致精子受精能力不同,本实验旨在检测不同保存时间的牛冻精的精子活力、DNA 完整性和线粒体功能等并分析功能指标与受精能力的相关性,为建立既快速又能准确反映牛冻精受精能力的方法、评价牛冷冻精液受精能力奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 冷冻精液来源 3 批荷斯坦奶牛冷冻精液分别为A 冻精(2018 年冷冻,保存1 年)、B 冻精(2016 年冷冻,保存3 年)和C 冻精(2006 年冷冻,保存13 年),均来自于北京奶牛中心。每批鲜精都来自4 头种公牛,采用相同的冷冻方法冷冻,液氮保存。精液在冷冻前后均进行各项指标检测,3 批精液精子活力、活率、直线运动状态、顶体染色率等指标在鲜精或者冻精间没有差异。
1.1.2 实验试剂及仪器 实验所用试剂均购自Sigma 公司,培养液购自Gibco 公司,通用型DNA 损伤彗星检测试剂盒、MTT 比色法细胞繁殖定量检测试剂盒、活体细胞线粒体膜通道孔(MPTP)荧光检测试剂盒、活体细胞线粒体内膜功能(膜电位)荧光测定试剂盒、精子活力和顶体反应三色染色试剂盒、呼吸链依赖性纯化线粒体氧化应激活性氧荧光测定试剂盒购自上海杰美基因。正置光学显微镜(Olympus,日本);荧光显微镜(Leica,德国);二氧化碳培养箱(Thermo Fisher Scientific,美国);伟力精子分析仪WLJY-9000(北京伟力新世纪科技发展有限公司,中国);电热恒温水浴箱(精宏 KD-S24,中国)。
1.2 实验方法
1.2.1 精子运动状态检测 利用伟力精子分析仪检测3批牛冷冻精液的精子活力、运动前向行、直线运动速度、曲线运动速度、直线性、摆动性、和鞭打频率。
1.2.2 精子顶体完整率测定 按照精子活力和顶体反应三色染色试剂盒说明书操作,光学显微镜观察并计数(每个视野计数200 个精子)。其中,着粉红色为顶体完整精子,顶体未着色为顶体不完整精子(顶体内含物丢失,故未着色)。
1.2.3 精子活率检测 精子胞膜具有选择透过性,活精子的胞膜完整,台盼蓝拒染;而丧失活性或细胞膜不完整的精子细胞丧失选择透过性,可被台盼蓝染成蓝色。利用台盼蓝染色后统计拒染精子所占精子的百分比,光学显微镜观察精子染色情况。
1.2.4 线粒体功能检测 按照活体细胞线粒体膜通道孔荧光检测试剂盒说明书操作检测精子细胞线粒体膜通道孔(MPTP),线粒体膜通道孔相对荧光单位(RFU)值降低,表明膜通道孔活性增强。利用MTT 比色法细胞繁殖定量检测试剂盒检测精子线粒体活性,吸光值与细胞量呈线性正相关,能够反映线粒体活性。利用活体细胞线粒体内膜功能(膜电位)荧光测定试剂盒检测精子线粒体膜电位(MMP)。利用呼吸链依赖性纯化线粒体氧化应激活性氧荧光测定试剂盒检测线粒体氧化应激活性氧(ROS)。
1.2.5 精子DNA 完整性检测 利用通用型DNA 损伤彗星检测试剂盒检测精子DNA 完整性,DNA 损伤后其DNA 碎片拖尾,形成典型的“彗星”图像,根据迁移长度和荧光强度即可定量分析DNA 损伤的程度。在荧光显微镜下观察并拍照记录。
1.2.6 牛冷冻精液的受精能力检测 牛卵母细胞培养:牛卵巢采自河北省屠宰场,保存于28~30℃生理盐水,2 h 内运至实验室,用含有青、链霉素的37℃生理盐水洗涤卵巢3 次,采用真空泵和18 号针头抽取直径为2~6 mm 卵泡中的卵泡液,显微镜下挑选包含3 层及3 层以上卵丘细胞且胞质均匀的卵丘卵母细胞复合体(COCs),放入四孔板(每孔50 枚),置于38.5℃、5% CO2、饱和湿度的培养箱中培养22~24 h;体外成熟培养液包含TCM-199、0.01 IU/mL 促卵泡素(FSH)、10 IU/mL 促黄体生成素(LH)、1 μg/mL 雌二醇(E2)。体外受精(IVF)操作:成熟后的COCs 去除外周部分卵丘细胞,放于50 μL 的受精液滴中,每滴放入15~20枚 COCs,将精子和卵母细胞在38.5℃、5% CO2、饱和湿度的培养箱中共孵育8~16 h;受精液:112.0 mmol/L NaCl、4.02 mmol/L KCl、2.25 mmol/L CaCl2•2H2O、0.52 mmol/L MgCl2•6H2O、0.83 mmol/L KH2PO3、37.0 mmol/L NaHCO3、1.25 mmol/L 丙酮酸钠、10 μg/mL Heparin、4 mg/mL BSA、10 mmol/L 咖啡因、双抗(100 U/mL 青霉素+100 μg/mL 链霉素)。体外胚胎培养:利用玻璃针去除体外受精后8~16 h 受精卵外周卵丘细胞,将受精卵在前期胚胎培养液中洗3 遍,放入38.5℃、5% CO2、饱和湿度的培养箱中培养48 h 后换入后期胚胎培养液,此后每隔48 h 进行半量换液,并在2 d 和7 d 分别统计早期胚胎的卵裂率和囊胚率(囊胚率的统计以卵裂数为总数)。
1.2.7 基因表达分析 复苏3 批冷冻精液之后,总RNA提取依照RNeasy micro-RNA isolation kit(Qiagen,美国)操作指南进行,反转依照QuantiTek(Qiagen,美国)反转录体系进行,得到cDNA,Real-time PCR 方法检测目的基因精子线粒体相关半胱氨酸富集蛋白(SMCP)、不溶性弹性蛋白3(TEKT3)、轴丝动力蛋白1 (DNAH1)及T 复合体相关睾丸表达3(TCTE3)的相对表达量。相关引物序列见表1。
1.2.8 统计分析 所有实验均重复3 次。用Sigma plot 13.0 软件进行统计学分析,数据类型采用方差分析(ANOVA)和t检验,结果以平均值±标准误差表示,P<0.05 为有显著性差异。

表1 引物序列
2 结果
2.1 不同冷冻时间对牛精子运动状态的影响 如表2 显示,随冷冻时间延长,精子活力和运动直线性均显著下降。
2.2 不同冷冻时间对牛精子活率的影响 如图1 所示,A 精液的精子活率(91%)显著高于B(67%)、C 精液(59.67%)。
2.3 不同冷冻时间对牛精子顶体完整率的影响 如图2 所示,A、B、C 3 批冻精的精子顶体完整率分别为98.13%、94.36%、88.28%,均高于国家标准 (标准≥82%)。
2.4 牛冷冻解冻精液体外受精能力检测 如图3 所示,A、B 和C 3 批冷冻精液的卵裂率分别为70.77%、62.89%、51.90%;囊胚率分别为30.47%、25.14%、16.43%。说明随冷冻保存时间延长,精液的受精能力显著下降。
2.5 精子线粒体功能分析 如图4 所示,线粒体膜通道孔的结果显示,A 精液RFU 值最高,B 精液次之,C 精液RFU 值最低(P<0.05),表明A 精液线粒体的膜通道孔活性最高;线粒体膜电位结果显示,A 精液最好;MTT 法间接测定精子线粒体活性的实验结果显示,A精液的光密度(Optical Density,OD)值最高(P<0.05),表明精液质量最好;线粒体氧化应激活性氧的测定显示,A 精液ROS 最低(P<0.05)。
2.6 冷冻精液DNA 损伤检测 如图5 所示,A 精液拖尾最短(P<0.05),B 精液其次,C 精液拖尾最长(P<0.05),表明A 精液精子的DNA 碎片最少,DNA 损伤最轻,而C 精液精子的DNA 碎片最多,DNA 损伤程度最严重。
2.7 不同保存时间对弱精子症相关蛋白基因表达水平的影响 如图6 所示,4 种基因的表达趋势未显现出如IVF 实验结果相一致的趋势,表达差异不显著。
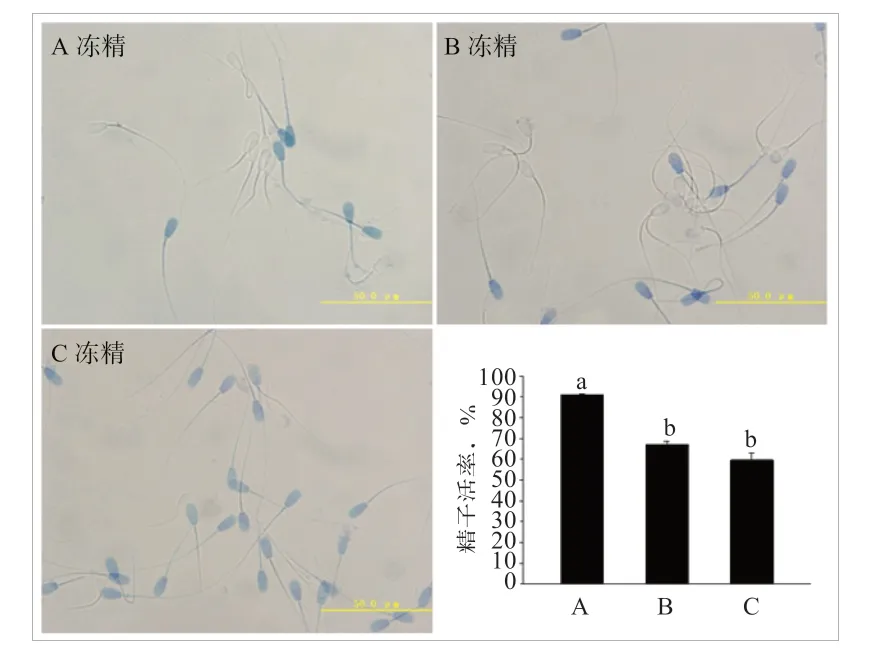
图1 牛冻精解冻后精子台盼蓝染色

图2 牛冻精解冻后精子顶体完整率
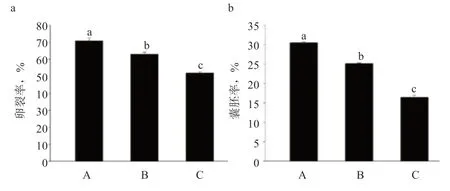
图3 不同保存时间牛冷冻精液的IVF 后期胚胎发育情况

表2 不同冷冻时间对牛精子运动状态的影响

图4 不同保存时间牛冷冻精液精子线粒体功能分析

图5 不同保存时间牛冷冻精液精子DNA 损伤测定

图6 不同保存时间对牛冷冻精液弱精子症相关基因表达的影响
3 讨 论
精液冷冻保存技术对于大型哺乳动物的人工繁育至关重要。本研究对不同冷冻时间的3 批荷斯坦奶牛精液进行了检测,由于冷冻时间跨度较长(1 年、3 年及13 年),没有使用同一批冷冻的精液,但精液来源于同一品种公牛,3 批精液精子活力、活率、直线运动状态、顶体染色率等指标在鲜精或者冻精间没有差异。本实验中,不同时期的牛可能稍有影响,但影响精子功能的主要是冷冻保存时间。
精子的活率、活力是影响精子受精能力的重要因素[6]。本研究中冻精的精子活力和活率在保存3 年后显著下降,但继续保存至13 年,下降不明显,说明精子活率和活力主要在冷冻保存早期下降,短期冷冻对其影响较小,超过3 年后,精子活率及活力不再显著下降。精子的直线运动状态与母牛的受孕率关系密切。冷冻保存1年的精子直线运动性最高,保存3 年后,下降不明显,而保存13 年后精子的直线运动性显著下降,结果表明短时间的冷冻保存主要使精子的活力和活率下降,而长时间的冷冻主要使精子的直线运动性下降,导致受精能力下降。哺乳动物顶体的顶体反应是受精过程中的一个重要环节,冷冻精液中精子顶体的完整率是衡量精液品质的一个重要指标[14]。本研究表明,冷冻时间的延长对精子顶体完整率影响不明显。
体外受精能力最能真实、客观、准确地反映精液品质[6]。本研究结果表明,冷冻保存1 年的牛精液的卵裂率和囊胚发育率与以前报道的牛冷冻精液的受精率结果相似[15-16],然而,冷冻保存3 年的精液受精率和囊胚发育率明显下降,冷冻保存13 年的精液囊胚发育率进一步下降,这表明冷冻精液保存1 年对受精率影响不大,但随着冷冻保存的时间延长,精子的受精能力会显著下降。
精子线粒体是精子运动的能量来源,因此线粒体功能状态是影响精子受精能力的一个重要因素。线粒体活性、MMP 及MPTP 结果均表明,冻存将对牛精液精子线粒体功能造成严重损伤,这与之前关于绵羊精液精子线粒体的报道相一致[17],且冻存时间越长,线粒体功能受损程度越严重,这可能是由于细胞凋亡或坏死时,线粒体内容物通过膜通道孔释放到胞浆中,膜通道孔开放,显著增加了线粒体的通透性[12]。本实验结果发现,3 批精液精子的DNA 均有碎片,表明牛精子冷冻会增加核DNA 碎片,这与冷冻对人类精子核DNA 造成损伤的研究结果相一致[18-19];冻存1 年的精子的DNA 碎片较少,冷冻保存3 年后 DNA 碎片极显著增加,冷冻保存13 年的精子DNA 碎片进一步增加,这些结果表明精液冷冻导致线粒体膜通道孔通透性和DNA 损伤的变化幅度最大,可能是导致精子受精能力下降的内在因素。
3 批牛冷冻精液精子中弱精子症相关基因的表达并无明显变化,可能是冷冻保存并不会导致遗传异常,而弱精症相关基因的表达主要受遗传物质影响,这与郭靓等[20]研究海福特公牛冻精保存35年并未发现遗传异常相一致。
4 结 论
本实验结果显示,随着冷冻时间的延长,精子的活力、直线性、活率、线粒体活性、MPTP、受精能力、DNA 完整性等指标均下降,其中MPTP 和DNA 完整性指标变化幅度最大,可作为判断牛冷冻精液受精能力的参考指标。

