丁苯酞软胶囊联合脑蛋白水解物对急性脑梗死患者NIHSS评分及Keap1-Nrf2/ARE信号传导通路的影响
张立攀, 朱云亮
(济宁医学院附属医院, 山东 济宁 272029)
急性脑梗死(Acute cerebral infarction,ACI)为临床常见卒中类型,约占全部脑卒中60%~80%,且近年来,随着我国人口结构改变,该病发病率逐年增长,受到临床高度关注[1,2]。ACI后极易出现缺血性脑组织损伤,研究认为以核因子-E2相关因子2(Nrf2)为核心的Keap1-Nrf2/ARE信号转导通路具有抗氧化应激、抗炎症损伤、减轻钙离子超载、抗细胞凋亡等多重作用,在维持脑组织细胞内氧化还原平衡状态方面具有重要意义[3]。脑蛋白水解物作为脑血管辅助药物,对ACI血小板活化抑制作用显著,可缓解炎症反应,减轻脑损伤,促进神经功能修复[4]。丁苯酞软胶囊可阻断ACI所致多个病理环节,维持脑缺血状态下脑能量代谢、促进缺血区域脑血流量恢复,减少神经细胞凋亡,改善神经功能缺损症状[5]。本研究首次联合采用丁苯酞软胶囊、脑蛋白水解物治疗ACI,分析其对患者神经功能(NIHSS)评分及Keap1-Nrf2/ARE信号传导通路的影响。
1 资料与方法
1.1临床资料:选取2016年8月至2019年7月我院93例ACI患者作为研究对象,纳入标准:①符合依据《中国急性缺血性脑卒中诊治指南2014》中ACI相关诊断标准[6],并经头颅CT或MRI证实;②发病至入院时间<72h;③患者或其家属自愿签署本研究知情同意书;④本研究经我院医学伦理委员会审核批准;排除标准:①伴有出血性倾向疾病者;②合并心、肝、肾等重要脏器功能障碍;③伴有免疫系统或血液系统疾病者;④发病前两周内行重大手术者;⑤合并恶性肿瘤者;⑥过敏体质或对本研究所用药物具有使用禁忌症者。简单随机化分组,各31例。三组年龄、性别、发病时间、梗死部位、病情程度、合并症等基线资料无明显差异(P>0.05),见表1。

表1 三组临床资料对比
1.2方 法
1.2.1治疗方法:三组均根据《中国急性缺血性脑卒中诊治指南2014》制定常规治疗方案,包括稳定生命体征、控制血压血糖、吸氧、纠正水电解质平衡等基础治疗,同时根据患者病情程度予以抗血小板聚集、改善脑功能、改善脑循环等药物治疗;于此基础上,对照A组予以脑蛋白水解物(北京赛生药业有限公司,国药准字H11022185)治疗,20mL脑蛋白水解物+250mL生理盐水,静脉滴注,60~120min滴完,1次/d;对照B组予以丁苯酞软胶囊(石药集团恩必普药业有限公司,国药准字H20050299)治疗,200mg/次,3次/d;观察组予以蛋白质水解物联合丁苯酞软胶囊治疗,脑蛋白水解物、丁苯酞软胶囊用法用量同对照A、B组。三组均连续治疗14d。
1.2.2检测方法:空腹状态下抽取5mL肘静脉血,高速离心处理(3000r/min,10min),留取血清待检,采用酶联免疫吸附法测定脂联素(APN)、血管性假血友病因子(vWF)、白介素(IL)-8、IL-19、肿瘤坏死因子(TNF)-α,比色法测定血清超氧化物歧化酶(SOD)、丙二醛(MDA),试剂盒购自南京建成生物科技有限公司,严格按照试剂盒操作说明书进行;同时抽取外周血5mL采用免疫印迹法测定Keap1-Nrf2/ARE信号传导通路相关蛋白表达,肝素抗凝后,分离出外周血淋巴细胞,提取PBMC,采用1640培养液洗涤2次,经重悬后收集至PBMC,加入细胞裂解液裂解,离心收集上层清夜取得总蛋白,BCA法测定并配平蛋白浓度,电转移法转移相应蛋白至PVDF膜上,以5%脱脂牛奶封闭液室温下封闭2h,加入一抗4℃孵育过夜,次日TBST洗涤10min,共3次,加入经荧光标记的羊抗兔二抗孵育1h后洗膜,TBST洗涤10min,共3次,ECL发光显影,采用QuantityOne软件测定灰度值,计算蛋白条带灰度值与内条带灰度值比值表示目的蛋白相对表达水平。
1.3观察指标:①临床疗效,参考《中国急性缺血性脑卒中诊治指南2014》判断患者治疗后疗效,基本控制:NIHSS评分下降>90%,病残程度为0级;显效:NIHSS评分下降46%~90%,病残程度为1~3级;有效:NIHSS评分下降18%~45%;无效:NIHSS评分降低≤17或增加。总有效率=(基本控制+显效+有效)/31×100%。②治疗前、疗程结束后神经功能及日常生活活动能力,以美国国立卫生研究院卒中量表(NIHSS)评分评估神经功能,分值越低,神经功能恢复越良好[7];Barthel指数评估日常生活活动能力,分值越高,日常生活活动能力越强。③治疗前、疗程结束后内皮功能指标APN、vWF水平。④治疗前、疗程结束后氧化应激指标SOD、MDA水平。⑤治疗前、疗程结束后血清炎性因子IL-19、IL-8、TNF-α水平。⑥治疗前、疗程结束后Keap1-Nrf2/ARE信号传导通路相关蛋白表达。

2 结 果
2.1临床疗效:观察组临床总有效率高于对照A、B组,差异有统计学意义(P<0.05),对照A、B组临床总有效率相比,无明显差异(P>0.0167),见表2。
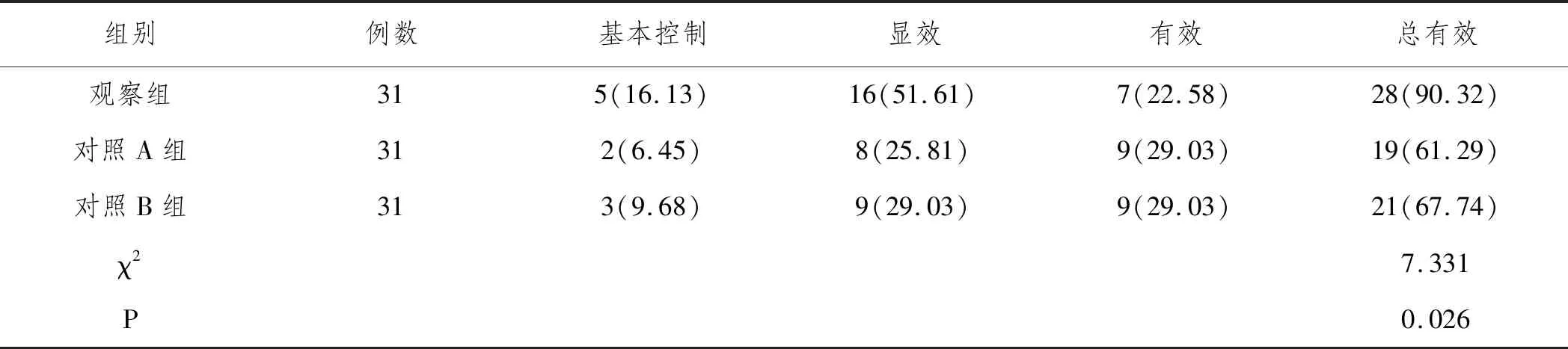
表2 三组临床疗效对比n(%)
2.2NIHSS评分、Barthel指数:三组NIHSS评分、Barthel指数组间、不同时间点的差异及组间·不同时间点交互作用均数有统计学意义(F1=12.314,F2=26.124,F3=19.052,F4=9.126,F5=25.134,F6=16.247,P<0.05),三组治疗前NIHSS评分、Barthel指数相比,无明显差异(P>0.05);疗程结束后,观察组NIHSS评分低于对照A、B组,Barthel指数高于对照A、B组(P<0.05),见表3。

表3 三组NIHSS评分 Barthel指数对比分)
2.3内皮功能指标:三组APN、vWF水平组间、不同时间点差异及组间·不同时间点交互作用均有统计学意义(F1=10.125,F2=24.129,F3=19.742,F4=9.256,F5=25.175,F6=16.167,P<0.05),三组治疗前血清APN、vWF水平相比,无明显差异(P>0.05);疗程结束后,观察组血清vWF水平低于对照A、B组,APN水平高于对照A、B组(P<0.05)(P<0.05),见表4。
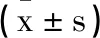
表4 三组内皮功能指标水平对比
2.4血清SOD、MDA水平:三组SOD、MDA水平组间、不同时间点差异及组间·不同时间点交互均有统计学意义(F1=9.745,F2=15.169,F3=13.256,F4=10.129,F5=27.141,F6=13.196,P<0.05),三组治疗前血清MDA、SOD水平相比,无明显差异(P>0.05);疗程结束后,观察组血清MDA水平低于对照A、B组,SOD水平高于对照A、B组(P<0.05),见表5。
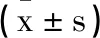
表5 三组血清SOD MDA水平对比
2.5血清炎性因子:三组IL-19、IL-8、TNF-α水平组间、不同时间点差异及组间·不同时间点交互均有统计学意义(F1=8.941,F2=16.174,F3=12.185,F4=11.254,F5=27.276,F6=14.251,F7=9.845,F8=24.312,F9=12.141,P<0.05),三组治疗前血清IL-19、IL-8、TNF-α水平相比,无明显差异(P>0.05);疗程结束后,观察组血清IL-19、IL-8、TNF-α水平低于对照A、B组(P<0.05)(P<0.05),见表6。
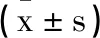
表6 三组血清炎性因子对比
2.6Keap1-Nrf2/ARE信号传导通路相关蛋白:三组Keap1、NQO1、ARE、Nrf2表达水平组间、不同时间点差异及组间·不同时间点交互均有统计学意义(F1=8.172,F2=17.254,F3=14.135,F4=10.944,F5=25.126,F6=12.361,F7=8.125,F8=25.612,F9=15.141,F10=9.265,F11=24.756,F12=10.695,P<0.05),三组治疗前Keap1、NQO1、ARE、Nrf2表达水平相比,无明显差异(P>0.05);疗程结束后,观察组Keap1表达水平低于对照A、B组,NQO1、ARE、Nrf2表达水平高于对照A、B组(P<0.05),见表7。
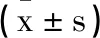
表7 三组Keap1-Nrf2/ARE信号传导通路相关蛋白对比
3 讨 论
ACI治疗原则为抑制血栓扩展,缩小梗死范围,尽快恢复缺血区域脑灌注,同时改善脑微循环,保护脑细胞,减轻缺血后再灌注损伤,防治脑细胞凋亡[8]。丁苯酞软胶囊、脑蛋白水解物为脑血管疾病治疗常用药物,目前临床多单一采用二者治疗ACI,关于其联合应用较为鲜见。本研究为进一步提高治疗效果,联合采用丁苯酞软胶囊、脑蛋白水解物治疗ACI,结果显示疗程结束后,观察组NIHSS评分低于对照A、B组,Barthel指数高于对照A、B组,临床疗效优于对照A、B组,充分说明丁苯酞软胶囊联合脑蛋白水解物治疗ACI,可显著改善患者神经功能及日常生活活动能力,提高治疗效果。此外,动脉硬化及血管内皮损伤的病理过程影响患者血清APN、vWF水平,血清APN、vWF水平可作为反映ACI患者脑血管受损程度及内皮功能[9]。本研究中,疗程结束后,观察组血清vWF水平低于对照A、B组,APN水平高于对照A、B组,提示丁苯酞软胶囊联合脑蛋白水解物可显著改善患者血清APN、vWF水平,亦从血清层面进一步证实丁苯酞软胶囊联合脑蛋白水解物治疗效果。原因在于①丁苯酞软胶囊通过抑制谷氨酸释放,解除微血管痉挛,抑制血小板聚集;保护血管内皮、加速血管生成,促进侧支循环建立;减少线粒体电子传递链细胞色素C释放,抑制神经元凋亡;保护线粒体功能,避免线粒体酶自我损伤,改善脑缺血再灌注引起的线粒体肿胀与功能异常;抑制氧化酶激活,防止脂质过氧化,发挥对缺血性神经元损伤的保护作用;②脑蛋白水解物可增加脑组织对氧利用率;增加脑组织无氧代谢时三磷酸腺苷生成;钠离子拮抗,抑制钙离子内流,降低氧自由基生成;调节脑内抑制性、兴奋性物质平衡及有关激素生成,促进神经功能恢复;③丁苯酞软胶囊、脑蛋白水解物作用机制不同,联合应用,作用协同补充,进一步提高治疗效果。
ACI后随局部侧支循环开放,受损脑组织缺血再灌注,致使大量自由基释放,导致脑细胞膜脂质过氧化,产生微循环障碍及破坏脑细胞结构,为造成脑功能障碍的主要因素之一[10]。MDA为脂质过氧化反应中的代谢产物,可间接反应体内自由基水平,代表细胞受自由基损伤涉及脂质过氧化反应的程度;SOD作为体内自由基清除剂,可抑制氧自由基损伤脑细胞,减少缺血再灌注时脑组织过氧化产物生成,增加大脑皮层耐缺氧能力。此外,Keap1-Nrf2/ARE信号传导通路作为一种氧化应激信号通路,在急性脑缺血后再灌注损伤中的作用可能是通过激活下游因子表达而发挥抗炎、抗氧化应激、抗凋亡等作用。本研究中,疗程结束后,观察组血清MDA、IL-19、IL-8、TNF-α、Keap1水平低于对照A、B组,SOD、NQO1、ARE、Nrf2水平高于对照A、B组,提示丁苯酞软胶囊联合脑蛋白水解物ACI,可降低患者血清MDA、IL-19、IL-8、TNF-α水平,提高SOD水平,调节Keap1-Nrf2/ARE信号传导通路,从而达到抑制氧化应激反应目的。原因在于丁苯酞软胶囊可加强自由基清除,抑制自由基产生,减少脑组织损伤后组织内有害物质增加,降低炎性反应,维护脑组织营养代谢;脑蛋白水解物具有钙离子拮抗作用,可有效抑制钙离子内流,减少氧自由基生成,抑制氧化应激反应,减轻ACI继发性炎症反应,二者联合应用,可增强抗氧化应激能力,抑制炎性反应。
综上所述,丁苯酞软胶囊联合脑蛋白水解物治疗ACI,可明显改善患者血管内皮功能,抑制氧化应激反应及炎症反应,调节Keap1-Nrf2/ARE信号传导通路相关蛋白,改善神经功能及日常生活活动能力,效果较为显著。但本研究样本量较小,还需临床多中心、多渠道取样,作进一步证实。

