金荞麦提取物对膝骨关节炎模型大鼠氧自由基的影响
潘朝旺,杨家林,辑丹菊,万进军
(鄂州职业大学 医学院,湖北 鄂州436099)
骨关节炎(osteoarthritis,OA)是在力学和生物学等因素的共同作用下,软骨组织正常分解和合成代谢失衡,导致软骨细胞死亡、基质降解、软骨组织破坏的一种系统性疾病,目前其确切病因仍不明确,近年来研究提示OA的发生发展与氧自由基关系密切[1-2],发生在膝关节的骨关节炎称为膝骨关节炎。本课题组之前在金荞麦对膝骨关节炎兔作用的研究中,提示其对膝骨关节炎兔关节软骨有保护作用[3],为了进一步探讨其对骨关节炎的作用,本研究拟通过观察金荞麦提取物对膝骨关节炎模型大鼠血清、关节液及关节软骨超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化脂质(LPO)的影响,探讨其治疗膝骨关节炎作用。
1 材料
1.1 动物
SD大鼠60只,清洁级,体重200±20g,购自成都达硕实验动物研究中心,许可证号:SCXK(川2013-24)。
1.2 药物与试剂
金荞麦提取物(每g相当于原药材20g),购自西安草翠芯生物科技有限公司;抗骨增生胶囊,江苏康缘药业股份有限公司。SOD、MDA、LPO ELISA试剂盒,购自上海拜力生物科技有限公司。木瓜蛋白酶,购自西安正东生物科技有限公司。
1.3 仪器
9602A酶标仪,南京普朗医用设备有限公司;UV754紫外可见分光光度计,上海佑科仪器仪表有限公司;台式冷冻离心机,上海安亭科学仪器公司;Z160M微量高速离心机,德国HERMLE。
2 方法
2.1 动物造模及分组给药
取大鼠60只,随机挑选10只作为正常组,其余50只参照文献[4]制备骨关节炎模型:分别在第1、4、7天于大鼠双侧后肢膝关节腔内注射4%木瓜蛋白酶溶液0.2mL/肢,每天1次。将模型动物随机分为5组,每组10只,即模型组、抗骨增生胶囊组、金荞麦低、中、高剂量组,加上前面的正常组共6组。最后一次注射木瓜蛋白酶后,给药,金荞麦低、中、高剂量组每天灌胃金荞麦提取物0.135、0.270、0.540g/kg,抗骨增生胶囊组每天灌胃抗骨增生胶囊混悬液0.945g/kg,模型组和正常组每天灌胃生理盐水5ml,连续给药28天,末次给药24小时后。观察以下指标。
2.2 ELISA法检测血清SOD、MDA、LPO
末次给药24h后,将大鼠用3%戊巴比妥钠40mg/kg腹腔注射麻醉,固定,腹总动脉取血约8mL/只,离心,制备血清。按试剂盒说明采用ELISA法测定SOD、MDA、LPO含量。
2.3 ELISA法检测关节液SOD、MDA、LPO
参照文献[4],将膝关节逐层分离至关节囊,通过反复活动膝关节,将关节液挤压至髌上囊内侧,关节腔内注入0.5mL生理盐水,抽取关节液。按试剂盒说明采用ELISA法测定SOD、MDA、LPO含量。
2.4 ELISA法检测软骨组织SOD、MDA、LPO
取关节软骨,剪碎,用生理盐水1:20匀浆。按试剂盒说明采用ELISA法测定SOD、MDA、LPO含量。
2.5 数据统计
数据用spss19.0软件进行统计处理,各实验组数据均采用均数±标准差(±S)表示,多组间比较采用单因素方差分析,两组间比较用T检验。
3 结果
3.1 各组血清SOD、MDA、LPO比较
与正常组比较,模型组血清SOD含量明显下降,而MDA、LPO明显升高,差异有极显著意义(P<0.01);与模型组比较,抗骨增生胶囊组、金荞麦各剂量组血清SOD含量明显升高,MDA、LPO明显下降(P<0.05或 P<0.01),其中抗骨增生胶囊组、金荞麦高、中剂量组差异有极显著意义(P<0.01),金荞麦低剂量组差异有显著意义(P<0.05)。另外,金荞麦高、中剂量组对SOD、MDA、LPO的调节作用优于抗骨增生胶囊组,金荞麦中剂量组作用弱于高剂量组,但效价强度高于高剂量组,是3个剂量的最优选择。见表1。
表1 各组血清 SOD、MDA、LPO 比较(±S,n=10)
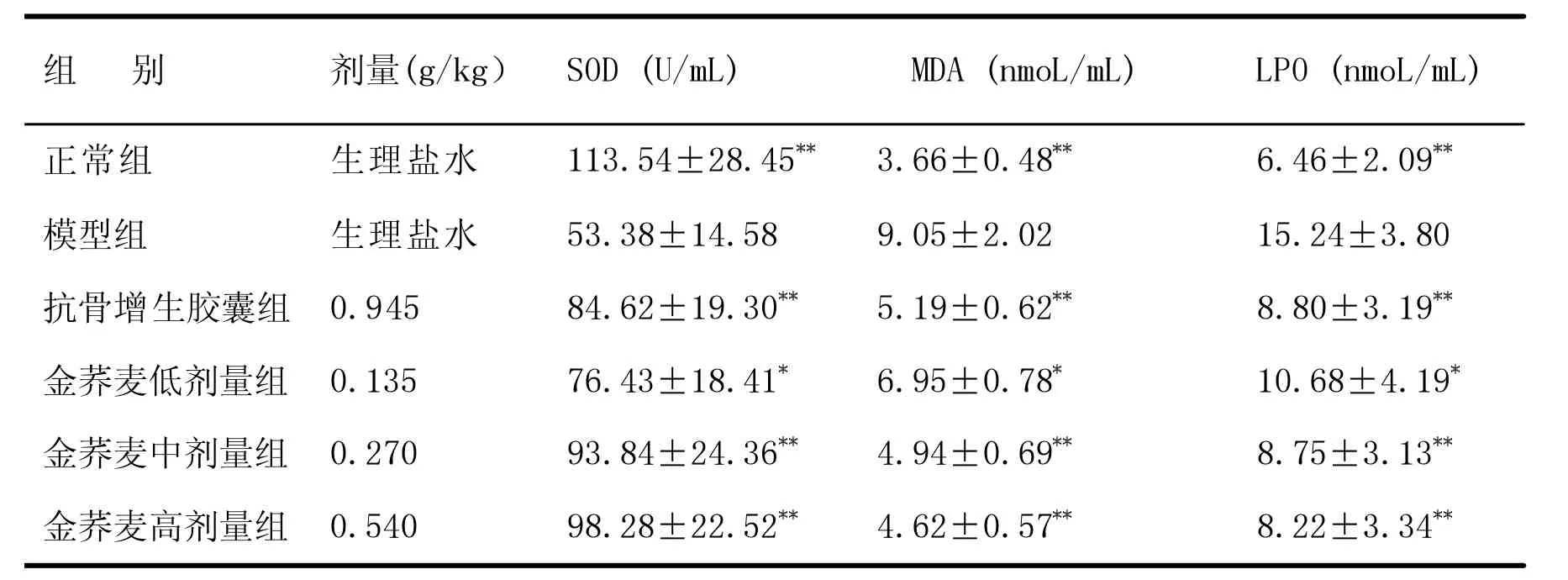
表1 各组血清 SOD、MDA、LPO 比较(±S,n=10)
注:与模型组比较:*P<0.05,**P<0.01(下同)
组 别 剂量(g/kg) SOD (U/mL) MDA (nmoL/mL) LPO (nmoL/mL)正常组模型组抗骨增生胶囊组金荞麦低剂量组金荞麦中剂量组金荞麦高剂量组生理盐水生理盐水0.945 0.135 0.270 0.540 113.54±28.45images/BZ_108_1265_1501_2309_1522.png53.38±14.58 84.62±19.30images/BZ_108_1244_1677_2288_1698.png76.43±18.41images/BZ_108_1244_1764_2288_1785.png93.84±24.36images/BZ_108_1244_1850_2288_1871.png98.28±22.52images/BZ_108_1244_1937_2288_1958.png6.46±2.09 15.24±3.80 8.80±3.19 10.68±4.19 8.75±3.13 8.22±3.34
3.2 各组关节液和关节软骨组织SOD、MDA、LPO比较
同上述血清SOD、MDA、LPO相似,与正常组比较,模型组关节液和关节软骨组织SOD含量明显下降,而MDA、LPO明显升高,差异有极显著意义(P<0.01);与模型组比较,抗骨增生胶囊组、金荞麦各剂量组关节液和关节软骨组织SOD含量明显升高,MDA、LPO明显下降(P<0.05或 P<0.01)。金荞麦各剂量中,中剂量组仍是效价强度最高。见表 2、表 3。
表2 各组关节液 SOD、MDA、LPO 比较(±S,n=10)
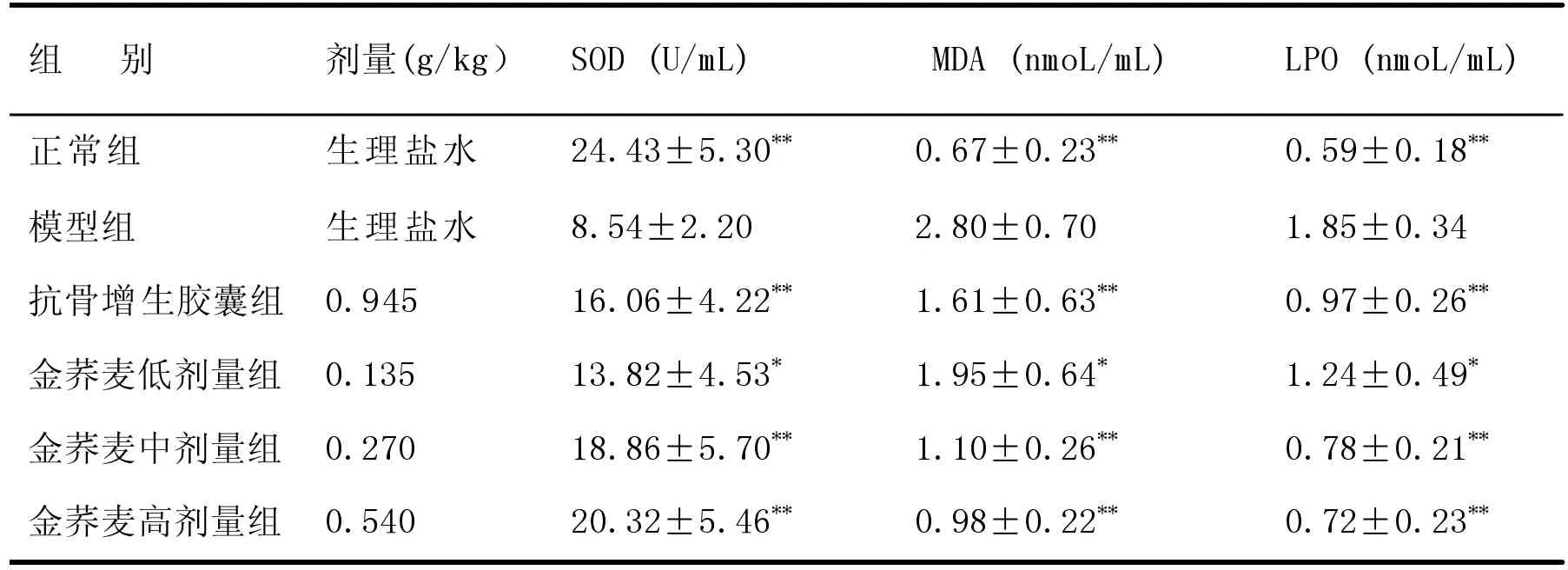
表2 各组关节液 SOD、MDA、LPO 比较(±S,n=10)
组 别 剂量(g/kg) SOD(U/mL) MDA(nmoL/mL) LPO(nmoL/mL)正常组模型组抗骨增生胶囊组金荞麦低剂量组金荞麦中剂量组金荞麦高剂量组生理盐水生理盐水0.945 0.135 0.270 0.540 24.43±5.30images/BZ_108_1240_2677_2266_2697.png8.54±2.20 16.06±4.22images/BZ_108_1240_2849_2266_2869.png13.82±4.53images/BZ_108_1240_2934_2266_2954.png18.86±5.70images/BZ_108_1240_3019_2266_3039.png20.32±5.46images/BZ_108_1240_3104_2266_3124.png0.67±0.23images/BZ_108_1615_2677_2641_2697.png2.80±0.70 1.61±0.63images/BZ_108_1615_2849_2641_2869.png1.95±0.64images/BZ_108_1615_2934_2641_2954.png1.10±0.26images/BZ_108_1615_3019_2641_3039.png0.98±0.22images/BZ_108_1615_3104_2641_3124.png0.59±0.18 1.85±0.34 0.97±0.26 1.24±0.49 0.78±0.21 0.72±0.23
表3 各组膝关节软骨组织SOD、MDA、LPO比较(±S,n=10)

表3 各组膝关节软骨组织SOD、MDA、LPO比较(±S,n=10)
组 别 剂量(g/kg) S0D (U/mg) MDA (nmoL/mg) LP0 (nmoL/mg)正常组模型组抗骨增生胶囊组金荞麦低剂量组金荞麦中剂量组金荞麦高剂量组生理盐水生理盐水0.945 0.135 0.270 0.540 4.48±0.69 8.76±0.90 6.04±0.53 7.38±0.74 5.35±0.72 5.06±0.83
4 讨论
OA作为常见于中老年人的慢性退行性关节病损,严重影响了人们的生活质量。目前,临床上对于本病也没有治愈的明确方法,原因是其具体的发病机制还不是十分清楚。已有的研究表明,生物应力、激素代谢、先天遗传因素,金属原子、氧化应激(自由基)、炎症因子等因素被认为与OA发病原因及病理发展密切相关[5]。
在上述因素中,氧化应激是OA发生发展的非常重要因素,它可以通过调节胞外基质的合成和降解、细胞内信号通道的传导、基因的转录和翻译、细胞衰老和凋亡等过程,促进OA病情的发展。而氧自由基是氧化应激导致OA软骨细胞损伤、衰老和凋亡的直接原因。氧自由基参与了维持细胞糖酵解的氧化还原平衡,从而维持关节软骨细胞代谢的动态平衡[6]。关节组织细胞微环境里稳态平衡的氧自由基,对于维持其结构和功能具有重要作用[7],但是,如果氧自由基代谢失衡,过量的氧自由基会导致软骨细胞代谢失衡,抑制软骨基质蛋白多糖和胶原的合成,加速软骨基质的降解,引起细胞损伤。氧自由基作用于细胞脂膜,使多不饱和脂肪酸发生脂质过氧化,产生LPO,LPO通过正反馈攻击生物膜导致恶性循环的细胞膜损伤,并诱使连锁增殖反应,形成降解产物MDA[8],故LPO和MDA均为氧自由基引起脂质过氧化的产物,故二者是检测氧自由基水平的常用指标,它们含量的高低反映机体细胞受自由基攻击的严重程度,间接反映骨关节炎的严重程度。SOD是氧自由基的清除剂,它的活力反映机体清除氧自由基的能力,从而保护损伤软骨组织,减缓软骨破坏,其浓度越高,表明骨关节炎损伤越小。本研究表明,OA病变过程中含量存在着氧自由基代谢的紊乱,金荞麦提取物可明显提高膝骨关节炎大鼠血清、关节液和软骨组织SOD含量,降低LPO、MDA的含量,改善氧自由基代谢平衡,减轻氧自由基对软骨组织的损伤,从而保护软骨组织。

