腹腔镜辅助胃癌D2 根治术对胃癌患者炎性因子及免疫球蛋白水平的影响
钟进营
(登封市人民医院 普外心胸外科, 河南 郑州452470)
胃癌属于临床常见疾病, 发病率较高, 且早期胃癌较为隐匿, 多数患者在确诊时已处于进展期[1]。 目前临床上对胃癌患者多采用手术方式进行治疗, 手术会对患者的免疫功能产生不同程度的抑制, 且抑制程度与手术创伤的严重程度有关, 而免疫功能又关系到术后肿瘤的复发及患者的预后[2]。 腹腔镜辅助胃癌D2 根治术是在腹腔镜技术上发展的术式。 与开腹手术相比, 行腹腔镜辅助胃癌D2 根治术的胃癌患者术后疼痛较轻,术后恢复也往往较快[3]。 然而, 关于两者对胃癌患者炎性因子及免疫球蛋白水平的影响的报道较少。 鉴于此, 本研究旨在比较腹腔镜辅助胃癌D2 根治术及开腹远端胃癌D2 根治术对胃癌患者炎性因子及免疫球蛋白水平的影响, 现报道如下。
1 资料与方法
1.1 一般资料选择2017 年1 月至2019 年6 月我院收治的90例胃癌患者, 采用随机数字表法分为对照组和观察组各45 例。对照组男26 例, 女19 例; 年龄35~73 岁, 平均年龄 (47.23± 7.48) 岁; TNM 分期: Ⅰ期14 例, Ⅱ期13 例, Ⅲ期18 例。观察组男27 例, 女18 例; 年龄36~75 岁, 平均年龄 (47.46± 7.74) 岁; TNM 分期: Ⅰ期15 例, Ⅱ期15 例, Ⅲ期15 例。两组的一般资料比较无统计学差异 (P>0.05) 具有可比性。
1.2 入选标准纳入标准: ①经CT、 超声检查确诊为胃癌; ②无手术禁忌; ③未发现肿瘤远处转移。 排除标准: ①癌组织病灶直径>10 cm; ②伴有严重心脑血管疾病; ③精神疾病; ④伴有腹腔粘连。
1.3 方法观察组行腹腔镜辅助远端胃癌D2 根治术。 患者气管插管全麻后取平卧位, 建立气腹, 五孔法置入腹腔镜, 观察腹腔内的肿瘤形态及与周围组织的关系, 剥离结肠系膜前叶和胰腺包膜, 离断相关微血管及韧带, 清除No.4d、 No.4sb, 暴露胃大弯, 解剖胃结肠干; 清除No.14v, 并离断相关静脉及动脉;清除No.6, 解剖十二指肠动脉, 离断胃右动脉; 清除No.12a、No.5, 解剖腹腔干3 大分支, 行血管离断, 并清除No.7、 No.8、No.9、 No.11p。 术毕, 将标本取出重建消化道。 对照组行开腹远端胃癌D2 根治术。 患者气管插管全麻后取平卧位, 在上腹部正中作20 cm 切口, 术中游离吻合操作与观察组相同。
1.4 观察指标①比较两组患者术前及术后1 d 的炎性因子水平。 取静脉血3 mL, 离心后取血清, 采用酶联免疫吸附法测定白细胞介素6 (IL-6)、 白介素8 (IL-8)、 肿瘤坏死因子α(TNF-α) 水平。 ②比较两组术前及术后3 d 的免疫球蛋白水平。 空腹采血2 mL, 置于EDTA-2K 抗凝试管, 采用免疫悬浊法测定免疫球蛋白A (IgA)、 免疫球蛋白M (IgM)、 免疫球蛋白G (IgG) 水平。
1.5 统计学方法采用SPSS 22.0 软件处理数据, 计量资料以± s 表示, 比较采用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 炎性因子水平术前, 两组的IL-6、 IL-8、 TNF-α 水平比较, 差异无统计学意义 (P>0.05); 术后, 两组的IL-6、 IL-8、TNF-α 水平均高于术前, 但观察组的IL-6、 IL-8、 TNF-α 水平低于对照组 (P<0.05)。 见表1。
表1 两组的炎性因子水平比较 (±s)

表1 两组的炎性因子水平比较 (±s)
注: 与同组术前比较, *P <0.05。
时间 组别 n IL-6 (ng/L) IL-8 (ng/mL) TNF-α (ng/L)术前 观察组 45 16.68±2.35 6.54±1.38 49.53±11.45对照组 45 16.78±2.36 6.53±1.42 50.68±10.47 t 0.201 0.034 0.497 P 0.841 0.973 0.620术后 观察组 45 21.12±2.03* 13.13±2.95* 71.24±13.64*对照组 45 33.87±5.42* 24.85±4.12* 84.89±17.96*t 14.778 15.515 4.060 P 0.000 0.000 0.000
2.2 免疫球蛋白水平术前, 两组的IgA、 IgM、 IgG 水平比较,差异无统计学意义 (P>0.05); 术后, 两组的IgA、 IgM、 IgG水平均低于术前, 但观察组的IgA、 IgM、 IgG 水平高于对照组(P<0.05)。 见表2。
表2 两组的免疫球蛋白水平比较 (±s)
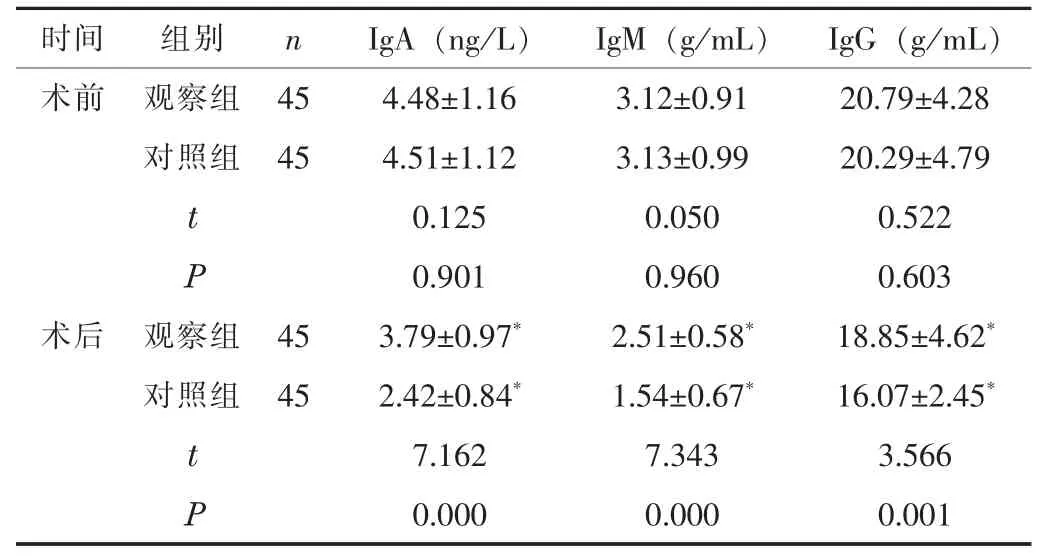
表2 两组的免疫球蛋白水平比较 (±s)
注: 与同组术前比较, *P <0.05。
时间 组别 n IgA (ng/L)IgM (g/mL)IgG (g/mL)术前 观察组 45 4.48±1.16 3.12±0.91 20.79±4.28对照组 45 4.51±1.12 3.13±0.99 20.29±4.79 t 0.125 0.050 0.522 P 0.901 0.960 0.603术后 观察组 45 3.79±0.97* 2.51±0.58* 18.85±4.62*对照组 45 2.42±0.84* 1.54±0.67* 16.07±2.45*t 7.162 7.343 3.566 P 0.000 0.000 0.001
3 讨论
近年来, 随着人们生活水平的提升, 胃癌发病率呈逐年上升趋势。 胃癌的发生多与遗传、 地域环境及幽门螺杆菌感染有关, 且多数患者就诊时已到进展期[4]。 临床治疗胃癌以根治术为主, 传统开腹手术可有效清除淋巴结, 但切口较长, 创伤较大, 不利于术后恢复[5]。 随着微创技术的发展, 腹腔镜手术因其创伤小、 恢复快等优势, 广泛应用于胃癌的临床治疗中。
机体受到创伤后会引发多种炎性细胞释放炎性因子、 生长因子, 其中TNF-α 与白介素是常见的细胞因子, 且与患者的应激反应有关[6]。 机体免疫功能是术后康复、 抵抗感染的重要基础, 而IgA、 IgM、 IgG 是重要的免疫功能指标。 本研究结果显示, 术后, 两组的IL-6、 IL-8、 TNF-α 水平均高于术前, 但观察组的IL-6、 IL-8、 TNF-α 水平低于对照组 (P<0.05); 术后,两组的IgA、 IgM、 IgG 水平均低于术前, 但观察组的IgA、IgM、 IgG 水平高于对照组 (P<0.05), 表明胃癌患者行腹腔镜辅助胃癌D2 根治术可有效减轻机体炎性反应, 对免疫功能影响较小。 分析其原因在于: 开腹手术创伤较大, 术中腹腔暴露较为广泛, 术后炎性反应较为严重, 进而对免疫功能产生较大影响[7]。 腹腔镜辅助胃癌D2 根治术属于微创手术, 在腹腔镜辅助下具备特殊的视角及照明技术处理血管及淋巴结, 有助于术者充分清除D2 淋巴结; 同时腹腔镜下手术视野可放大4 倍,可在彻底清除淋巴结的同时更精细地解剖组织, 避免因开腹导致的副损伤, 减少对神经、 血管的损伤及炎性反应[8], 故对患者的免疫功能损伤较小。
综上所述, 腹腔镜辅助胃癌D2 根治术可有效减轻胃癌患者术后炎性反应, 且对免疫功能影响较小。

