大肠杆菌DNA定性标准物质的制备及在枸杞子污染检测中的应用
夏丹丹,赵莹莹,马盼盼,王深垒,马常阳,3,郜晓峰,,康文艺,3,
(1.河南大学 国家食用菌加工技术研发专业中心,河南 开封 475004;2.河南省药食两用资源功能研究国际联合实验室,河南 开封 475004;3.开封市保健食品功效成分研究重点实验室,河南 开封 475004)
枸杞子(Lycium barbarumL.)是茄科枸杞属植物的干燥成熟果实[1],具有抗氧化、控制血糖、养肝明目、提高免疫力等多种功效[2-4],是卫生部批准的药食两用食物。枸杞子糖分含量很高,多糖是它主要的功能成分[5],占比约为3.36%[6]。所以枸杞子易泛油,一旦贮存不当很容易腐烂、虫蛀甚至被微生物污染,目前,对枸杞子的微生物污染情况研究不够深入[7]。
大肠埃希氏菌(Escherichia coli)是最为常见的食源性微生物之一[8]。大肠杆菌中常见的毒力基因有志贺样毒素基因(stx1和stx2)、紧密素(eae)、溶血素基因(hly)、O抗原编码基因(rfb)、β-葡糖醛酸糖苷酶基因(uid)和鞭毛抗原基因(fli)[9-12]。目前对于大肠杆菌的检测从传统方法到包括常规聚合酶链式反应(polymerase chain reaction,PCR)、多重PCR、实时PCR[13-14]的分子生物学技术、DNA微阵列技术[15]、免疫检测技术[16]、传感器芯片技术[17]和质谱技术[18]。这些方法基于相应的核酸标准物质。由于质粒标准品具备稳定性好、纯度高等优点[19-21],常常用于临床应用检测阳性对照品。由于缺少大肠埃希氏菌毒力基因监测相关质粒定性标准样品[22],参考物质溯源性不强、不确定度高、评价模式单一等严重缺陷,导致各检测机构之间的检测结果差异极大,无法为食品检验数据提供技术保障。
本研究针对目前相关领域急需,构建大肠杆菌毒力基因质粒标准品,保证大肠杆菌关方法检测结果的可比性,并以药食两用食物枸杞子为研究目标,快速检测大肠杆菌污染情况,以期为食品中大肠杆菌的快速检测提供技术参考。
1 材料与方法
1.1 材料与试剂
34 批枸杞子样品购于2018年1月,存放于河南大学国家食用菌加工技术研发专业中心。
大肠杆菌(O157、CMCC 43201、CICC 10372、ATCC 25922)、金黄色葡萄球菌(CICC 23656)、阪崎肠杆菌(CICC 21560)、鼠伤寒沙门氏菌(ATCC 14028)、单核细胞性李斯特菌(ATCC 19115)均由中国食品药品检定研究院于2018年5月赠送,并贮存于河南大学国家食用菌加工技术研发专业中心。本研究中选择CICC为基因组提供菌。
琼脂糖 东格生物技术有限公司;6×DNA loading Buffer、GoldView I型核酸染色剂、氨苄青霉素 美国Solarbio公司;琼脂、麦康凯琼脂培养基、伊红美蓝培养基、营养肉汤、营养琼脂 北京奥博星生物技术有限公司;D2000 DNA Marker、Marker III、感受态细胞(DH-5a)、2×Pfu PCR Master Mix(KP201)、细菌基因组DNA提取试剂盒(DP302)、普通琼脂糖凝胶DNA回收试剂盒(DP209)、pLB零背景快速克隆试剂盒、快速质粒小提试剂盒(DP105)、土壤基因组DNA提取试剂盒(DP336) 天根生化科技有限公司;pH 7.0无菌氯化钠蛋白胨缓冲液 青岛宾得生物技术有限公司。
1.2 仪器与设备
PCR扩增仪、Nano Drop 2000超微量分光光度计、台式高速离心机 美国Thermo Scientific公司;超净工作台苏洁净化设备有限公司;生化培养箱 泰宏医疗器械有限公司;JUNYI脉冲场凝胶电泳仪、BIS910凝胶成像系统 北京东胜创新生物科技有限公司。
1.3 方法
1.3.1 大肠杆菌PCR检测方法的建立和评价
取大肠杆菌菌液1 mL,12 000 r/min,4 ℃离心2 min,弃上清液,按照细菌基因组DNA提取试剂盒的操作步骤提取大肠杆菌基因组DNA。对大肠杆菌中毒力基因escV、stx2和hlyA进行PCR反应体系和反应程序的优化,并对所建立的PCR反应进行特异性和灵敏度实验。用金黄色葡萄球菌、阪崎肠杆菌、沙门氏菌和单核细胞性李斯特菌进行引物特异性实验。将提取的大肠杆菌全基因组DNA进行10 倍梯度倍比稀释为10-1、10-2、10-3、10-4、10-5和10-6系列浓度,进行检测灵敏度实验,将同一批不同稀释度的稀释液按建立的方法进行3 次重复实验,分析此方法的重复性。

表1 引物序列及产物大小Table 1Primer sequences and PCR-amplified product sizes
1.3.2 重组质粒的构建和验证
利用建立的PCR反应扩增大肠杆菌的毒力基因,得到目的条带后,使用普通琼脂糖凝胶DNA回收试剂盒进行胶回收。使用pLB零背景快速克隆试剂盒将大肠杆菌毒力基因escV、stx2、bfpA纯化后的PCR产物连接至pLB-simple Vector上,连接产物转化至大肠杆菌DH5α感受态细胞,培养重组大肠杆菌,挑取单菌落经菌落PCR、并送往华大生物科技有限公司和生工生物工程(上海)股份有限公司测序进行鉴定,对测序结果采用BLAST进行比对,以验证质粒标准品构建的是否正确。经筛选连接转化成功后的重组子继续进行传代培养15 代,并进行送检测序验证传代过程中质粒是否丢失。
1.3.3 质粒标准品冻干粉的制备
质粒标准品虽然具有性质稳定的优点,但其在长期贮存过程中也会出现染菌,贮存不方便等问题,考虑到这方面,本研究将制备的质粒标准品进行冻干粉制备,将质粒标准品制备成无菌粉末剂型,贮存在EP管中,质粒标准品经过冻干之后,使用时再将冻干粉溶解,不仅减少了染菌的几率,其稳定性也更高,贮存起来也更方便。本研究也对制备的冻干粉进行了检测限研究、均匀性研究以及短期稳定性和长期稳定性研究。
将escV、stx2、hlyA重组质粒进行冻干粉制备和应用,选择经筛选成功的escV、stx2、hlyA阳性克隆进行菌液扩大培养,采用碱裂解法进行质粒大提用于质粒标准品冻干粉的制备,使用Nano Drop 2000超微量分光光度计测定提取质粒的浓度和纯度,然后送公司进行测序。测序成功后进行冻干粉的制备,用EP管贮存,制成质量400 ng左右的冻干粉,分别制备150 管。
1.3.4 均匀性分析
在制备的150 管冻干粉中随机挑选15 管,用10 μL ddH2O溶解,进行各管之间的均一性研究。使用Nano Drop 2000超微量分光光度计测定其浓度,分别测定3 次,取其平均值,用F检验[24]对数据进行分析。
1.3.5 稳定性分析
1.3.5.1 短期稳定性
随机取质粒标准品冻干粉置于25、4、-20 ℃ 3 个温度下2 周进行短期稳定性实验,第1、3、7、14天进行检测,每次检测各取3 管,用10 μL ddH2O溶解,用Nano Drop 2000超微量分光光度计测定其浓度,另取溶解后的escV、stx2、hlyA质粒标准品作为模板,分别对escV、stx2、hlyA引物进行PCR扩增,进行定性分析,考察冻干粉的短期稳定性。
1.3.5.2 长期稳定性
随机取质粒标准品冻干粉置于25、4、-20 ℃ 3 个温度下5 个月进行长期稳定性实验,每个月进行一次检测。每次检测各取3 管,用10 μL ddH2O溶解,用Nano Drop 2000超微量分光光度计测定其浓度和PCR扩增来考察冻干粉的长期稳定性。
1.3.6 检测限实验
将提取的escV、stx2、hlyA质粒标准品浓度先50 倍稀释后,作为初始检测样品,进行稀释后得到10-1、10-2、10-3、10-4、10-5和10-6系列浓度梯度,进行检测限实验,确定escV、stx2、bfpA、hlyA质粒标准品的检测限。将escV、stx2和hlyA标准质粒浓度按照下式换算为拷贝数:
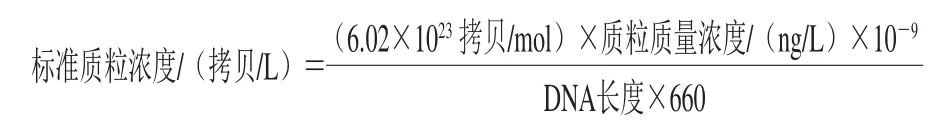
DNA长度=载体长度+目的基因长度
1.3.7 质粒冻干粉在枸杞子检测中的应用
样品制备:称取25 g枸杞样本加入pH 7.0无菌氯化钠蛋白胨缓冲液225 mL,振荡30 min,超声处理10 min。收集液体6 000 r/min离心10 min,取沉淀,用于DNA提取。使用土壤基因组DNA提取试剂盒提取枸杞样品的微生物基因组DNA,将提取的枸杞样品DNA作为PCR扩增的模板,进行毒力基因escV、stx2、hlyA的检测。对于PCR检测结果呈现阳性的枸杞样品进行传统微生物分离纯化检测。
2 结果与分析
2.1 PCR检测方法的建立和评价结果
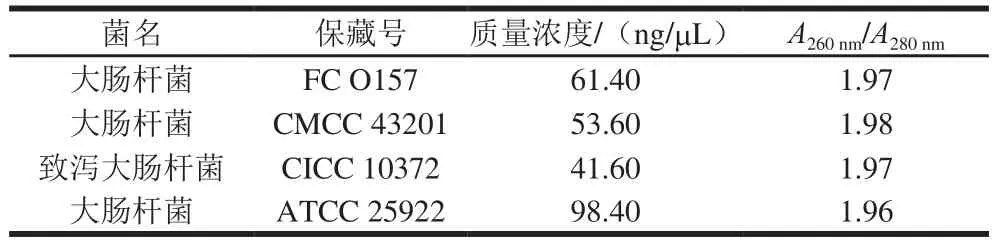
表2 基因组DNA质量浓度和纯度Table 2 Concentration and purity of genomic DNA
通过使用Nano Drop 2000超微量分光光度计,测定提取的大肠杆菌全基因质量DNA质量浓度和纯度,结果如表2所示。提取的大肠杆菌DNA质量浓度在50~100 ng/μL之间,A260nm/A280nm也可以满足后续实验要求。如图1所示,可以观察到单一清晰的特异性条带,无杂带,条带较亮,说明提取的DNA纯度和浓度较好,满足后续实验要求。
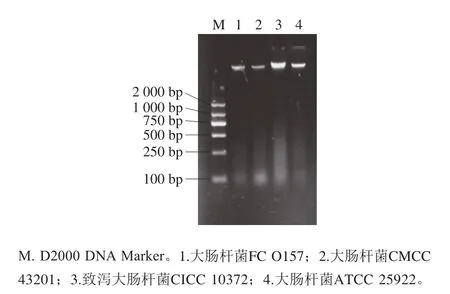
图1 大肠杆菌全基因组DNA电泳图Fig.1 Electrophoretic diagram of E.coli whole genomic DNA
优化后的25 μL PCR反应体系为2×Pfu PCR Master Mix 12.5 μL,DNA模板0.5 μL(<1 μg/μL),上、下游引物0.25 μL(10 μmol/L),加双蒸水至25 μL。escV和stx2扩增条件:94 ℃预变性5 min;94 ℃变性1 min,63 ℃退火30 s,72 ℃延伸40 s,30 个循环;72 ℃延伸7 min。hlyA扩增条件:95 ℃预变性5 min;95 ℃变性1 min,56 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸7 min。
大肠杆菌escV、stx2和hlyA引物特异性实验结果表明这些引物具有特异性,结果如图2所示。建立的PCR检测方法可使大肠杆菌的检出限达到pg水平,检测结果如图3所示。重复性实验结果并无差异,该PCR检测方法重复性满足实验要求。
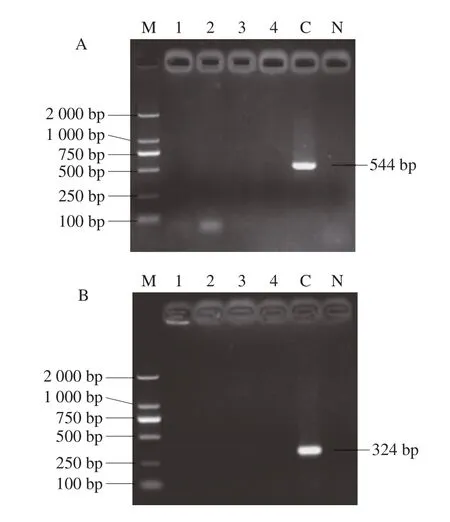
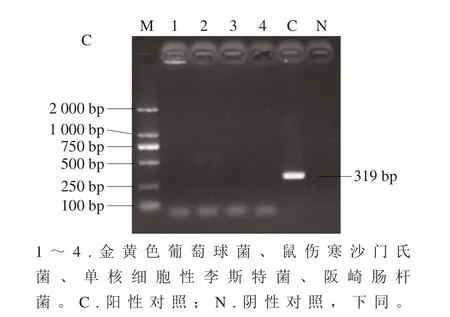
图2 大肠杆菌escV(A)、stx2(B)、hlyA(C)引物特异性结果Fig.2 Primer specificity of escV (A), stx2 (B), and hlyA (C) in E.coli
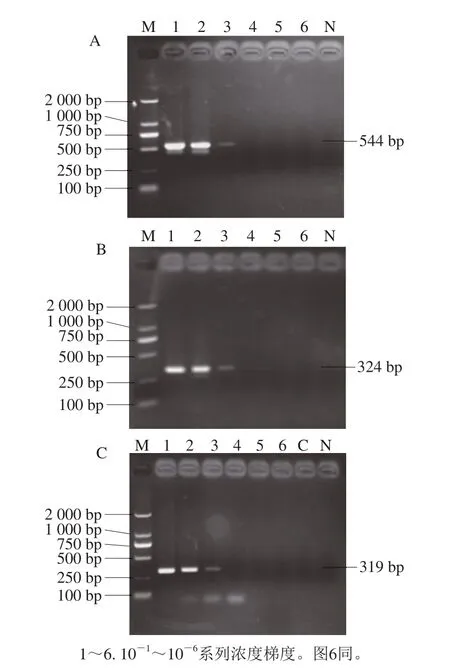
图3 大肠杆菌escV(A)、stx2(B)、hlyA(C)基因PCR检测灵敏度结果Fig.3 PCR sensitivity of escV (A), stx2 (B), and hlyA (C) in E.coli
2.2 重组质粒构建结果
重组质粒PCR结果显示各个毒力基因的片段大小相一致,表明转入的重组质粒中含有目的基因。将escV、stx2、hlyA重组质粒测序结果与GeneBank上已经公布的序列进行比对,用DNAMAN软件进行序列比对,比对率都为100%、100%、100%,检测结果如图4所示。将经筛选连接转化成功后的重组子继续进行传代培养15 代,并进行质粒提取,每隔代送检测序,测序结果与上述测序结果相同,说明在传代过程中没有发生碱基丢失、错配、突变的现象。

图4 大肠杆菌escV(A)、stx2(B)、hlyA(C)测序比对结果Fig.4 Sequence alignment results of escV (A), stx2 (B), and hlyA (C) in E.coli
2.3 质粒标准品制备及分析结果
用碱裂解法进行质粒提取,所提质粒用NanoDrop 2000超微量分光光度计测定质量浓度和纯度如表3所示,A260nm/A280nm均在1.8~2.0之间,纯度良好,满足实验要求。将提取的质粒进行测序,GeneBank上已经公布的序列进行比对,比对率均为100%。
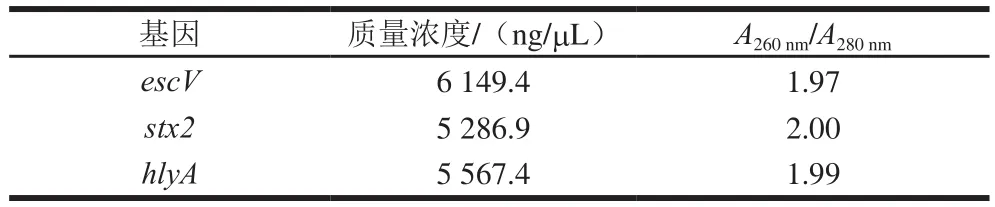
表3 重组质粒质量浓度和纯度Table 3 Concentration and purity of recombinant plasmids
2.3.1 均匀性结果
随机挑选escV、stx2和hlyA质粒标准品15 管进行质量浓度测定结果如表4所示,并对测定结果进行方差分析,结果escV、stx2和hlyA质粒标准品质量浓度F值均小于F0.05(14,30)=2.04,15 管之间不存在显著性差异,样品均匀性较好。
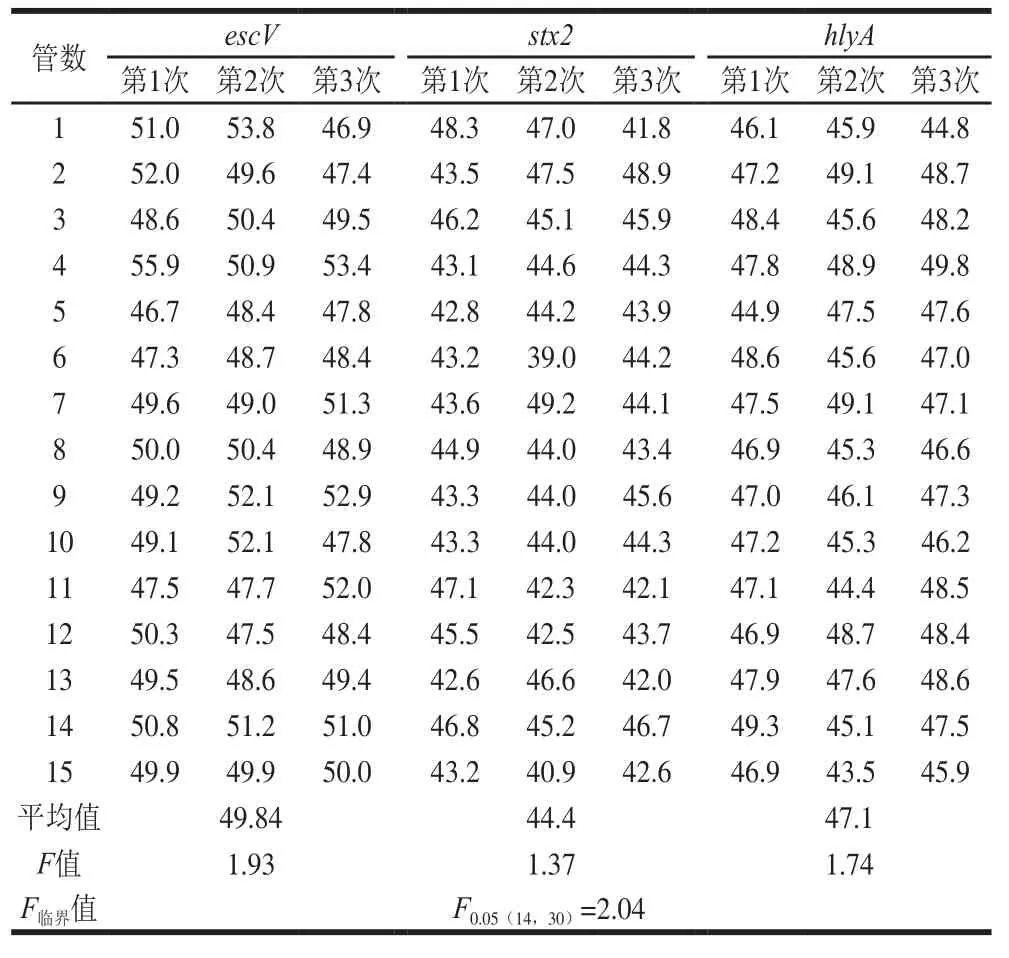
表4 escV、stx2和hlyA质粒标准品质量浓度Table 4 Homogeneity evaluation: concentrations of escV, stx2 and hlyA plasmid standards ng/μL
2.3.2 短期稳定性结果
在25、4、-20 ℃ 3 个温度下贮存14 d,各个质粒标准品质量浓度相近,没有显著性变化(表5),数据之间离散程度较小,PCR扩增均可扩增出单一明亮的特异性条带(图5),说明质粒标准品短期稳定性好。
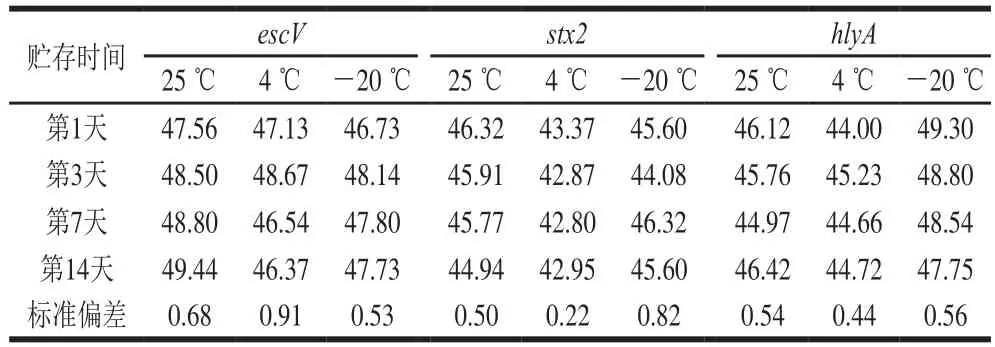
表5 escV、stx2和hlyA质粒标准品短期质量浓度Table 5Short-term stability evaluation: concentrations of escV, stx2 and hlyA plasmid standards ng/μL
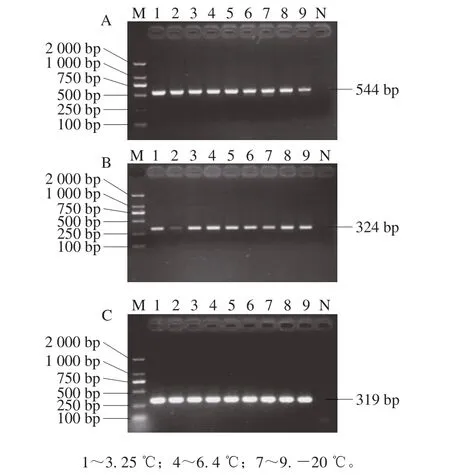
图5 escV(A)、stx2(B)和hlyA(C)质粒标准品定性检测结果Fig.5 Qualitative test results with escV (A), stx2 (B) and hlyA (C)plasmid standards
2.3.3 长期稳定性结果
在25、4、-20 ℃ 3 个温度下贮存5 个月,各个质粒标准品质量浓度没有显著性变化(表6),数据之间离散程度较小,PCR扩增均可扩增出单一明亮的特异性条带,说明质粒标准品长期稳定性好。
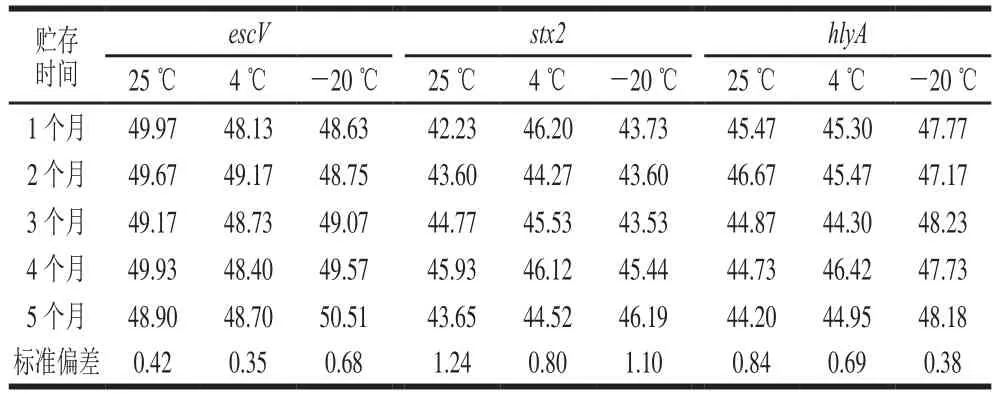
表6 escV、stx2和hlyA质粒标准品长期质量浓度测定Table 6Long-term stability evaluation: concentrations of escV, stx2 and hlyA plasmid standardsng/μL
2.3.4 检测限实验结果
如图6所示,通过计算得到escV、stx2和hlyA质粒标准品的检测限分别为3.93×106、2.41×105拷贝/μL和2.14×105拷贝/μL。
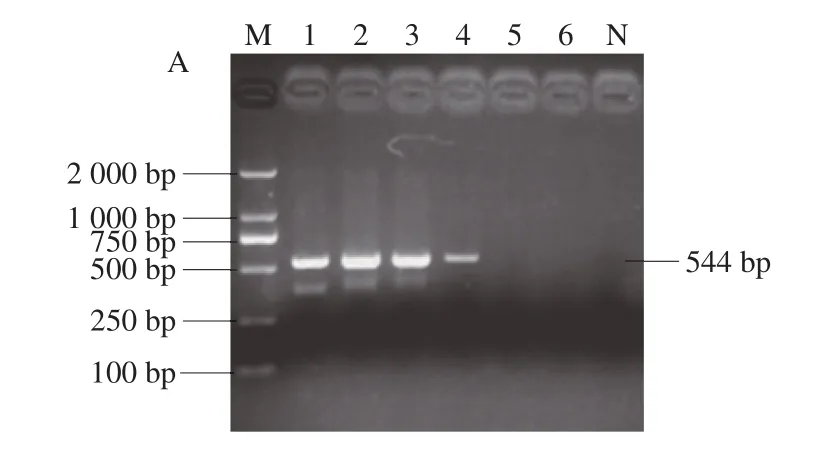
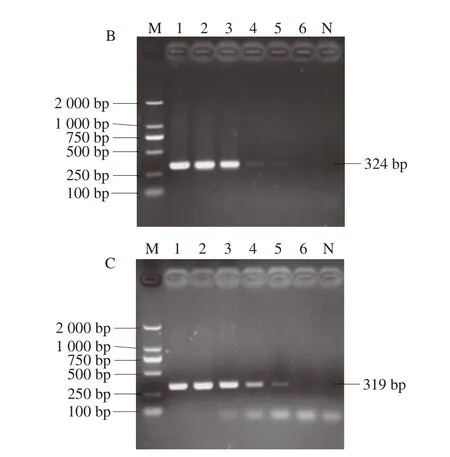
图6 梯度稀释质粒标准品escV(A)、stx2(B)、hlyA(C)的1.5%电泳结果Fig.6 Electrophoresis of gradient dilutions of plasmid standards escV (A), stx2 (B), and hlyA (C)
2.3.5 质粒标准品在枸杞子中的应用
将34 批枸杞子样品进行escV、stx2、hlyA检测,在34 批枸杞子样品中,没有检测出escV、stx2,16号、33号和34号枸杞子样品中检测出hlyA(图7)。
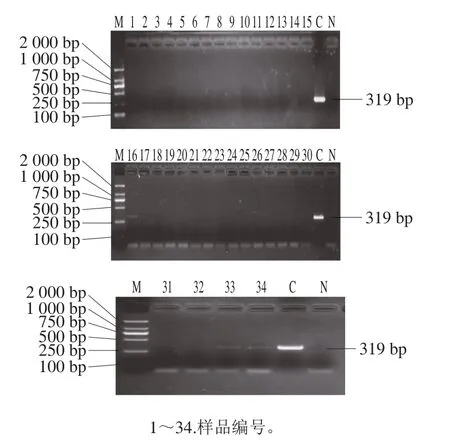
图7 枸杞子样品中hlyA的PCR检测结果Fig.7 PCR results of hlyA in L.barbarum samples
选择PCR检测结果为阳性的3 批枸杞样品按照GB 4789.6—2016《食品卫生微生物学检验 致泻大肠埃希氏菌检验》的方法进行检测,结果没有检测出大肠杆菌。
3 讨 论
食品原料在加工、包装、运输和贮存过程中,由于温度、湿度、空气和光线等条件没有严格控制会使质量下降,产生安全隐患[25-26],霉变、虫蛀是最常见的变异现象,对于糖分、脂肪含量高的食品原料更容易发生腐烂变质、产生菌丝、微生物污染等现象[27-28]。本研究所用的枸杞子是2018年1月在不同产地收集,自然条件下贮存,并用构建的escV、stx2、hlyA质粒DNA标准品进行了大肠杆菌致病菌检测,结果在34 批样品中escV、stx2没有被检测出,有3 批枸杞样品中检测出hlyA,检出率为8.82%,选择被检出的3 批枸杞子样品,进行传统的微生物分离方法进行检测,并进行16S rRNA测序,结果没有检测出大肠杆菌。没有检出并不能代表枸杞子中不含有大肠杆菌,传统微生物检测方法中使用的增菌液没有针对性的对目的菌增菌,在大的微生物污染环境下,目标致病菌就很可能被抑制生长,大大降低了检出率[29]。PCR检测方法和传统的微生物分离检测技术相比不仅缩短了检测时间,而且检测结果的准确性也更高[30-31],本研究采用常规的PCR检测技术结合质粒构建成功构建了用于快速检测大肠杆菌的重组质粒DNA标准品,相对于传统微生物分离鉴定检出率有了很大的提高。姜睿娇等[32]通过双重荧光定量PCR方法和质粒构建技术结合成功构建了用于快速检测副猪嗜血杆菌和巴氏杆菌的重组质粒标准品,并对临床28 份样品进行了检测,结果阳性检出率为53.57%,同时也采用了常规PCR技术和细菌分离鉴定同步进行检测,结果检出率分别为46.42%和28.57%。随着对微生物快速检测的要求越来越高,传统的细菌分离检测技术已经不能满足需求,细菌分离也较为困难,能分离出的细菌种类较少[33],并且耗时较长,大大降低了样品检测的准确性和效率。将PCR技术与多种技术相结合应用到食品中微生物的快速检测,不仅克服了传统检测方法的弊端,得到的检测结果准确度和灵敏度更高,检测效率也有了很大的提高。
本研究中构建的大肠杆菌中质粒标准品,经过菌落PCR、测序以及传代进行了验证,结果呈现100%,测序与GeneBank上已经公布的序列进行比对,比对率也均为100%,传代结果也显示出质粒标准品具有良好的稳定性。本研究使用的是一种即用型的阳性选择克隆载体pLB-simple Vector,pLB是在pLL3.7载体基础上的修改,添加了已知的防止表观遗传沉默的遗传元件,由于该载体含有一种致死基因,因此当克隆位点处插入外源片段时就会引起基因的失活[34],只有转化了重组质粒的细菌才能存活形成克隆菌落,可以保证在连接的过程中重组质粒的成功构建,基于pLB载体的这个优势,它在载体构建中得到了广泛的应用,本研究中制备的质粒标准品的A260nm/A280nm在1.8~2.0之间,纯度也较好。本研究将制备成功的质粒标准品进行了无菌冻干处理,制备成质量浓度在400 ng/μL左右的冻干粉,并进行了均匀性、稳定性研究,结果表明质粒标准品冻干粉均匀性、稳定性都较好,由于将质粒标准品进行了无菌冻干,也减少了冻干粉贮存过程中的污染机率,有研究将大肠杆菌菌悬液、金黄色葡萄球菌菌悬液进行了无菌冻干处理,并对其进行了均匀性和稳定性实验,结果表明其均匀性结果无显著性差异,保存过程中稳定性也较好[35-36]。
大肠杆菌作为食品安全微生物限量指标中的指示菌[37],不同的食品中对大肠杆菌的检出限量有不同的规定,当环境中检出含有大肠杆菌时,说明可能存在大肠杆菌污染,大肠杆菌本身作为一种正常肠道菌群,在一定的环境下可以使人致病[38]。当人们的日常饮食被大肠杆菌污染时,及时、准确地检测出来,不仅可以起到预防作用,减少疾病的爆发,也能做到溯源,有效地控制污染源的散播。
4 结 论
目前,我国对于食品安全未知风险发现能力较弱、风险识别与评估技术周期长、效率低、食品安全检测技术及相关标准缺乏[39-40]。无论与食品安全形势的实际需求,还是与国际食品安全基本标准相比,都存在较大差距。尤其是食品微生物定性和定量检验DNA参考物质体系不完整,极大限制了检验检测的水平。本研究以食源性微生物大肠杆菌为研究对象,构建大肠杆菌中常见毒力基因的质粒DNA标准品,并对常用药食两用资源枸杞子进行检测,建立了一种可以应用的技术和质粒标准品。该质粒标准品能够为PCR快速检测食品和中药中大肠杆菌提供阳性对照,减小了方法的不确定性,保证检测结果的准确性,实现检测结果的可溯源性,为食品中大肠杆菌的快速检测提供技术参考。

