二维超高效液相色谱-三重四极杆/复合线性离子阱质谱联用法快速测定水产品及其制品中河豚毒素
张秀尧,蔡欣欣,张晓艺,李瑞芬
(温州市疾病预防控制中心,浙江 温州 325001)
河豚毒素(tetrodotoxin,TTX)是一种毒性很强的非蛋白神经毒素,存在于河豚鱼和多种脊椎动物及无脊椎动物体内,如河豚鱼、织纹螺、蝾螈、蟾蜍和蟹类等水产品。TTX属氨基全氢化喹唑啉化合物,为钠通道阻断剂,可以选择性地阻断神经元细胞及肌膜上的钠离子通道,阻断神经冲动的传导,引起神经麻痹,严重者抑制呼吸导致死亡[1-2]。TTX的化学性质稳定,烹饪、日光曝晒、盐腌等一般食物加工方法均难以完全破坏,所以含有TTX的水产品加工成制品,如烤鱼片或鱼干等也是有毒的。由于河豚鱼和织纹螺等肉鲜味美,我国沿海均有食用的习惯,已发生多起误食河豚鱼或织纹螺等引起的TTX中毒事件[3-6],中毒后又缺乏特效解毒药,严重者常致人死亡,TTX中毒已成为引人关注的水产品安全问题。因此,水产品及其制品中TTX的检测方法一直是研究的热点。
水产品中TTX的检测方法主要有小鼠生物法[7-8]、液相色谱紫外检测法[9]、液相色谱柱后衍生荧光法[10]、气相色谱-质谱联用法[11]和液相色谱-串联质谱联用法[12-20]等。其中小鼠生物法测定样品的总毒性,但不能对样品中毒素成分进行定性,且小鼠个体差异较大,检测结果误差大;液相色谱紫外检测法选择性差、灵敏度低;液相色谱荧光检测法选择性不强,常有基质成分的干扰;气相色谱-质谱联用法需要衍生,操作比较复杂,测定在强碱性条件下能够生成C9-碱的包括TTX在内的TTX类似物的总和,且灵敏度低;液相色谱-串联质谱联用法灵敏度高、定性能力强,是测定TTX的理想检测方法。早期由于缺少TTX专一性强的样品前处理方法,样品处理液的基质抑制效应比较严重,又没有商品化的同位素内标,多使用基质匹配标准外标法定量,方法的灵敏度不高,定量的准确度和精密度均不理想[13-15]。近年来有文献采用免疫亲和柱净化方法,能够去除杂质,消除基质效应(matrix effect,ME),可以采用溶剂标准法进行定量,但也存在免疫亲和柱价格高、线性范围窄等缺点[16-18]。
二维超高效液相色谱技术具有峰容量大、分离能力强、能够显著降低复杂样品的ME、实现样品分析的自动化等优点,已在食品安全、中药有效成分分析、环境科学等领域得到广泛应用[21-23]。本研究采用中心切割二维超高效液相色谱技术同时对样品进行净化和分离,减少样品ME,采用三重四极杆/复合线性离子阱质谱技术进行检测,建立水产品及其制品中TTX的快速检测方法,方法简单、灵敏、准确。
1 材料与方法
1.1 材料与试剂
乙腈、甲醇(液相色谱溶剂级) 德国Merck公司;乙酸、甲酸(液相色谱溶剂级) 美国Tedia公司;TTX标准物质(纯度≥99%) 大连瑞芳生化物品有限公司,用0.2%乙酸溶液配制成100 μg/mL标准贮备溶液,保存于-80 ℃冰箱中。
1.2 仪器与设备
二维超高效液相色谱仪(由ACQUITY UPLC QSM四元溶剂管理系统(第1维)、ACQUITY UPLC BSM二元溶剂管理系统(第2维)、ACQUITY UPLC FTN样品管理系统、ACQUITY UPLC CM-A色谱柱管理系统和515稀释泵组成,由Empower 3工作站控制) 美国Waters公司;QTRAP 6500三重四极杆/复合线性离子阱串联质谱仪(由Analyst 1.6.2软件控制) 美国AB SCIEX公司;GM200碾磨仪德国Retsch公司;ULTRA-TURRAX T-25型分散机、MS3旋涡混旋器 德国IKA-WERKE公司;3-30K高速冷冻离心机 德国Sigma公司;2510超声波清洗机美国Branson公司;Gradient A10 Mill-Q超纯水器 法国Millipore公司。
1.3 方法
1.3.1 样品前处理
从样品中取出有代表性的可食部分经碾磨仪搅碎、均质,-35 ℃冷冻保存。
称取2.00 g样品置于50 mL具塞离心管中,加入9.0 ml 0.2%乙酸溶液,分散机匀质15 s,刀头用9 mL 0.2%乙酸溶液清洗,提取液调pH 3~5,置于沸水浴中加热5 min,(或者102 ℃烘箱放置10 min),取下用冷水冷却至室温,超声提取5 min,12 000 r/min离心5 min,吸取上清液,残渣再用刀头清洗液重复提取1 次,合并提取液,用0.2%乙酸溶液定容至20 mL,混匀,吸取100 μL提取液加入900 μL 0.2%乙酸溶液,旋涡混匀,过0.2 μm滤膜,待测。
1.3.2 色谱条件
中心切割二维超高效液相色谱流路图见图1。
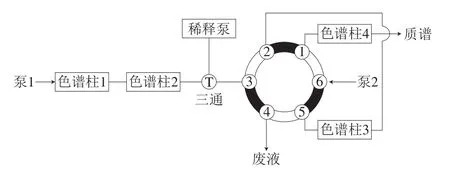
图1 中心切割二维超高效液相色谱流路图Fig.1 Schematic illustration of heart-cutting two-dimensional liquid chromatography
第1维:保护柱Hypercarb PGC(4.6 mm×10 mm,5 μm,色谱柱1),色谱柱为Hypercarb PGC(2.1 mm×100 mm,3 μm,色谱柱2),柱温40 ℃,流动相A:0.2%甲酸溶液,流动相B:乙腈;进样体积10 μL。515稀释泵的溶剂为乙腈。梯度洗脱程序见表1。
第2维:捕集柱为XBridge BEH Amide guard column(4.6 mm×10 mm,2.5 μm,色谱柱3),分析柱为Acquity BEH Amide(2.1 mm×100 mm,1.7 μm,色谱柱4)柱温40 ℃,流动相A:0.1%甲酸-乙腈溶液,流动相B:0.1%甲酸溶液。梯度洗脱程序见表1。
1.3.3 质谱条件
电喷雾离子源,正离子扫描方式,多离子监测触发的增强子离子扫描(multiple reaction monitoringinformation dependent acquisition-enhanced product ion scanning,MRM-IDA-EPI)模式。离子化电压:5 500 V,离子源温度:600 ℃,气帘气压强:276 kPa,喷雾气压强:345 kPa,辅助加热气压强:414 kPa,碰撞器:High。TTX的定量离子对为m/z320.0/302.2,定性离子对为m/z320.0/162.2,去簇电压均为150 V,碰撞能量分别为32 eV和50 eV。增强子离子扫描参数:扫描速率10 000 Da/s,扫描范围m/z100~340,动态阱集时间不大于1 ms,增强子离子扫描碰撞能量:30、40 eV和50 eV。
运行开始时,第2维色谱柱流出液经六通切换阀切换至废液,6.00 min后再切换至离子源,质谱开始采集数据直到7.00 min结束,同时六通切换阀又将柱流出液切换至废液中。
2 结果与分析
2.1 质谱条件选择
在电喷雾正离子检测方式下对质谱测定条件进行优化,Q1扫描时可见[M+H]+峰,然后对准分子离子峰进行碰撞,通过子离子扫描得到TTX碎片离子信息,然后再对去簇电压、碰撞能量等参数进行优化,使得分子离子对的信号达到最强,选择两对分子离子对,以响应相对较强的子离子作为定量离子,另一子离子作为定性离子。同时设定合适的峰驻留时间确保色谱峰的采样点数在15~20点,从而得到较好的定量重复性。优化后的测定条件见1.3.3节。
三重四极杆/复合线性离子阱质谱,既保留三重四极杆质谱较好的选择性与灵敏度,又增加了线性离子阱增强子离子扫描功能,采用电喷雾正离子模式MRM-IDAEPI模式,一次进样可以同时得到用于定量的MRM色谱图和用于定性的增强子离子扫描质谱图,利用标准物质自建增强子离子扫描谱库,检测时可以通过谱库检索技术对被检出化合物进行确证,提高了方法的定性能力,有利于复杂基体中痕量目标化合物的定性,可以避免假阳性结果。图2为含有0.008 mg/kg TTX的织纹螺样品的增强子离子扫描谱图,谱库检索的TTX符合率为92.2%。
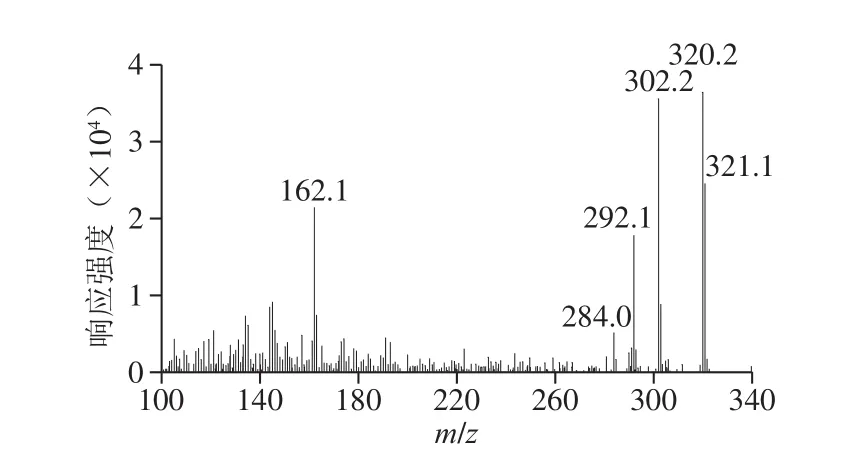
图2 织纹螺中TTX的增强子离子扫描谱图Fig.2 Enhanced product ion scan spectra of tetrodotoxin in Nassarius
2.2 中心切割二维色谱条件的选择与优化
TTX属强极性化合物,在常规反相色谱柱上不保留或保留很弱,目前多采用酰胺型亲水色谱柱进行分离[14,16-18,24-27],实验选用Acquity UPLC BEH Amide色谱柱作为第2维色谱柱进行分离。采用亲水色谱法进行分离时,TTX易受基质成分影响,表现为保留时间不稳定,基质抑制效应较严重[14]。为了去除基质成分增加了一维分离,采用Acquity UPLC HSS T3、Agilent Zorbax SB-Aq和Thermo Fisher Hypercarb色谱柱作为第1维分离柱,结果显示只有Hypercarb色谱柱能够较好保留TTX,以0.2%甲酸溶液作为流动相时TTX的保留时间为2.68 min(保留因子约为0.5)(图3),因此选择Hypercarb色谱柱作为第1维分离柱,采用中心切割的方式去除基质杂质,既可减少ME,又可确保第2维分离TTX时保留时间稳定。为了确保TTX切割完全,增加方法的耐受性,适当加大切割时间的区间,经过实验中心切割时间最终确定为2.20~3.20 min。若单纯采用Hypercarb色谱柱进行TTX的分离,由于保留不强,易受基质成分影响,质谱信号抑制明显,将第1维色谱柱流出的含有TTX的流分通过六通阀切换至捕集柱(XBridge BEH Amide guard column),Amide柱保留TTX的机理为亲水色谱分离机理,由于此时第1维流动相0.2%甲酸溶液为Amide柱的强洗脱流动相,TTX不能被Amide柱保留,必须泵入高比例的乙腈(弱洗脱流动相),TTX才能被Amide柱保留,因此选择515泵泵入高比例的乙腈通过三通先与第1维色谱柱切割的流分混合后,再流入Amide捕集柱,TTX就可被捕集在捕集柱的柱上,实验分别以0.50、1.00、2.00、3.00 mL/min泵入乙腈,结果显示当乙腈流速不低于2.00 mL/min时,TTX可被Amide完全捕集在柱头,洗脱出来的色谱峰窄而高,故后续实验乙腈流速选用2.00 mL/min。当TTX捕集完成后,六通阀将捕集柱反向切入第2维色谱系统,流动相将捕集在柱头的TTX洗脱入Amide分析柱中进行分离,此时TTX得到聚焦,洗脱色谱峰比较窄,检测灵敏度高,保留时间稳定,见图4。优化二维色谱条件见1.3.2节。
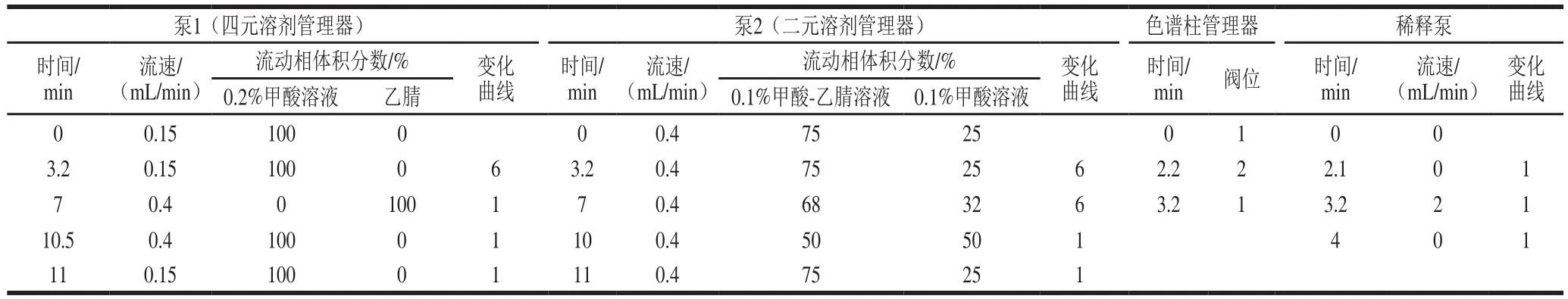
表1 超高效液相色谱梯度洗脱条件及阀切换时间Table 1 UPLC gradient elution conditions and valve switching program
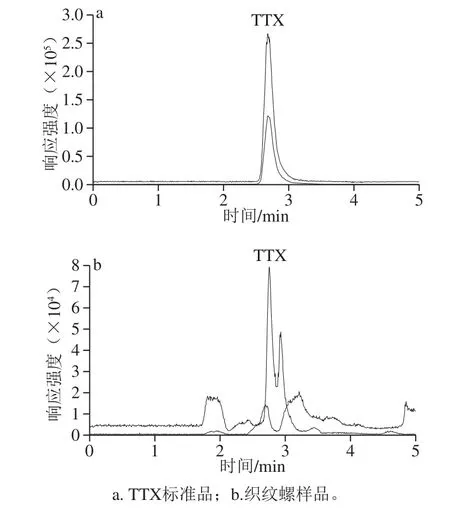
图3 第1维液相分离MRM色谱图Fig.3 First-dimensional MRM chromatograms
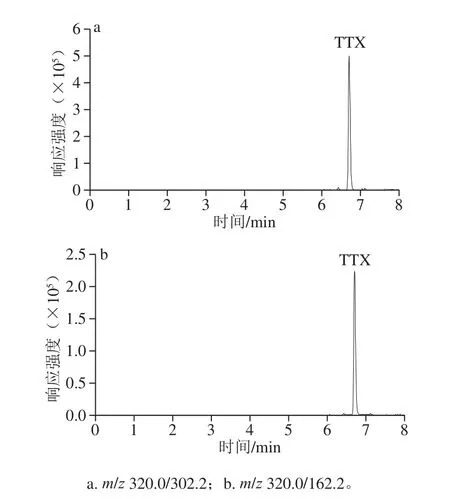
图4 TTX二维超高效色谱MRM图Fig.4 MRM chromatograms of TTX (1.0 μg/L) by two-dimensional UPLC
2.3 样品前处理条件的优化
TTX不溶于水和一般有机溶剂,但在酸性条件下,可溶于水和甲醇。目前文献报道的提取方法主要有酸性水溶液和酸性甲醇溶液,考虑到提取效率以及提取液与第1维色谱柱分离条件的匹配性,选择0.2%乙酸溶液作为提取剂进行2 次提取,TTX提取效率可达98%以上[14,28]。
水产品中TTX净化方法主要有:反相固相萃取结合超滤法[10]、石墨化碳黑固相萃取法[14]和免疫亲和柱净化法[16-18]等。反相固相萃取结合超滤法净化效果不好,ME非常严重;石墨化碳黑固相萃取法净化后,水产品中TTX的基质抑制效应在40%~50%左右,定量时要采用基质标准进行匹配,在实际样品测定时,当一批样品由多个不同类型样本组成时,采用基质标准匹配时工作量大;免疫亲和柱净化效果好,水产品中TTX基本不呈基质抑制效应,可以采用溶剂标准定量,但免疫亲和柱价格高,易受柱容量等因素限制,线性范围比较窄[16-18]。
本法采用中心切割二维色谱法进行净化和分离,在第1维Hypercarb色谱柱分离时可将TTX与大部分基质成分分离,中心切割时只将含有TTX的流分切入第2维的色谱柱进行分离,由于本法两维的分离机理分别为反相色谱和亲水色谱,具有一定的正交性,第1维切割的TTX流分中含有的基质成分在第2维色谱柱上与TTX得到较好地分离,经过实验将样品提取液再稀释10 倍后进行测定,基质抑制效应很小。选取贻贝、花蛤、香螺、织纹螺和河豚鱼肉进行ME评估,在样品提取液中加入适量的标准溶液制成基质匹配标准溶液系列(0.02~20 μg/L)进行测定,将基质匹配标准曲线的斜率除以溶剂标准曲线(0.02~20 μg/L)的斜率再乘以100%作为样品的ME[29],当ME<100%,表现为基质抑制效应,当ME>100%,表现为基质增强效应,当ME=100%,表现为无ME,结果见表2,样品的ME在88%~95%之间,表明不存在明显的ME,可以采用溶剂标准外标法定量[30],因此无需进行基质匹配,方便操作,又能得到准确结果。
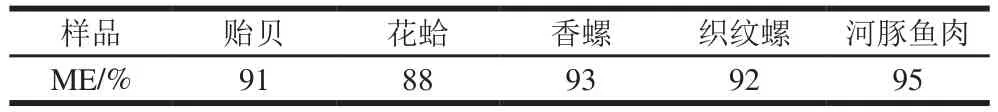
表2 水产品中TTX的METable 2 Matrix effects of TTX in aquatic products
2.4 方法的分析性能
2.4.1 标准曲线、检出限和定量限
将TTX标准品溶液用0.2%乙酸溶液稀释成分别含0.02、0.05、0.1、0.5、1.0、10 μg/L和20 μg/L的TTX系列标准溶液进行测定,采用MultiQuant(Ver.3.0)定量软件进行数据处理,以定量离子对的峰面积(y)对标准系列质量浓度(x,μg/L)进行回归(权重取1/x),TTX在0.02~20 μg/L质量浓度范围内回归方程为y=1.18×106x+8 582,相关系数优于0.999,符合线性关系的要求。
在空白样本中加入系列低质量浓度的TTX按本法测定,以两对分子离子对的RSN≥3时对应的样品质量浓度作为检出限,RSN≥10时对应的样品质量浓度作为定量限,实验测得样品的检出限为0.000 7 mg/kg,定量限为0.002 mg/kg,定量上限为2.0 mg/kg,高质量浓度样品需稀释后再行测定。
2.4.2 方法的精密度和加标回收实验
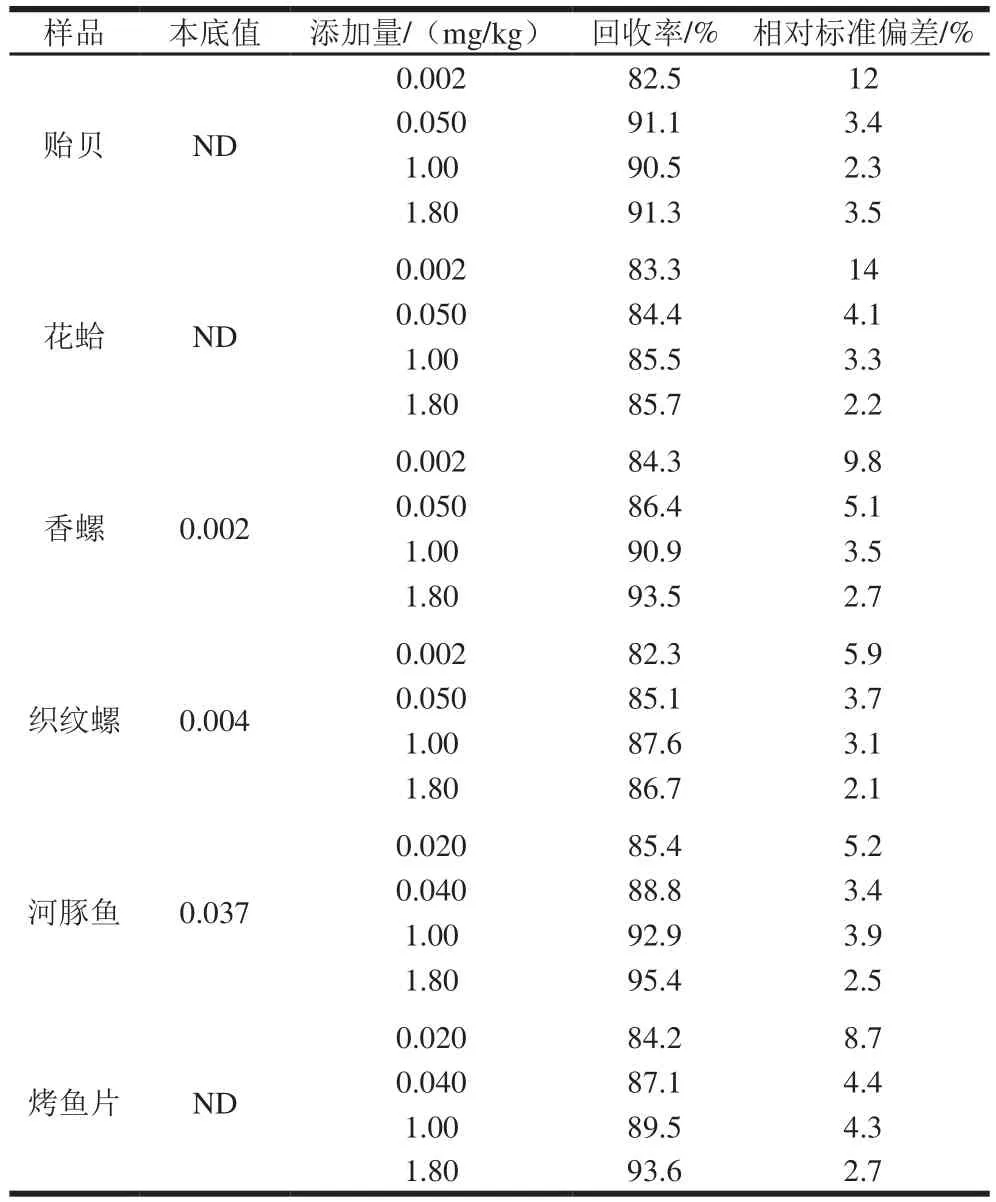
表3 水产品中TTX加标回收率和精密度(n=6)Table 3 Recoveries and RSDs of tetrodotoxin in aquatic products (n= 6)
选取不含TTX或含低含量TTX的贻贝、花蛤、香螺、织纹螺、河豚鱼肉和烤鱼片进行加标回收和精密度实验,样品中添加了不同质量浓度的标准溶液后,放置过夜,使待测成分与样品基体成分相互作用达到平衡,再按样品前处理方法进行操作,其回收率和精密度结果见表3。样品的加标回收率分别为82.3%~95.4%,相对标准偏差在2.1%~14%之间,符合痕量分析的要求。
2.5 实际样品的分析
采用本法在4 a时间内共测定291 份水产品及其制品。贻贝、花蚶、牡蛎、扇贝、花蛤、文蛤等80 份贝类样品中有1 份白蛤和2 份文蛤检出TTX,含量分别为0.022、0.008 mg/kg和0.007 mg/kg;40 份香螺均检出TTX,含量为0.002~0.296 mg/kg;118 份烤鱼片中有26 份检出TTX,含量为0.002~2.55 mg/kg;53 份织纹螺均检出TTX,含量为0.003~64.1 mg/kg,其中有10 份织纹螺中TTX的含量在7.9~64.1 mg/kg之间,存在中毒隐患。
3 结 论
本研究建立了中心切割二维超高效液相色谱-三重四极杆/复合线性离子阱质谱法快速测定水产品及其制品中TTX的方法。通过二维色谱分离系统的优化,达到较好的样品净化和分离效果,基本消除了样品ME,简化了样品前处理操作,简便快速;通过对质谱检测条件的优化,得到了较高的检测灵敏度;采用MRM-IDA-EPI模式,一次进样可以同时得到用于定量的MRM色谱图和用于定性的二级扫描质谱图,提高了定性能力,有利于复杂基体中痕量目标化合物的定性;采用溶剂标准外标定量,结果准确、重复性好,已应用于实际样品的测定取得满意结果。

