QuEChERS-同位素稀释-气相色谱-串联质谱同时测定植物油中16 种邻苯二甲酸酯
曾少甫,胡长鹰,冯志强
(1.广东省食品工业研究所有限公司,广东 广州 511442;2.广东省食品质量监督检验站,广东 广州 511442;3.暨南大学食品科学与工程系,广东 广州 510632)
邻苯二甲酸酯(phthalate esters,PAEs)通常简称为塑化剂。由于PAEs可提高塑料聚合物的柔韧性和耐久性[1],被大量的添加在塑料中改善塑料特性[2-3],是塑料中最常用、使用量最大的增塑剂。从结构上看,PAEs仅通过与聚合物链的弱二次分子相互作用增加其柔韧性,未与乙烯基聚合物基质共价结合,易从高聚物母体中迁移出来,如从塑料中迁移到土壤和水中,间接影响作物;或直接从食品接触材料迁移进入食物和饮料中,对人体产生安全隐患[4-5]。迄今为止,PAEs已造成一定的环境污染,同时也成为食品的主要污染来源之一[6-8]。许多研究已表明,PAEs可能有生殖毒性、致癌作用、心脏毒性、肝毒性和肾毒性[9-12],同时,也被国际癌症组织划分为2B类致癌物。
食用油是人类饮食中最重要的一部分,由于PAEs具有亲脂性[13],因此油脂在生产加工过程中易受到PVC管、塑料贮存容器和包装材料的容器中PAEs的污染[14-15],这些污染给人们健康造成了严重的风险。欧盟现已制定了法规,对食品接触材料内PAEs类向食品中的迁移限量要求,其最大残留限量为邻苯二甲酸二(2-乙基己基)酯(bis(2-ethylhexyl) phthalate,DEHP)1.5 mg/kg、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)0.3 mg/kg、邻苯二甲酸苄基丁基酯(butyl benzyl phthalate,BBP)30 mg/kg和己二酸二(2-乙基己基)酯18 mg/kg[16]。根据卫生部增塑剂限量通知[17],我国现有标准规定仅将DEHP、DBP和邻苯二甲酸二异壬酯的最高残留量分别设定为1.5、0.3、9.0 mg/kg,相关法律法规需要进一步完善。
目前,针对PAEs的前处理方法主要有固相萃取法(solid-phase extraction,SPE)和凝胶色谱法。Guo Zhiyong等[18]采用SPE法结合气相质谱测定火腿肠中6 种PAEs。Cavaliere等[6]使用气相质谱-串联质谱法,配合凝胶色谱法检测橄榄油中6 种PAEs。但是,2 种操作过程均较繁琐、耗时长、有损失,且塑料SPE小柱有潜在的塑化剂污染。QuEChERS(quick, easy, cheap, effective, rugged,and safe)最早由Anastassiades等[19]提出,其方法提高了提取的质量和实验效率,基质适用范围广[7,20-21],现已广泛应用于食品安全检测,取得良好的效果[22]。董蔚等[23]采用QuEChERS,结合气相色谱-质谱联用技术检测大麦中14 种PAEs类。Socas-Rodríguez等[24]用气相色谱-串联质谱法测定不同婴儿食品中PAEs的含量。但是,迄今为止针对检测食用油中PAEs的QuEChERS检测方法的报道还相对较少。本研究利用QuEChERS对样品前处理净化方面进行优化,内标法定量,建立气相色谱-串联质谱法,检测食用油中16 种PAEs,并对方法中食用油的基质效应(matrix effect,ME)影响进行评估,以期为植物油中PAEs类检测提供依据。
1 材料与方法
1.1 材料与试剂
玉米油、花生油、葵花籽油均购自某油脂公司,经检测为阴性样品。
16 种PAEs标准品:邻苯二甲酸二甲酯(dimethyl phthalate,DMP,纯度99.0%)、邻苯二甲酸二乙酯(diethyl phthalate,DEP,纯度≥99.0%)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP,纯度≥98.5%)、DBP(纯度≥99.0%)、邻苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethyl) phthalate,DMEP,纯度≥98.0%)、邻苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl) phthalate,BMPP,纯度≥99.0%)、邻苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl)phthalate,DEEP,纯度≥99.0%)、邻苯二甲酸二戊酯(dipentyl phthalate,DPP,纯度≥97.0%)、邻苯二甲酸二己酯(dihexyl phthalate,DHXP,纯度≥98.0%)、BBP(纯度≥98.0%)、邻苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethyl) phthalate,DBEP,纯度≥99.5%)、邻苯二甲酸二环己酯(dicyclohexylphthalate,DCHP,纯度≥99.9%)、DEHP(纯度≥98.0%)、邻苯二甲酸二苯酯(diphenyl phthalate,DPHP,纯度≥99.9%)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP,纯度≥99.0%)、邻苯二甲酸二壬酯(dinonyl phthalate,DNP,纯度≥97.0%) 北京曼哈格生物科技有限公司。
16 种PAEs氘代同位素:氘代邻苯二甲酸二甲酯(dimethyl phthalate-3,4,5,6-D4,D4-DMP,纯度98.6%)、氘代邻苯二甲酸二乙酯(diethyl phthalate-3,4,5,6-D4,D4-DEP,纯度99.8%)、氘代邻苯二甲酸二异丁酯(di-iso-butyl phthalate-3,4,5,6-D4,D4-DIBP,纯度99.0%)、氘代邻苯二甲酸二正丁酯(di-n-butyl phthalate-3,4,5,6-D4,D4-DBP,纯度99.0%)、氘代邻苯二甲酸二(2-甲氧基)乙酯(bis(2-methoxyethyl) phthalate-3,4,5,6-D4,D4-DMEP,纯度99.7%)、氘代邻苯二甲酸二(4-甲基-2-戊基)酯(bis(4-methyl-2-pentyl)phthalate-3,4,5,6-D4,D4-BMPP,纯度99.0%)、氘代邻苯二甲酸二(2-乙氧基)乙酯(bis(2-ethoxyethyl) phthalate-3,4,5,6-D4,D4-DEEP,纯度99.1%)、氘代邻苯二甲酸二戊酯(di-n-pentyl phthalate-3,4,5,6-D4,D4-DPP,纯度99.6%)、氘代邻苯二甲酸二己酯(di-n-hexyl phthalate-3,4,5,6-D4,D4-DHXP,纯度99.8%)、氘代邻苯二甲酸丁基苄基酯(benzyln-butyl phthalate-3,4,5,6-D4,D4-BBP,纯度99.0%)、氘代邻苯二甲酸二(2-丁氧基)乙酯(bis(2-butoxyethyl)phthalate-3,4,5,6-D4,D4-DBEP,纯度98.6%)、氘代邻苯二甲酸二环己酯(dicyclohexyl phthalate-3,4,5,6-D4,D4-DCHP,纯度99.0%)、氘代邻苯二甲酸二(2-乙基)己酯(di-(2-ethylhexyl)phthalate-3,4,5,6-D4,D4-DEHP,纯度98.8%)、氘代邻苯二甲酸二苯酯(diphenyl phthalate-3,4,5,6-D4,D4-DPhP,纯度99.0%)、氘代邻苯二甲酸二正辛酯(di-n-octyl phthalate-3,4,5,6-D4,D4-DNOP,纯度99.0%)、氘代邻苯二甲酸二壬酯(di-n-nonyl phthalate-3,4,5,6-D4,D4-DNP,纯度97.1%) 北京曼哈格生物科技有限公司。
乙腈、正己烷(均为色谱纯) 美国Honeywell公司;丙酮(色谱纯) 天津市康科德科技有限公司;乙二胺-N-丙基硅烷(ethylenediamine-N-propylsilane,PSA:40~60 μm) 天津博纳艾杰尔科技有限公司;十八烷基硅烷键合硅胶(octadecyl bonded silica gel,C18:40~63 μm) 德国CNW科技公司;无水硫酸镁广州化学试剂厂;中性氧化铝(层析用) 上海五四化学试剂有限公司。
净化剂为PSA、C18、中性氧化铝按照比例搭配,在使用前需要在150 ℃烘箱中烘烤4 h,冷却至室温后密封保存备用。
1.2 仪器与设备
7890 B-5977B气相色谱-质谱仪 美国安捷伦科技有限公司;MS3 basic涡旋振荡器 德国IKA公司;3K15离心机 德国Sigma公司;Research plus移液器 德国Eppendorf公司。
1.3 方法
1.3.1 标准溶液的配制
1 mg/mL PAEs标准储备液:根据纯度分别准确称取16 种PAEs标准品各10 mg(精确至0.01 mg),用乙腈溶解定容至10.0 mL,于-18 ℃冰箱避光保存。
10 μg/mL PAEs标准工作液:准确量取PAEs标准储备液100.0 μL,用乙腈定容至10.0 mL,于-18 ℃冰箱避光保存。
10 μg/mLD4-PAEs内标工作液:根据纯度分别准确称取D4-PAEs标准品各10 mg(精确至0.01 mg),用乙腈溶液分别溶解定容至10.0 mL配制成1 mg/mL的内标标准储备液,准确量取100.0 μL内标储备液,用乙腈配溶液容至10.0 mL制成10 μg/mL的内标工作液,-18 ℃冰箱保存。
混合标准工作系列溶液配制:准确量取PAEs标准工作液,用乙腈溶液提取的样品空白基质提取液稀释成5、10、25、50、100、250、500 μg/L系列质量浓度的标准混合工作溶液,加入内标工作液,使内标质量浓度均为0.10 μg/mL,用于制作标准曲线。
1.3.2 气相色谱条件
色谱柱:Agilent HP-5MS(30 m×250 μm,0.25 μm);升温程序:起始温度60 ℃,保持1 min,以20 ℃/min的速率升温至220 ℃,保持1 min,再以5 ℃/min的速率升温至270 ℃,保持5 min,再以30 ℃/min的速率升温至290 ℃;进样方式为无分流进样,进样量为1 μL;进样口温度为260 ℃;辅助加热区为290 ℃;载气为氦气(纯度≥99.999%),流速1.0 mL/min;溶剂延迟6 min。
1.3.3 质谱条件
离子源温度230 ℃;四极杆温度150 ℃;电离方式为电子电离(高灵敏度源Xtr EI源);电子轰击能量为70 eV;扫描方式采用选择离子扫描(selected ion monitor,SIM)模式;定量方式为峰面积内标法定量,定量及定性离子见表1,SIM图谱见图1、2。
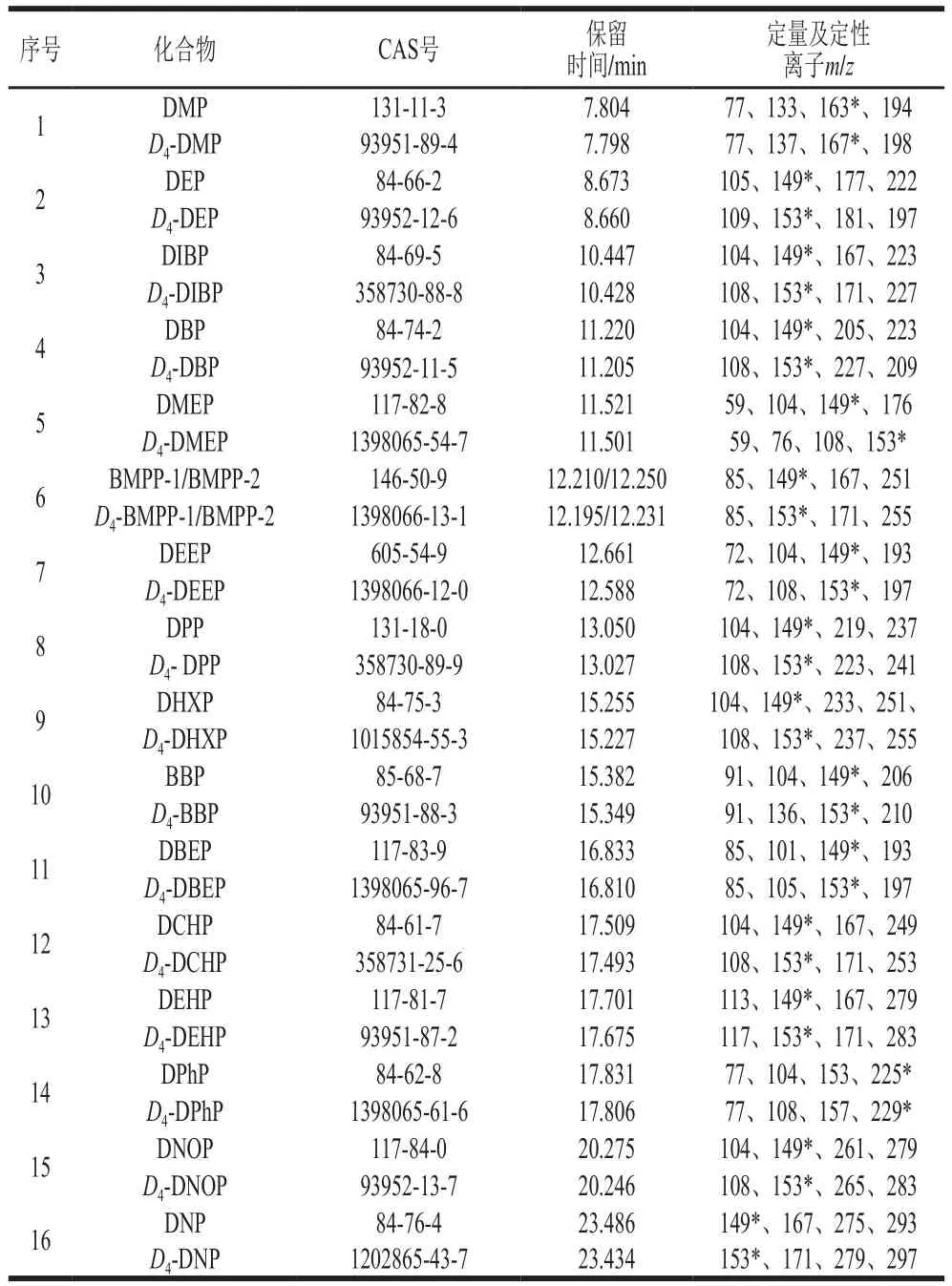
表1 16 种PAEs类化合物及氘代同位素内标保留时间和SIM参数Table 1 Retention times and SIM parameters for 16 PAEs and isotope internal standards
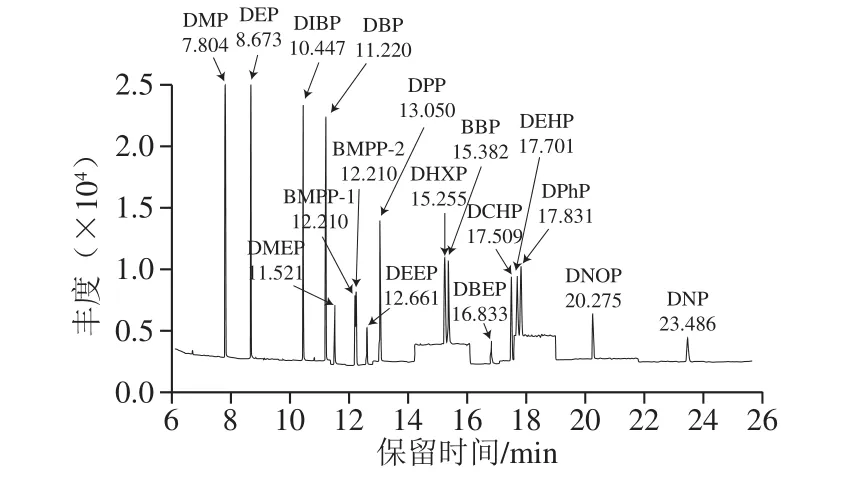
图1 16 种PAEs类化合物的SIM图谱(0.01 μg/mL乙腈)Fig.1 SIM chromatograms of 16 PAEs in acetonitrile (0.01 μg/mL)
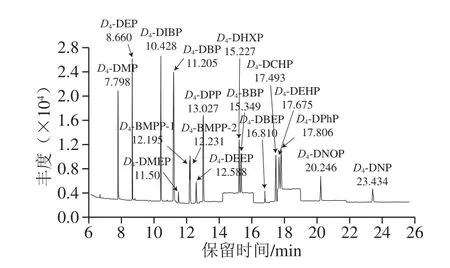
图2 16 种PAEs类同位素化合物的SIM图谱(0.01 μg/mL乙腈)Fig.2 SIM chromatograms of 16 PAE isotope compounds in acetonitrile (0.01 μg/mL)
1.3.4 QuEChERS样品前处理
为了避免塑化剂的干扰,实验过程中使用玻璃器皿,在洗净后,需用丙酮浸泡3 h,再将玻璃器皿在150 ℃烘箱中烘烤4 h,冷却至室温备用。
均匀称取样品0.5 g(精确到0.01 g)于10 mL具塞玻璃离心管中,加入10 μL内标工作液,充分混匀,加入2 mL正己烷(与乙腈饱和)溶解样品,涡旋30 s后加入4 mL乙腈(与正己烷饱和)提取,涡旋振荡一定时间,超声10 min,4 500 r/min离心5 min。弃去正己烷层,以乙腈层作为待净化液。
将待净化液转移到玻璃净化管中,依次加入无水MgSO4、净化剂。涡旋充分混匀1 min,然后在4 500 r/min离心5min,取上清液于1 mL进样瓶中,进行气相色谱质谱分析。
1.3.5 提取效果评价
以加标回收的回收率作为指标评价提取效果[25]。
1.3.6 ME评价
由于基质组分在色谱柱中的与待测组分的共洗脱可以抑制或增强分析物信号,进而影响定量结果。在该研究中,为了评估ME,将在基质匹配校准中获得的斜率与在标准溶液校准中获得的斜率进行比较,并计算每种PAEs的基质/溶剂的斜率比[21]。使用下式计算ME:
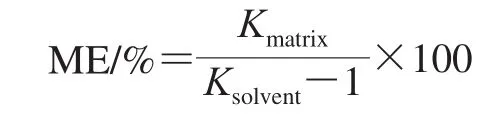
式中:Kmatrix为植物油基质匹配标准曲线斜率;Ksolvent为纯乙腈溶液配制的标准曲线斜率。
1.4 数据统计分析
Agilent GC-MS MassHunter工作站进行数据分析,实验数据统计分析采用SPSS(Version 19.0)进行进行数据处理。Duncan多重比较检验法进行显著性分析(P<0.05)。采用OriginPro 8.0作图,结果以 ±s表示。
2 结果与分析
2.1 提取试剂的优化
根据已有文献研究[13,26-27],PAEs可用二氯甲烷、正己烷、乙腈和丙酮提取。本实验使用乙腈(饱和正己烷)提取PAEs,这是基于脂肪在乙腈中的弱溶解度,分层效果好,同时一些干扰物质从植物油中被提取出来,例如甘油三酯、脂肪酸、色素等[28],因此提取物需要进一步净化。由于植物油中甘油三酯占比大,用乙腈提取会造成共萃物多,干扰严重,而正己烷易于溶解甘油三酯,是最常用的去油脂溶剂,因此在乙腈提取前先加入正己烷(饱和乙腈),再通过高速离心减弱乙腈相中的甘油三酯,达到一定的净化效果。
2.2 提取时间的优化
涡流搅动能加速萃取溶剂分散到液体样品中,从而提高了提取效率[29]。依照1.3.4节的步骤做加标回收实验(加标量为0.3 mg/kg),在旋转速率3 000 r/min下研究了不同的涡旋时间(0.5、1.0、2.0、4.0 min)的加标回收效果。如图3所示,在0.5~2 min时间内,随着涡旋时间的延长,回收率增加,并在2 min后趋于稳定。当涡旋时间为2 min时,16 种PAEs的回收率保持在90.56%~100.97%,当到4 min时,回收率达到90.03%~100.86%,已平衡稳定。因此选择2 min作为最佳涡旋时间。
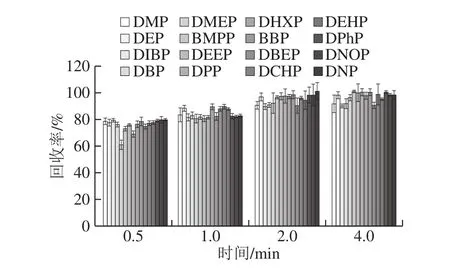
图3 提取时间对玉米油中16 种PAEs回收率的影响(n=6)Fig.3 Effect of extraction duration on the recoveries of 16 PAEs from corn oil (n = 6)
2.3 提取溶剂体积的优化
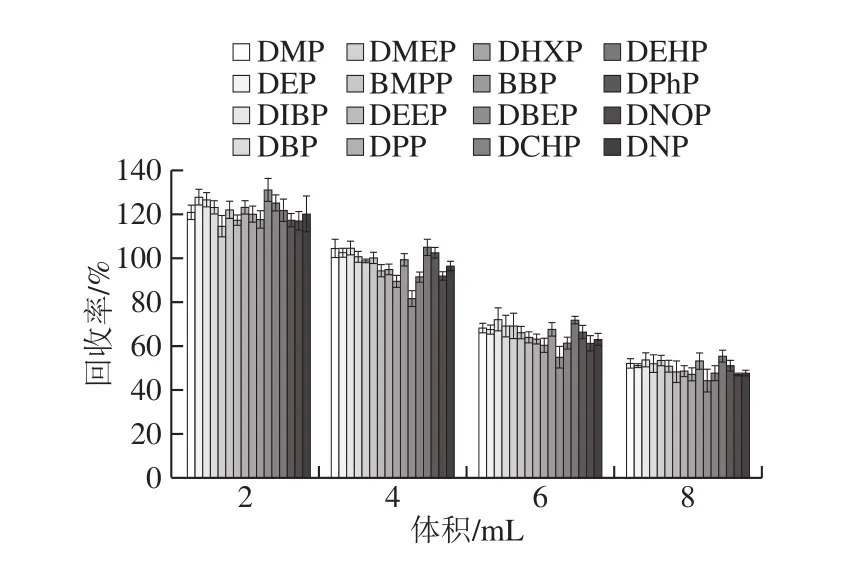
图4 提取溶剂体积对玉米油中16 种PAEs回收率的影响(n=6)Fig.4 Effect of extraction solvent volume on the recoveries of 16 PAEs from corn oil (n = 6)
如图4所示,随着乙腈用量增加,各PAEs的回收率显著降低(P<0.05)。当乙腈用量为2 mL时,其回收率高达为114.45%~130.90%。当用量为8 mL时,其回收率仅为44.26%~55.51%。提取溶剂体积4 mL获得最佳回收率,在81.78%~104.90%之间。
2.4 净化剂的选择
如果乙腈提取物未经进一步净化,其中的脂肪酸,多酚化合物和色素会干扰PAEs的测定,并且随着注射次数的增加,柱效会降低,色谱峰也会拖尾,仪器灵敏度会下降[28]。目前QuEChERS方法的净化剂有C18吸附剂、PSA、中性氧化铝等。按1.3.4节方法进行QuEChERS前处理提取,样品加标量为0.3 mg/kg。分别使用PSA(100 mg/mL)、C18(100 mg/mL)、PSA+C18(50+50 mg/mL)和中性Al2O3(100 mg/mL)并结合100 mg/mL MgSO4的4 种不同组合方式进行净化,比较不同组合方式16 种PAEs的回收率作来确认最佳的吸附剂。如图5所示,C18的PAEs回收率在76.49%~129.31%,PSA回收率为60.21%~127.75%,Al2O3回收率为51.72%~121.87%,当使用PSA+C18萃取效率最高,16 种PAEs的回收率在76.56%~108.84%之间,满足检测要求。因此选择PSA+C18作为最优净化剂。
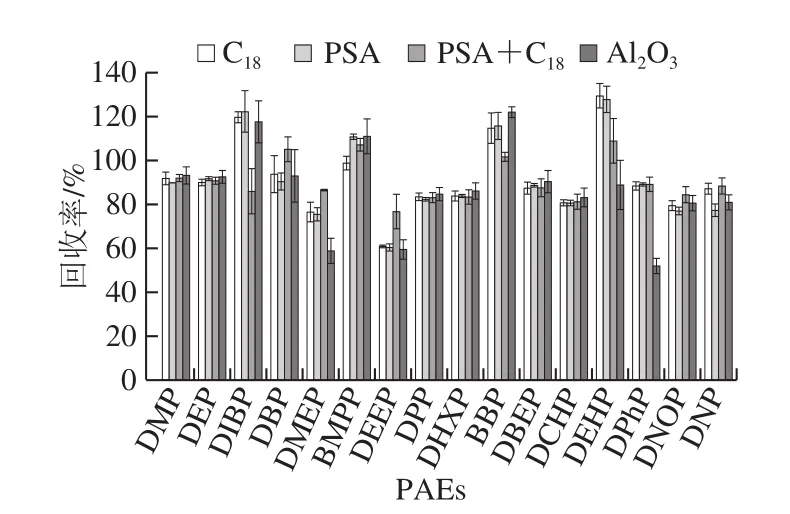
图5 净化剂的选择对回收率的影响(n=6)Fig.5 Effect of purification adsorbents on the recoveries of 16 PAEs (n = 6)
同时,取未加标的玉米油样乙腈提取物1 mL分别进行了25+25、50+50、100+100 mg比例的PSA+C18的净化,以全扫描模式进行分析和对比净化效果,其总离子流色谱图如图6所示。
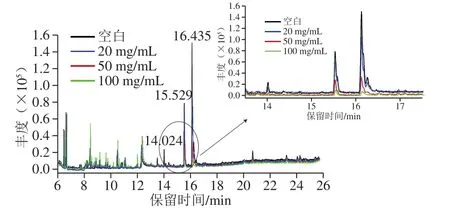
图6 不同比例PSA+C18净化后的玉米油样乙腈提取物的总离子色谱图Fig.6 Total ion current chromatograms of the purified corn oil acetonitrile extracts with different ratios of PSA + C18
主要峰在13.0~17.0 min被洗脱出来,通过NIST谱图搜索匹配,发现主要有2,3-丙三醇脂十八碳烯酸异酯(14.024 min)、单亚油酸甘油酯(15.529 min)、亚油酰甘油(16.435 min)。随着PSA和C18用量的增加,降低了玉米油乙腈提取物中的主要基质峰(保留时间13.0~17.0 min)(图6),说明PSA+C18对于洗脱出来的3 种酯类有一定的净化作用。根据相关文献,由于PSA具有伯胺和仲胺2 个基团,比其他氨基功能团吸附剂碳载量高,与含有羟基或羧基的化合物形成氢键,能有效地去除脂肪酸和非极性脂质共提取物[19-20]。而C18净化剂疏水性极强,能够有效去除脂肪酸和色素,同时对非极性化合物具有较强的吸附作用[30]。
2.5 净化剂用量的优化
吸附剂的量对净化的效果及目标物的回收率有不同影响(加标量为0.3 mg/kg)。本研究分别考察25、50、100、150 mg的PSA及C18净化每毫升玉米油乙腈提取物对16 种PAEs回收率的影响,结果如图7、8所示。
随着C18用量增加,各PAEs类塑化剂的回收率增加。对于DMEP、DEEP和DPhP 3 种PAEs塑化剂,当C18的用量为25 mg/mL时,其回收率为65.5%、54.7%和64.7%。当C18用量为100 mg/mL时,此时各PAEs有较好的回收效果,其回收率为72.2%~109.8%,因此最终选择添加100 mg/mL C18为最优用量。
PSA用量100 mg/mL和150 mg/mL的16 种PAEs回收率可达66.2%~110.4%和65.9%~121.5%。用量为25 mg/mL时,16 种PAEs回收率低于其他3 种用量时的回收率,为56.5%~91.2%。而50 mg/mL显示出相对更好的回收率,PAEs回收率为75.1%~108.2%,故选择PSA用量为50 mg/mL作为最优用量。
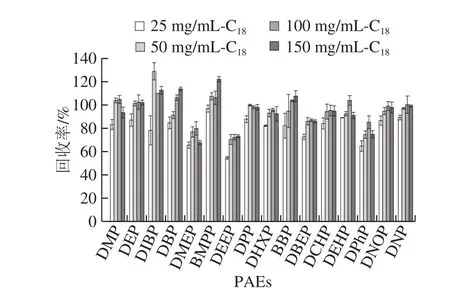
图7 C18用量对16 种PAEs回收率的影响(n= 6)Fig.7 Effects of C18 dosage on the recoveries of 16 PAEs (n = 6)
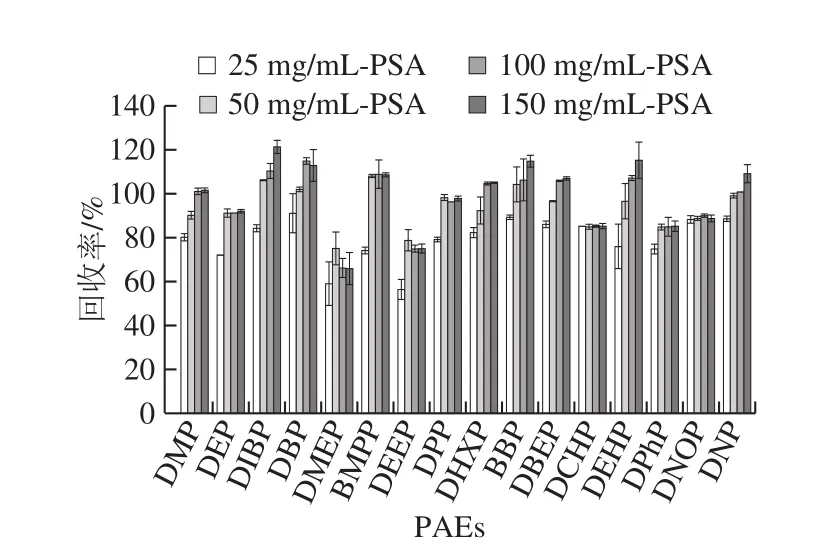
图8 PSA用量对16 种PAEs回收率的影响(n= 6)Fig.8 Effects of PSA dosage on the recoveries of 16 PAEs (n = 6)
2.6 方法的线性范围及检出限
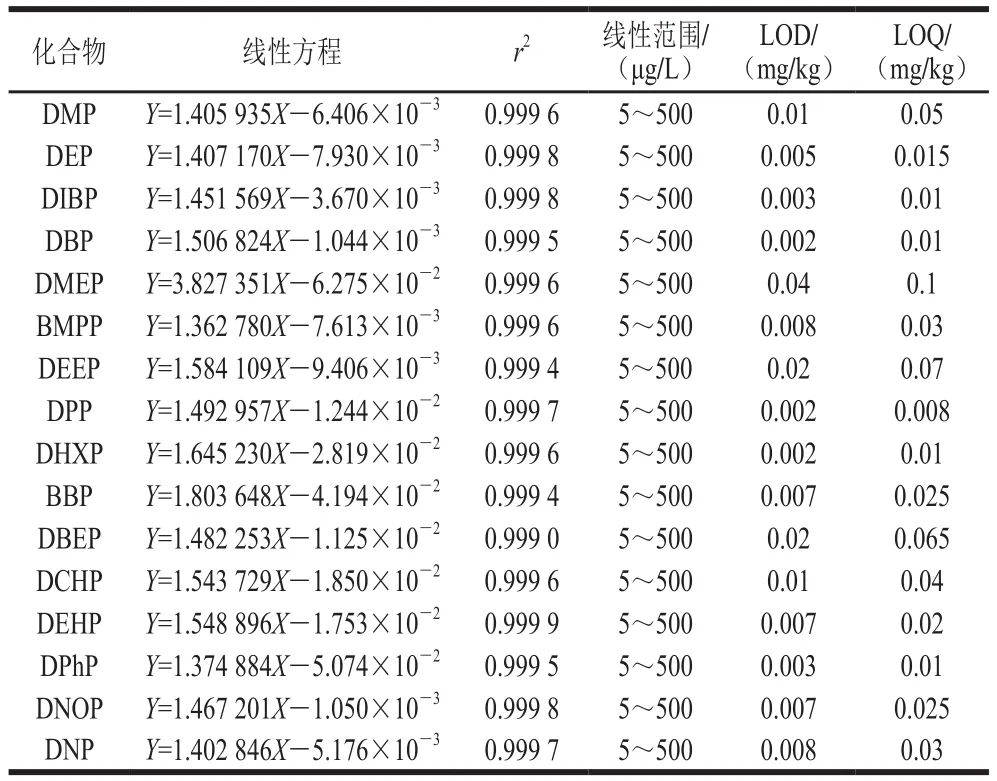
表2 16 种PAEs的线性方程、相关系数、线性范围、方法LOD和LOQTable 2 Linear equations, correlation coefficients, linearity range,LODs and LOQs of 16 PAEs
由于存在ME影响,采用基质匹配标曲法绘制标准曲线对消除ME有一定的影响。按照1.3.4节的前处理方法,以阴性玉米油样品提取液作为溶剂配制混合标准溶液,内标法定量。以1.3.1节中制备的混合标准溶液,形成系列水平的基质标准液。如表2所示,16 种PAEs在其线性范围内的线性关系良好,相关系数r2均大于0.999 0。以信噪比RSN≥3确定检出限(detection limit,LOD),信噪比RSN≥10确定定量限(quantification limit,LOQ),结果显示该方法的LOD在0.002~0.03 mg/kg之间,LOQ在0.008~0.1 mg/kg之间。
2.7 回收率实验
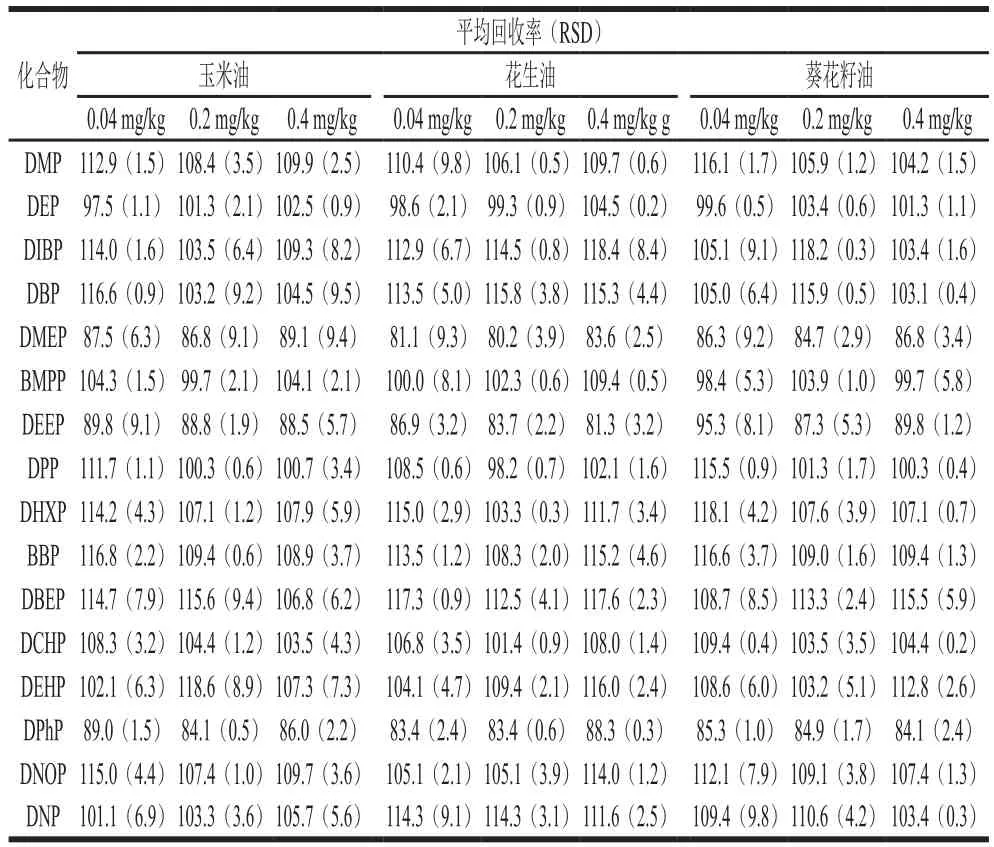
表3 16 种PAEs的加标平均回收率及精密度(n=3)Table 3 Average spiked recoveries and precision of 16 PAEs (n = 3)%
在空白植物油样品中分别添加16 种PAEs混合标准溶液,低、中、高3 个加标量分别为0.04、0.2、0.4 mg/kg,每个水平测试6 个平行样,并做一个样品空白。按1.3.4节的样品前处理方法以及优化好的QuEChERS方法进行提取和净化,测得平均回收率和精密度如表3所示,玉米油中16 种PAEs的加标回收率为81.1%~118.6%,RSD为0.5%~8.9%;花生油加标回收率为80.2%~118.4%,RSD为0.3%~9.8%;葵花籽油加标回收率在84.1%~118.2%之间,RSD在0.2%~9.8%之间;3 种基质的平均加标回收率为80%~120%,RSD均不超过10%。结果表明该方法具有良好的准确度和精密度,符合分析要求。
2.8 不同ME的影响
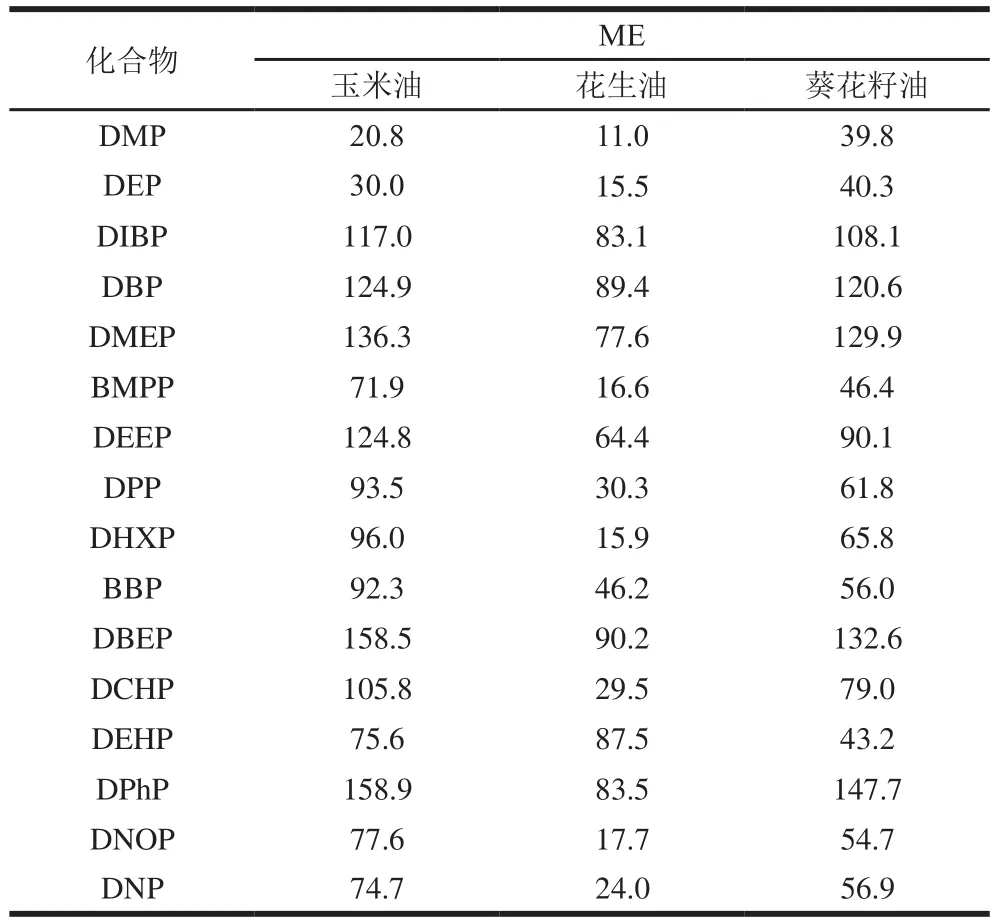
表4 3 种植物油中16 种PAEs的ME(n=3)Table 4 Matrix effects of 16 PAEs in three vegetable oils (n= 3)%
通过比较乙腈与基质匹配标准溶液,质量浓度范围为5.0~500.0 μg/L,不同ME的影响如表4所示,与乙腈中的目标分析物相比,16 种PAEs的目标分析物信号有一定的增强,为基质增强效应,当ME<20%为弱基质效应,ME在20%~50%为中等基质效应,ME>50%为强基质效应[31]。从基质来看,花生油受基质影响小于其他2 种植物油,ME值为11.0%(DMP)~90.2%(DBEP)。玉米受基质影响最大,14 种PAEs的ME值均大于另外2 种植物油,为20.8%(DMP)~158.9%(DPHP)。从各分析物来看,DIBP、DBP、DMEP、DEEP、DBEP和DPHP均受到3 种植物油强ME影响,ME值在54.7%~158.9%之间。为减少ME引起的误差,可以使用基质配标进行分析,获得的结果较准确和真实。
3 结 论
本研究建立了QuEChERS结合GC-MS法检测植物油中16 种PAEs残留量得分析方法,以16 种氘代同位素PAEs作为内标,配合空白基质标准工作液进行定量。采用乙腈为提取溶剂,提取溶剂体积为4 mL,提取时间为2 min,QuEChERS净化剂选择为C18和PSA,分别为100 mg/mL和50 mg/mL。对其进行3 种植物油加标实验,平均回收率在80.2%~118.6%范围内,RSD为0.2%~9.8%,LOD在0.002~0.03 mg/kg之间,LOQ在0.008~0.1 mg/kg之间,符合PAEs的分析要求。对玉米油、花生油、葵花籽油的ME进行分析,其ME在11.0%~158.9%之间,为基质增强效应。本研究采用基质匹配法绘制标准曲线,降低ME的影响。本方法高效、简便、快速,可作为植物油中16 种PAEs的定性和定量检测手段。

