低温条件下希氏乳杆菌Q19苹果酸-乳酸发酵特性及其对葡萄酒香气成分的影响
白雪菲,金 刚,刘 思,马 雯,张 众,王卉青,张军翔
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学葡萄酒学院,葡萄与葡萄酒教育部工程研究中心,宁夏葡萄与葡萄酒工程技术中心,宁夏 银川 750021)
葡萄酒的酿造主要包括2 个不同的发酵过程:由酵母菌完成的乙醇发酵和由乳酸菌完成的苹果酸-乳酸发酵(malolactic fermentation,MLF)[1-2]。MLF通过乳酸菌将L-苹果酸转化为L-乳酸,提高了葡萄酒的微生物稳定性,并且通过产生多种酶类水解挥发性物质前体释放出多种不同的香气物质,从而改善葡萄酒的香气结构,提高葡萄酒的品质[3-6]。
目前,生产中应用最广泛的MLF菌种为酒酒球菌(Oenococcus oeni),它具有优良的发酵特性和应对多种葡萄酒逆境胁迫的能力,但由于世界范围内少数几家商业酒酒球菌的广泛使用,使得本土微生物资源受到威胁,也带来葡萄酒的同质化等问题。特别是我国西部葡萄酒产区在11月份后正值MLF进行时气温迅速下降,在一些控温条件差的酒厂,利用传统商业乳酸菌进行MLF存在困难。宁夏贺兰山东麓酿酒葡萄种植区域面积广大,风土差异明显,有较丰富的酿酒微生物资源,开发利用本土酿酒微生物资源,不但可以突出葡萄酒的“风土”特征,而且可以逐步筛选出适合当地环境的酿酒微生物。
目前,关于苹果酸-乳酸细菌筛选的研究多集中于酒酒球菌[7-8],但有学者发现和酒酒球菌一样,乳杆菌(Lactobacillus)属中的希氏乳杆菌(L.hilgardii)同样具有启动和完成MLF的能力,并产生与酒酒球菌不同的香气物质[9]。然而,我国关于希氏乳杆菌的筛选及其对葡萄酒MLF影响的研究却鲜有报道。近年来,研究者对能在低温条件下完成MLF菌株的筛选越来越感兴趣[10-13]。Olguín等[14]对从Patagonian红葡萄酒中分离出的2 株酒酒球菌UNQOe4和UNQOe19分别进行低温MLF,结果表明这2 株酒酒球菌均能在18 ℃和21 ℃完成MLF,且完成这一过程的菌株可能属于嗜冷菌群。目前,低温发酵通常应用于乙醇发酵,并以此改善葡萄酒的品质,但关于低温条件下进行MLF对葡萄酒香气的影响尚未见报道。
本研究以从宁夏贺兰山东麓产区筛选出的1 株希氏乳杆菌Q19为研究对象,探究其在不同温度条件下的发酵性能及其对葡萄酒香气成分的影响,以期为希氏乳杆菌在低温发酵中的应用提供数据支持与参考。
1 材料与方法
1.1 材料与试剂
希氏乳杆菌Q19分离自宁夏贺兰山东麓青铜峡产区赤霞珠葡萄酒自然MLF过程中。
MRS培养基:蛋白胨10.0 g/L,牛肉浸粉8.0 g/L,酵母浸粉4.0 g/L,葡萄糖20.0 g/L,K2HPO32.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,吐温80 1.0 mL/L,加80%蒸馏水,调节pH 4.8,121 ℃灭菌20 min后,再加入20%苹果汁。
供试酒样:选用2017年宁夏贺兰山东麓产区乙醇发酵结束、未启动MLF的赤霞珠干红葡萄酒(乙醇体积分数14.6%,残糖3.04 g/L,pH 3.75)。
苹果酸试剂盒(L-Malic Acid Enology Enzymatic kit)乙酸、柠檬酸、L-乳酸、总酸、总糖试剂盒(Enology Enzymatic kit) 西班牙BioSystems SA公司。
1.2 仪器与设备
7890 B气相色谱-7000D质谱仪 美国Agilent公司;GL323l-1SCN电子天平、PB-10精密pH计 德国Sartorius公司;311 CO2培养箱 美国Thermo公司;LDZX-50FBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SHP-150B型生化培养箱 常州诺基仪器有限公司。
1.3 方法
1.3.1 菌种的准备
将保藏菌划线于MRS固体培养基,在28 ℃、厌氧条件下培养3 d。在MRS固体培养基上挑取菌落特征明显的单菌落接种于MRS液体培养基,于28 ℃、厌氧条件下培养72 h制成种子液。
1.3.2 MLF
将乙醇发酵结束后的赤霞珠葡萄酒酒样经0.2 μm孔径的过滤膜进行过滤除菌,将活化菌液以1%(V/V)接种量接种于250 mL葡萄酒中,未进行MLF(添加60 mg/L SO2且不接种菌液)相同容积的葡萄酒作为对照组,均做2 个重复。满瓶密封分别放置于10、15、20 ℃恒温培养箱中,每4 d取样。
1.3.3 理化指标测定
用平板计数法测定葡萄酒中的菌落总数;用苹果酸试剂盒检测L-苹果酸含量;L-苹果酸含量趋于稳定后用气相色谱-质谱测定各酒样的香气成分;乙酸、柠檬酸、L-乳酸、总酸、总糖在MLF前后用总糖试剂盒试剂盒检测。
1.3.4 香气成分的测定
采用顶空固相微萃取结合气相色谱-质谱仪对香气物质进行提取分析。将萃取头50/30 μm DVB/CAR/PDMS在250 ℃条件下老化10 min。取5.0 mL酒样于顶空瓶中,加入1.5 g NaCl及10.0 μL内标物4-甲基-2-戊醇,45 ℃保温5 min后将萃取头插入顶空瓶,45 ℃萃取35 min。
气相色谱-质谱条件:进样温度230 ℃,解吸8 min,不分流进样,载气为高纯氦气;流速1 mL/min;程序升温:初始温度40 ℃,恒温5 min,然后以3 ℃/min升至130 ℃,以2 ℃/min升至144 ℃,以5 ℃/min升至240 ℃,保持10 min。传输线温度和离子源温度分别为240 ℃和230 ℃,电子能量70 eV,扫描范围40~300 u。
定性:香气成分利用质谱全离子扫描模式下的总离子流图谱,依据色谱保留时间和质谱信息、NIST 标准谱库比对结果以及参考相关文献相结合的方法进行定性分析。
定量:采用内标法,各香气成分质量浓度计算公式如下:

1.4 数据处理及分析
采用Excel 2010进行数据处理,SPSS 20.0对数据进行单因素方差分析,利用Duncan检验对数据进行差异显著性分析(P<0.05,差异显著),对发酵酒样的香气物质进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 不同温度条件下MLF对葡萄酒理化指标的影响

表1 供试酒样MLF发酵前后理化指标Table 1 Physicochemical indexes of wine samples before and after MLF
从表1可以看出,在不同温度处理条件下,L-乳酸含量显著升高,说明菌株Q19可以使L-苹果酸脱羧生成L-乳酸。各处理MLF后葡萄酒中总酸含量都显著减少,15 ℃和20 ℃发酵总酸降低最为显著。挥发酸含量是判断葡萄酒健康状态的指标[15],也是评判乳酸菌发酵特性的指标,各处理均低于国家标准,其中15 ℃与其他处理组相比,挥发酸含量最低。另外,各处理组MLF后酒样中柠檬酸和总糖含量均有微量降低。
2.2 不同温度条件下MLF过程中菌密度变化
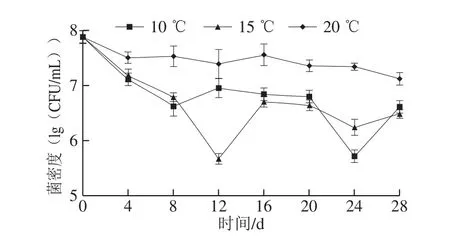
图1 不同温度发酵菌株Q19菌密度变化Fig.1 Changes in cell density of L.hilgardii Q19 during MLF at different temperatures
如图1所示,菌株Q19活化后接入葡萄酒中进行不同温度MLF,菌密度均呈现先下降后稳定的状态。从接种后到第8天,10、15 ℃与20 ℃发酵酒样相比,菌密度有明显的下降;接种8 d后,20 ℃发酵酒样的菌密度趋于稳定,并保持在107CFU/mL;而10、15 ℃发酵酒样的菌密度分别在发酵24 d和12 d呈现先下降后上升的趋势,最后趋于稳定并保持在106CFU/mL;在接种24 d后,各处理酒样的菌密度仍保持在106~107CFU/mL。
2.3 不同温度条件下MLF后葡萄酒中L-苹果酸含量的变化
如图2所示,菌株Q19接入葡萄酒中进行不同温度条件下的MLF,L-苹果酸含量均有所下降。接种后第8天,与初始L-苹果酸含量相比,10、15 ℃和20 ℃发酵酒样中L-苹果酸含量分别降低了17.5%、 40.6%和45%;在接种28 d后,10 ℃发酵酒样的L-苹果酸质量浓度仍有0.87 g/L,尽管菌密度保持在106CFU/mL,说明菌株Q19在10 ℃条件下MLF活性受到抑制;而15 ℃发酵酒样的L-苹果酸降到0.27 g/L,表现出了良好的L-苹果酸分解能力,表明菌株Q19在15 ℃条件下具有完成MLF的能力。
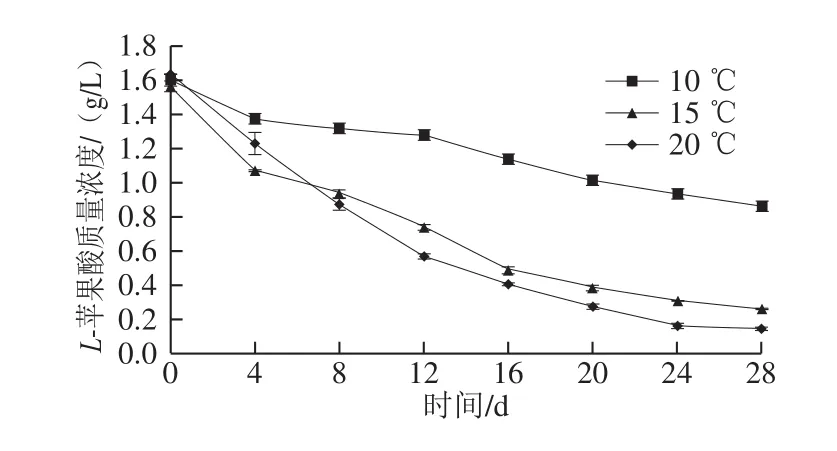
图2 不同温度发酵L-苹果酸含量变化Fig.2 Changes in L-malic acid content during MLF at different temperatures
2.4 不同温度条件下MLF后葡萄酒香气物质
如表2所示,酒样共检测到62 种挥发性化合物,包括18 种醇类,34 种酯类,3 种有机酸,3 种其他类化合物和4种萜烯类物质。其中未经MLF的酒样中香气物质检测总量和种类分别为217.48 mg/L和46 种,菌株Q19在10、15 ℃和20 ℃条件下进行MLF后,香气物质检测总量和种类数分别为182.55 mg/L和41 种、209.99 mg/L和52 种、194.66 mg/L和48 种。与未经MLF的酒样相比,各处理酒样香气物质检测总量均有所下降,但15 ℃和20 ℃处理显著增加了可检测物质的种类,其中15 ℃处理增加了正辛醇、庚酸乙酯、壬酸乙酯、乳酸乙酯、十一酸乙酯、正癸醛和萜烯类化合物含量,以及萜烯类化合物的种类。
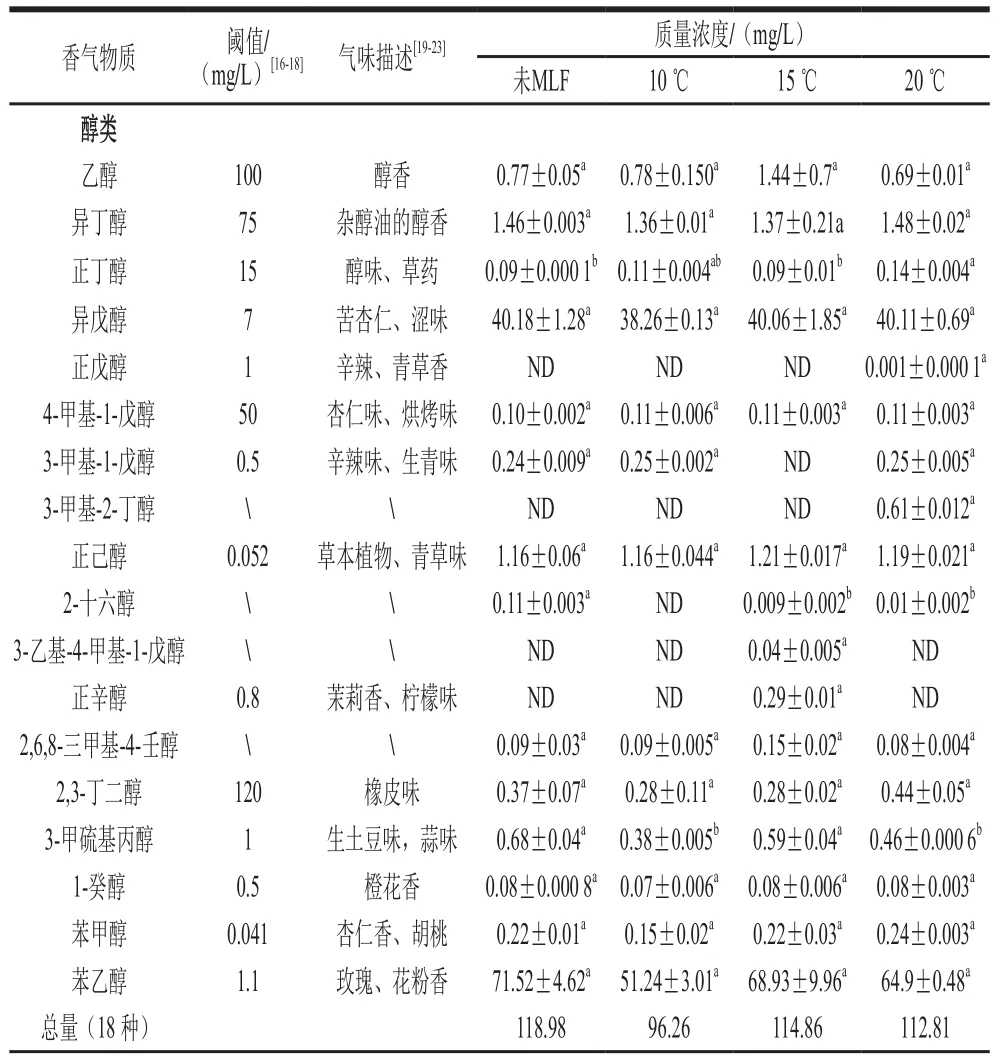
表2 不同温度条件MLF前后葡萄酒香气类别及含量Table 2 Types and contents of aroma components in wine before and after MLF at different temperatures
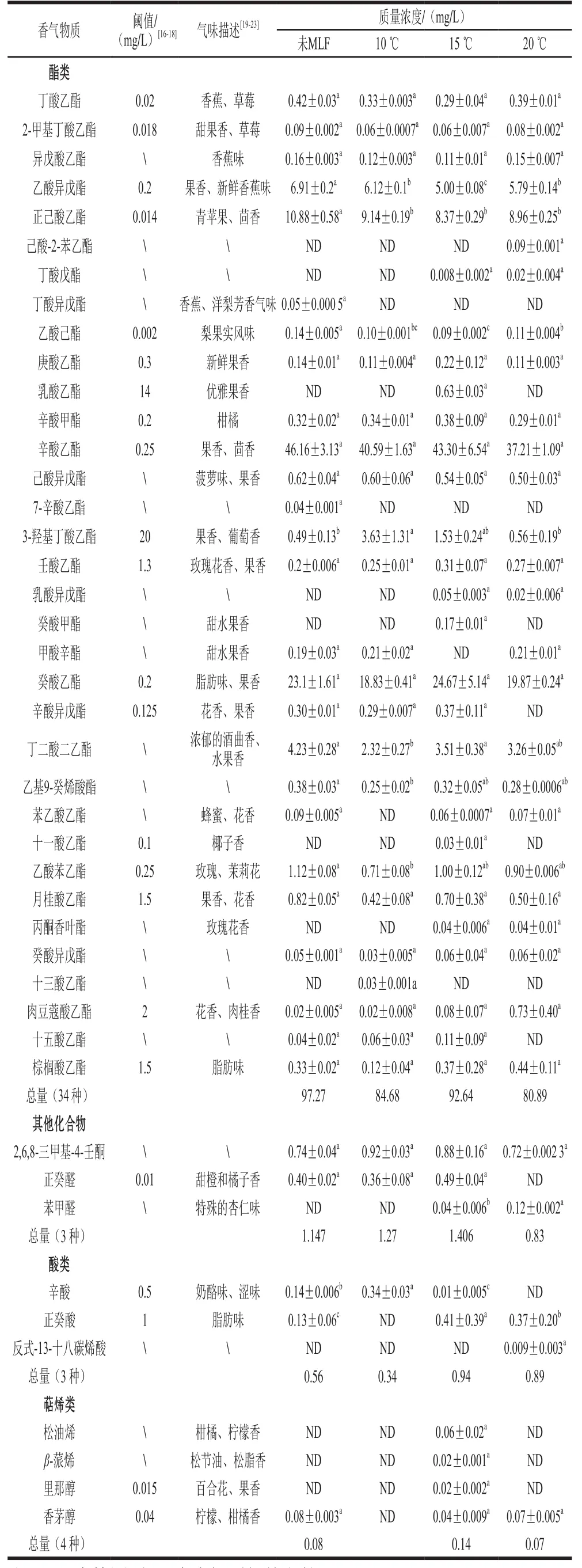
续表2
2.5 不同温度条件下MLF后酒样香气物质的PCA
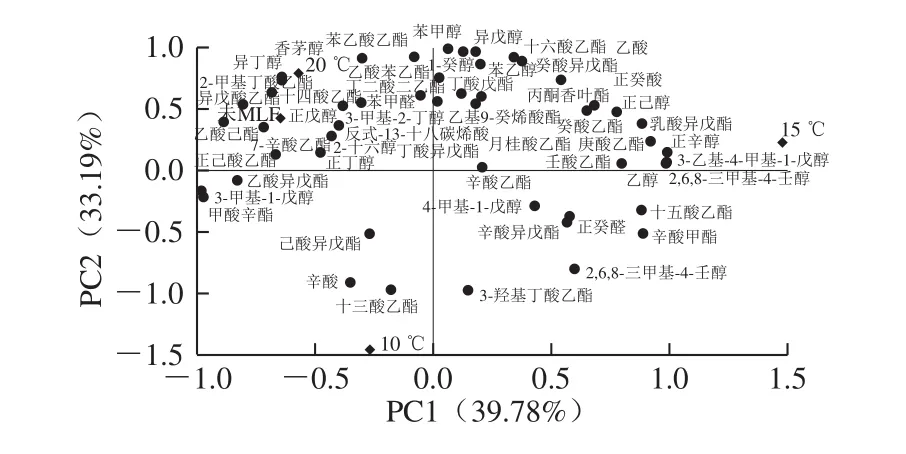
图3 不同香气物质在前2 个主成分上的载荷及处理酒样分布Fig.3 PC1 versus PC2 loadings plot for different aroma compounds with distribution of experimental and control samples shown in it
为了进一步分析不同温度条件下MLF对香气物质的影响,将供试酒样进行PCA,以特征值大于1为依据,提取2 个主成分,PC1(39.78%)和PC2(33.19%)的累计方差贡献率为72.97%。由图3可知,与PC1高度正相关的为庚酸乙酯、壬酸乙酯、乳酸乙酯、十一酸乙酯、正辛醇、里那醇、松油烯和β-蒎烯,而乙酸异戊酯、正己酸乙酯、甲酸辛酯和3-甲基-1-戊醇与PC1呈负相关;对PC2起贡献作用的香气物质主要有苯甲醇、苯乙醇、正癸醇、异戊醇和乙酸苯乙酯等,与辛酸、十三酸乙酯和3-羟基丁酸乙酯呈负相关。可以看出,发酵酒样中,15 ℃发酵酒样在PC1的正半轴得分最高,庚酸乙酯、乳酸乙酯、壬酸乙酯、十一酸乙酯、正辛醇、β-蒎烯、里那醇和松油烯含量较高,赋予葡萄酒独特的花香、果香,增加了其香气复杂性;20 ℃发酵酒样在PC2正半轴的得分较高,对其香气起贡献作用的物质主要是香茅醇和异丁醇;10 ℃发酵酒样在PC2的负半轴得分最高,辛酸和3-羟基丁酸乙酯含量较高,使其表现出较多的果香和脂肪味。
3 讨 论
希氏乳杆菌Q19在不同温度条件下进行MLF,柠檬酸和总糖含量均有少量降低,表明希氏乳杆菌Q19可以对糖、柠檬酸进行代谢[9],但本研究中不同温度条件下MLF后挥发酸没有显著升高;发酵温度对挥发酸含量影响不显著;总酸含量各处理组显著低于对照组,说明菌株Q19在MLF过程中具有一定的降酸能力。
菌株Q19接入葡萄酒中后,各处理酒样菌密度均呈现先下降后稳定的状态,在接种8 d后,各处理酒样的菌密度保持在106~107CFU/mL之间,与Lerm等[24]的研究结果基本一致,这主要是由于菌株细胞刚接入葡萄酒中后,其苛刻的环境导致乳酸菌的生长速率低于死亡速率,从而导致活菌的数量下降。在接种28 d后,15 ℃与20 ℃发酵酒样的L-苹果酸分别降到0.27 g/L和0.15 g/L,而10 ℃酒样L-苹果酸质量浓度仍然保持在0.87 g/L,尽管其菌密度仍保持在106CFU/mL,可能是低温抑制了其苹果酸-乳酸酶活性[25],且能在低温下完成MLF可能也与菌株中相关基因的表达有关[26-27]。李维新[25]通过研究温度对苹果酸-乳酸酶活性的影响时发现,在生长温度为15~35 ℃内,植物乳杆菌R23苹果酸-乳酸酶的活力随着温度的上升而增高。Olguín等[14]通过对菌株UNQOe19和UNQOe4分别在18 ℃和21 ℃培养48 h后相关的基因进行实时聚合酶链式反应,结果表明应激基因rmlB和hsp20在21 ℃时表达水平降低,但在18 ℃表达量显著增加。在本研究中,15 ℃较20 ℃发酵相比,对菌株Q19消耗苹果酸的影响不显著,而在10 ℃条件下,消耗苹果酸能力降低,表明15 ℃对希氏乳杆菌Q19苹果酸-乳酸酶活性影响不显著,10 ℃可能对其苹果酸-乳酸酶活性产生较大的抑制作用。
对于挥发性香气化合物,低温发酵能保留葡萄酒中的一些风味物质[28],也是发酵过程中唯一能人为控制的因素。葡萄酒中的醇类物质主要是由己糖或氨基酸通过丙酮酸途径产生,在MLF过程中,由于乳酸菌菌株代谢过程中酶活性不同,最终导致代谢产物及次级代谢产物不同[29]。在各处理中,15 ℃发酵酒样高级醇类物质含量最高,其中正辛醇(茉莉、柠檬香)和苯乙醇(玫瑰花香)含量均高于10、20 ℃发酵,且苯乙醇含量超过其相应的阈值,这为葡萄酒赋予一定的柠檬香、玫瑰花和蔷薇等香气起到积极作用。
酯类物质是葡萄酒中重要的挥发性化合物,大多数酯类可产生令人愉悦的香气,通常呈现水果香味[30]。在MLF过程中,酯类物质的合成与水解主要与乳酸菌中的酯酶及其活性有关[31]。经过不同温度MLF,15 ℃处理的酯类物质种类以及乙醇酯类物质含量均高于对照与其他处理,这些物质对于葡萄酒果香、花香和香料香气味具有积极的贡献。Pérez-Martín等[32]研究了温度对243 株乳酸菌酯酶活性的影响,发现70%的菌株酯酶活性在15 ℃时高于其他温度,这对葡萄酒香气可能具有潜在的影响。周安玲等[29]在研究乳酸菌对干红葡萄酒挥发性成分影响时发现,来源于泡菜中的植物乳杆菌C5由于其酯酶活性较高,从而促进了酯类物质的形成。
酸类物质除本身是香气成分外,还能和醇在酯酶催化作用下形成酯类物质,增加葡萄汁或酒的香气物质种类[21]。由本研究可知,各处理有机酸含量均高于对照组,其中10 ℃发酵增加了辛酸含量,15 ℃和20 ℃发酵均降低了辛酸含量,增加了正癸酸含量。
萜烯类化合物来源于葡萄果实本身,主要以糖苷键合态形式存在,酿造过程中可在糖苷酶作用下转变为挥发性的游离态香气化合物,从而赋予葡萄酒品种香气特征[33]。本实验酒样共检测出4 种萜烯类物质,在15 ℃处理酒样中,这4 种萜烯类物质均检测出并且总含量最高,对照和20 ℃发酵酒样仅检测到香茅醇的存在,10 ℃发酵酒样未检测到萜烯类物质。其中15 ℃发酵酒样产生的里那醇(百合花、果香)和香茅醇(柠檬、柑橘香)含量均超过感官阈值,这些物质赋予葡萄酒一定的花香、果香,增加了葡萄酒香气的复杂性。羰基类化合物主要来源于微生物的发酵,与对照相比,10 ℃和15 ℃发酵增加了羰基化合物含量,20 ℃发酵降低了其含量。其中15 ℃发酵产生的正癸醛(甜橙和橘子香气)含量高于对照和其他处理,且超过相应的感官阈值,这对酒体香气特征起重要的贡献作用。
关于温度及其他非生物胁迫对希氏乳杆菌Q19应激基因表达、酶活性以及有关物质代谢等方面的研究仍需进一步探索,以便更深入地理解希氏乳杆菌Q19的生理和代谢特点,为更好地应用于生产提供基础和依据。
4 结 论
希氏乳杆菌Q19在10、15、20 ℃条件下,启动MLF将苹果酸转化成乳酸,在15、20 ℃条件下,菌株表现出良好的苹果酸分解能力,启动发酵28 d内苹果酸质量浓度分别降到0.27 g/L和0.15 g/L,但在10 ℃条件下,启动发酵28 d内苹果酸质量浓度仍保持在0.87 g/L,MLF速度受到较大影响。10、15 ℃条件下,菌株对柠檬酸和糖进行了少量的代谢,但发酵后挥发酸升高不显著。在不同温度条件下,希氏乳杆菌Q19 MLF后的香气物质类别具有显著差异,与20 ℃发酵相比,15 ℃条件下发酵后葡萄酒中香气物质的种类与含量更丰富,其中正辛醇、庚酸乙酯、壬酸乙酯、乳酸乙酯、十一酸乙酯、正癸醛和萜烯类物质含量增加,赋予了葡萄酒独特的花香、果香等香气特征。结果表明希氏乳杆菌Q19能在15 ℃低温条件下启动并完成MLF,并能提升葡萄酒的香气质量,因而具有较高的商业化价值。

