白酒制曲环境和成品曲中产酸微生物分析
王春晓,袁国亿,苏 伟,王 啸,邱树毅
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
白酒是以粮谷(高粱、大米、玉米、小麦、糯米等)为主要原料,经蒸煮、糖化发酵(利用特制糖化发酵剂如大曲、小曲、麸曲、强化曲等中微生物和酶的作用进行,方式有固态、半固态、液态等)生成糖、酸和醇等物质,再经蒸馏、陈酿、勾兑制成的中国传统蒸馏酒[1-2]。白酒中各种不同的物质成分不仅影响其感官品质和质量安全[3-4],而且与人体健康相关联[2]。影响白酒感官品质的风味物质包含酯类、醇类、酸类、醛酮类等,其中酸类物质占风味物质总量的14%~16%[5],主要包含乙酸、乳酸、己酸和丁酸等[6],其中乙酸含量最高[7]。白酒中酸类物质主要作为呈味物质调节白酒的浓厚感[4-5],还可作为酯类的前体物质进一步影响白酒的风味形成[8-9],此外,白酒中报道的138 种健康因子中酸类化合物有16 种[2]。因此,酸类物质的形成与控制是不同白酒酿造中需要关注的重要物质成分指标之一[8],目前不同香型白酒的国家标准中规定了总酸的最低含量(如酱香型白酒高度酒优级为1.40 g/L,GB/T 26760—2011《酱香型白酒》[10]),但对于上限暂无要求。
研究表明白酒中的酸类物质主要由微生物对粮谷中淀粉的代谢产生[4-5],由于白酒酿造所用原料、糖化发酵剂、发酵及陈酿方式等的不同,不同类型白酒中微生物代谢产生的有机酸具有种类和含量多样性[7-8,11-12]。白酒中主要的乙酸产生菌为醋酸杆菌属(Acetobacterium)和葡萄糖杆菌属(Gluconobacteria)[13]。浓香型白酒中的己酸和丁酸主要由窖泥中的梭状芽孢杆菌属(Clostridium)如克氏梭状杆菌(C.kluyveri)代谢产生[5,14-16],乳酸由发酵酒醅中的嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳杆菌(L.plantanrum)、乳酸片球菌(Pediococcus acidilactici)、戊糖乳杆菌(L.pentosus)、解淀粉芽孢杆菌(Bacillus amylociquefaciens)、食窦魏斯氏菌(Weissella cibaria)和格氏乳球菌(Lactococcus garvieae)代谢产生[6,17],乙酸由发酵酒醅中的巴氏醋杆菌(Acetobacter pasteurianus)、东方醋杆菌(A.orientalis)和苹果醋杆菌(A.malorum)产生[6]。老白干香型白酒中的乳酸主要由大曲和酒醅中的食窦魏斯氏菌(W.cibaria)代谢产生[11]。豉香型白酒中的乙酸和乳酸主要由饼丸和大酒饼中醋酸菌和乳酸菌产生[9]。清香型白酒中的乙酸主要由发酵酒醅中异常毕赤酵母(Pichia anomala)代谢产生[18]。李兵等[13]研究表明部分根霉能够产生乳酸,此外,唐玉明等[19]发现大曲发酵房中的环境微生物对曲药质量的影响主要由酵母菌和细菌产生,酵母菌和细菌与大曲酸度显著相关。然而,总体而言白酒酿造中对产酸微生物的研究相对较少,五大香型中以浓香型对产酸微生物的研究较多,其余香型较少。且上述白酒对产酸微生物的研究主要集中于曲和酒醅中的醋酸菌和乳酸菌,对酵母菌和霉菌的关注相对较少。目前对白酒中酵母菌的研究主要集中在产酒、产酯和耐酸耐热等能力,对产酸的研究较少[20]。
因此,本实验对小曲白酒制曲环境和成品曲中的产酸微生物进行研究,对成品曲糖化样品进行主要酸类物质检测,以考察小曲白酒制曲环境和曲中的主导产酸微生物。期望对酸的形成和产酸微生物的控制提供理论依据,并为进一步研究酸对白酒风味的影响提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
成品曲样品:取自某小曲白酒厂3 个不同曲房,编号为Q1、Q2和Q3。
成品曲糖化样品:取自某小曲白酒厂,由成品曲Q1、Q2和Q3分别在30 ℃和35 ℃条件下糖化制成,编号为Q1-30、Q1-35、Q2-30、Q2-35、Q3-30和Q3-35,成品曲糖化样品取样后置于4 ℃运输和保存。
制曲环境空气微生物样品:在某兼小曲白酒厂制曲环境和曲房不同位置进行环境空气微生物取样分析检测,取样点共计15 处,6 处位于不同的制曲环境,9 处位于3 个不同曲房Q1、Q2和Q3的不同位置。取样时将醋酸菌分离和筛选培养基各3 份敞开置于取样点10 min,取样后于30 ℃培养3 d。
1.1.2 培养基
醋酸菌分离培养基:葡萄糖10 g/L、酵母膏10 g/L、琼脂20 g/L,自然pH值,121 ℃灭菌20 min后冷却至70 ℃左右加6%(体积分数)无水乙醇;醋酸菌筛选培养基:酵母膏10 g/L、葡萄糖10 g/L、CaCO310 g/L、琼脂20 g/L,自然pH值,121 ℃灭菌20 min后冷却至70 ℃左右加6%(体积分数)无水乙醇;醋酸菌生长液体培养基:葡萄糖10 g/L、酵母膏10 g/L,121 ℃灭菌20 min冷却至70 ℃左右加3.0%(体积分数)无水乙醇;YPD培养基:酵母浸出粉10 g/L、葡萄糖20 g/L、蛋白胨20 g/L、琼脂20 g/L。
1.1.3 试剂
聚合酶链式反应(polymerase chain reaction,PCR)扩增所用引物和酶等分子试剂 北京宝日医生物技术有限公司;GeneGeen核酸染料 北京天根生化科技有限公司;HyAgarose琼脂糖 厦门太阳马生物工程有限公司;三氯化铁 国药集团化学试剂有限公司;氢氧化钠 天津市优谱化学试剂有限公司;无水乙醇(分析纯) 天津市富宇精细化工有限公司;α-淀粉酶、糖化酶、琼脂 北京索莱宝科技有限公司;酵母浸出粉、蛋白胨 上海博微生物科技有限公司;酵母膏 北京奥博星生物科技有限责任公司;碳酸钙 成都金山化学试剂有限公司;葡萄糖 天津市永大化学试剂有限公司;乳酸、乙酸(均为色谱纯),磷酸二氢钾 天津市科密欧化学试剂有限公司;乙腈(色谱纯) 湖北弗顿科学技术有限公司。
1.2 仪器与设备
JXFSTPRP-24型细胞破碎仪 上海净信发展有限公司;MIT-100型恒温混匀仪 杭州米欧仪器有限公司;X3R型冷冻离心机 美国Thermo Fisher Scientific公司;CFX Connect型梯度荧光定量PCR仪、核酸电泳仪 美国Bio-Rad公司;Bio-Bset140E型凝胶成像仪 美国SIM公司;1260高效液相色谱仪(配二极管阵列(G1315D)加蒸发光) 美国Agilent公司;BX43型电子显微镜 日本Olympus公司;SW-CJ-IED型洁净工作台、SPX-250B-Z型生化培养箱、YXQ-30SII型立式压力蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 成品曲糖化样品中产酸微生物的分离与筛选
1.3.1.1 微生物的分离
取10 g成品曲糖化样品于装有30 mL无菌蒸馏水的50 mL离心管中,涡旋均匀后静置0.5 h,吸取上清液进行10 倍梯度稀释,将稀释度为100、10-1、10-2、10-3、10-4、10-5的稀释液涂布于醋酸菌分离培养基中,每个稀释度涂布2 份,30 ℃培养3 d。观察并记录不同微生物菌落数量、菌落形态和显微镜下细胞形态,初步区分所分离微生物的类别。
1.3.1.2 产酸微生物的筛选
将1.3.1.1节中醋酸菌分离培养基分离的不同微生物,点样培养于醋酸菌筛选培养基,每种类别的菌株重复点样3 次,30 ℃培养3 d后观察记录菌落形态和碳酸钙溶解圈大小,挑选具有明显碳酸钙溶解圈的菌株进行分离纯化及保藏。
1.3.1.3 产酸微生物产乙酸特性分析
取分离自成品曲糖化样品和制曲环境空气微生物样品中具有明显碳酸钙溶解圈的菌株,接种于醋酸菌生长液体培养基中,30 ℃、120 r/min摇床培养3 d,取10 mL培养液4 000 r/min离心,取5 mL上清液煮沸,用0.1 mol/L氢氧化钠溶液中和至pH 7.0,滴加50 g/L氯化铁溶液3~5 滴,观察是否有红褐色沉淀产生。
1.3.2 产酸酵母种水平鉴定
将成品曲糖化样品和制曲环境空气微生物样品中分离筛选的主导产酸酵母,划线培养于YPD培养基,28~30 ℃培养2 d后采用石英砂破壁法提取DNA[21],并进一步利用26S rRNA基因D1/D2区域序列分析方法鉴定主要产酸酵母[22-23]。PCR扩增引物为NL1和NL4[24],扩增程序:95 ℃预变性5 min, 94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸90 s(36 个循环),72 ℃最终延伸8 min。利用1.5%琼脂糖凝胶电泳检测PCR产物质量,将具有单一条带的PCR产物送至华大基因测序。测序结果首先通过峰图质量检测获取具有单一峰的碱基序列,然后与GenBank数据库中的序列进行BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,序列相似性大于99%的菌种作为待测菌株的菌种名称。
1.3.3 成品曲糖化样品中主要酸类物质含量检测
利用高效液相色谱法检测成品曲糖化样品中主要酸类物质乳酸和乙酸,使用SB-Aq色谱柱(4.6 mm×250 mm,5 μm),检测波长210 nm,流动相为10 mmol/L磷酸二氢钾-乙腈混合液(体积比99.5∶0.5,pH 2.0),流速0.8 mL/min,柱温40 ℃,进样量20 μL。采用混标法建立乳酸和乙酸标准品的标准曲线:乳酸(y=6.847x+17.82,r2=1)、乙酸(y=8.677x+32.86,r2=1)。样品处理:取样10 g加水20 mL于离心管中超声处理30 min,6 000 r/min离心5 min,取上清液加水20 mL离心,取上清液定容至50 mL容量瓶,采用0.22 μm水系膜过滤。
1.3.4 成品曲糖化样品酸度测定
取成品曲糖化样品10 g研细,加200 mL蒸馏水充分搅拌,浸泡0.5 h(每隔10 min搅拌一次),用纱布过滤,吸取滤液20 mL,采用GB/T 10345—2007《白酒分析方法》[25]指示剂法测定酸度(以乙酸计)。计算公式如下:
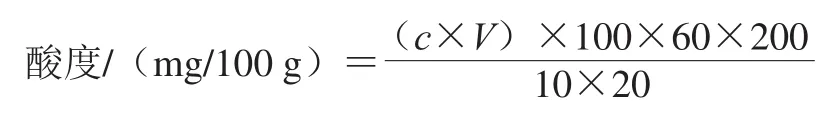
式中:c为氢氧化钠标准滴定溶液的试剂浓度/(mol/L);V为测定时消耗氢氧化钠标准滴定溶液的体积/mL;100为最终计算样品的质量/g;60为乙酸的摩尔质量/(g/mol);10为量取样品的质量/g;20为吸取样品的体积/mL;200为量取样品浸泡后的滤液总体积/mL。
1.3.5 产酸酵母实验室糖化样品制备及酸度检测
产酸酵母实验室糖化样品制备过程模拟取样酒厂制备糖化样品的过程,不同在于实验室使用了产酸酵母和糖化酶,而酒厂使用的是成品曲,实验室糖化样品的制备主要用于验证所接种产酸酵母的产酸能力,主要过程如下:取大米50 g,加蒸馏水浸泡过夜,沥干后,放入250 mL三角瓶中,加入100 mL蒸馏水,121 ℃灭菌20 min,冷却至30 ℃。A制备方法(直接接种产酸酵母):选2 株分离自成品曲糖化样品的产酸酵母FBKL2.8DJCS1和FBKL2.8DJCS2、1 株分离自制曲环境的产酸酵母FBKL2.8DJCS3,划线培养于YPD培养基,30 ℃培养2 d后挑取40 个菌落于10 mL无菌蒸馏水中,涡旋后拌匀入大米处理液中,30 ℃培养40 h。B制备方法(大米制备液冷却后,首先进行糖化处理):在大米制备液中加入0.945 g淀粉酶和0.28 g糖化酶,封口,放入60 ℃水浴锅糖化30 min后,冷却至30 ℃,然后按照A方法接种产酸酵母。A和B两种糖化样品制备都设立不接种酵母的对照组。
产酸酵母实验室糖化样品制备后,取3 g样品加入10 mL无菌蒸馏水中,涡旋均匀,取液体通过稀释涂布法培养于醋酸菌分离培养基,28~30 ℃培养2 d后,观察验证A、B和相应对照组中微生物菌落形态是否与接种产酸酵母一致。产酸酵母实验室糖化样品的酸度检测按1.3.4节所述方法进行。
1.3.6 成品曲高通量测序分析
成品曲Q1、Q2和Q3送至成都罗宁生物科技有限公司进行DNA提取和高通量测序分析:高通量测序分析目标扩增区域为16S rRNA基因V3-V4区,采用带有Barcode的特异引物341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)[26],PCR产物电泳、纯化和定量后采用试剂盒进行文库构建和测序,测序平台为HiSeq 2500测序模式为PE250。
测序获得的原始序列经拼接和过滤后得到高质量目标序列,基于Usearch(http://drive5.com/uparse/)软件使用UPARSE算法在97%的相似性水平上进行可操作分类单元(operational taxonomic units,OTU)聚类,挑选出OTU的代表性序列(即出现频数最高的序列),使用UCLUST分类法与SILVA数据库(http://www.arb-silva.de/)进行物种分类信息注释分析,并计算各个分类水平上的丰度信息。
1.4 数据处理与分析
采用Microsoft Office Excel 2007进行数据处理和作图。采用Origin 8.6进行酸度、乳酸和乙酸含量的差异性分析,差异性分析采用单因素方差分析(One Way ANOVA),P<0.05,差异显著。均值比较采用Tukey Test方法。
2 结果与分析
2.1 成品曲糖化样品和制曲环境空气微生物样品中微生物的检测结果
成品曲糖化样品中微生物浓度为105~108CFU/mL,其中Q1和Q2成品曲糖化样品中微生物的浓度明显高于Q3,为107~108CFU/mL(表1)。Q1、Q2和Q3来自3 个不同曲房,说明曲房环境可能影响了成品曲糖化样品中微生物的浓度。不同的糖化温度也会影响成品曲糖化样品中微生物的浓度,35 ℃的糖化样品中微生物浓度高于30 ℃。如表1所示,成品曲糖化样品中检测的微生物包含酵母、细菌和霉菌,其中Q1和Q2糖化样品中只检测到酵母,且106~108CFU/mL的酵母菌具有产乙酸能力,Q3糖化样品中检测到的微生物中只有酵母菌表现出产乙酸能力,说明该小曲白酒厂成品曲糖化样品中主导产酸菌为酵母菌。
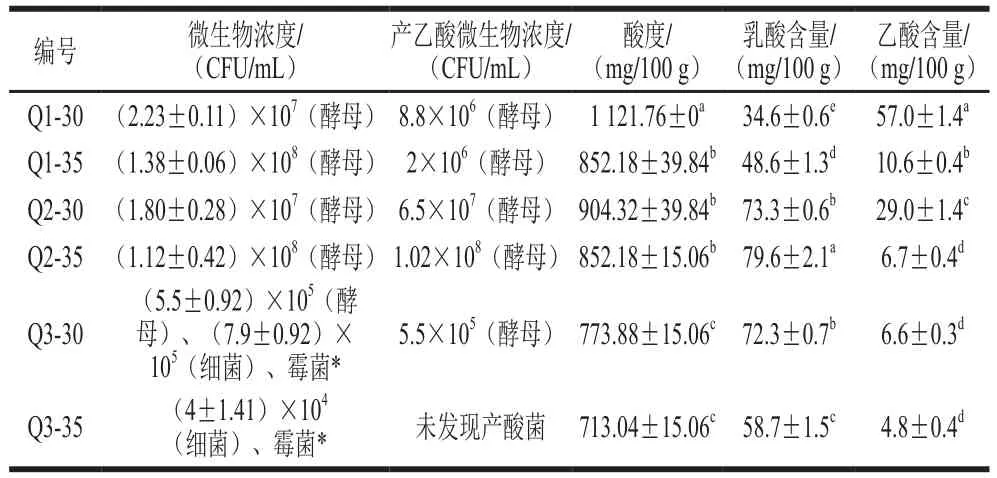
表1 成品曲糖化样品酸度、主要酸类物质和产酸微生物检测结果Table 1Acidity, main acids and acid-producing microorganisms in saccharified samples made with mature Qu
成品曲糖化样品的酸度值在700~1 200 mg/100 g范围内,其中Q1和Q2糖化样品的酸度平均值高于Q3,与其中产酸酵母的浓度一致,35 ℃制备的糖化样品酸度平均值低于30 ℃,6 个成品曲糖化样品的酸度值除Q2-30与Q2-35、Q1-35与Q2-30、Q1-35与Q2-35、Q3-35与Q3-30两两之间差异不显著之外,其余11 组两两对比差异性显著(P<0.05)。高效液相色谱分析表明成品曲糖化样品中的主要酸类物质为乳酸和乙酸,其中乳酸含量范围为30~80 mg/100 g,乙酸含量范围为4~60 mg/100 g。如表1所示,除Q1-30样品外,其余糖化样品中乳酸含量的平均值高于乙酸含量平均值,不同样品中乳酸含量是乙酸的2~14 倍,35 ℃制备的所有糖化样品中乙酸含量的平均值低于30 ℃,从而使35 ℃乳酸和乙酸的含量比值明显高于30 ℃,说明温度升高酵母菌的产乙酸能力降低。6 个成品曲糖化样品中的乳酸含量除Q2-30与Q3-30之间差异不显著之外,其余14 组两两对比差异性显著(P<0.05);6 个成品曲糖化样品中的乙酸含量除Q2-35、Q3-30与Q3-35两两之间差异不显著之外,其余12 组两两对比差异性显著(P<0.05)。差异性分析结果进一步证实了不同曲中微生物和温度对糖化样品的酸度、乳酸和乙酸含量的影响。
制曲环境和曲房不同位置的空气微生物检测结果如表2所示。搅拌器、踩曲处和室外空气中微生物数量相对较少(<30 个),物料房微生物数量增多,曲房的微生物数量最多,其中Q1和Q2曲房空气中微生物数量高于Q3曲房,3 个曲房都是靠门处微生物数量最少,Q1和Q3曲房靠窗处微生物数量高于曲房中间而Q2曲房相反。制曲环境和曲房不同位置检测的空气微生物包含酵母、细菌和霉菌,大部分位置酵母数量最高,其次为细菌,霉菌最少。每个位置都检测到产酸菌的存在,产酸菌中包含具有不同菌落特征的酵母和细菌,数量以曲房最高,物料房其次,其他取样点最少,主要产酸菌为酵母。
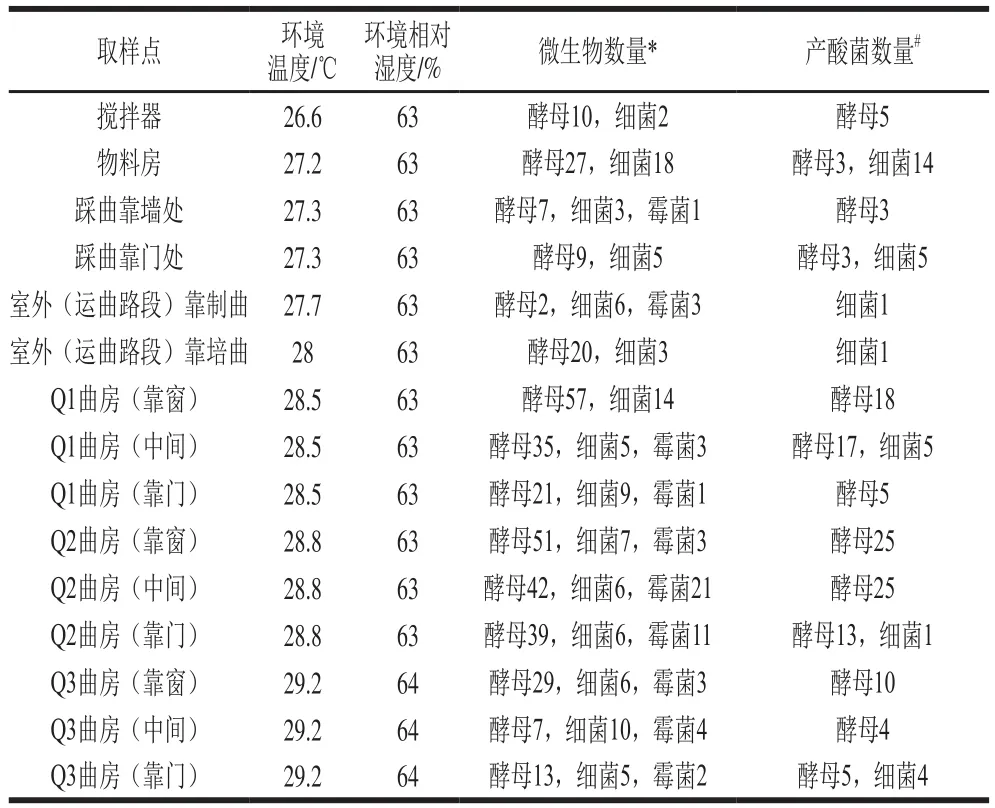
表2 制曲环境中空气微生物和产酸微生物数量Table 2Numbers of total microorganisms and acid-producing microorganisms in Qu-making environment
2.2 主导产乙酸酵母的分离鉴定

图1 主导产酸酵母菌落形态、显微细胞形态和产乙酸特性Fig.1 Colony morphology, cell characteristics under microscope and acetic acid production of main acid-producing yeast
将生长于醋酸菌分离和筛选培养基上的主导产乙酸酵母进行分离纯化和保藏,发现分离自成品曲糖化样品和制曲环境空气微生物样品中的主导产乙酸酵母具有类似的菌落特征(图1a、c)。在醋酸菌分离培养基上菌落呈白色、毛状、干燥、中央凸起、半径在2~5 mm左右、边缘规则,在醋酸菌筛选培养基上形成明显的碳酸钙溶解圈。该主导产乙酸酵母在400×显微镜下可观察到连在一起的菌丝和长在菌丝周围的卵圆形孢子(图1b)。选取3 株主导产酸酵母FBKL2.8DJCS1、FBKL2.8DJCS2和FBKL2.8DJCS3进行26S rRNA基因D1/D2区域序列分析,这3 株菌的相应序列与模式菌株的序列相似度高于99%,因此鉴定主导产酸酵母为扣囊复膜酵母(Saccharomycopsis fibuligera),该3 株菌在GenBank数据库中的序列登录号分别为MN203652、MN203653和MN203654。
将成品曲糖化样品和制曲环境空气微生物样品中分离的具有明显碳酸钙溶解圈的菌株进行产乙酸特性分析,结果发现大部分菌株能产生砖红色沉淀(图1d),即具有产乙酸能力,少部分菌株与没有透明圈的菌株一样,无法产生砖红色沉淀。由于该方法的检测结果对pH值依赖性较高,稳定性相对醋酸菌筛选培养基较低一些,不建议作为醋酸菌筛选的主要方法依据。
2.3 产酸酵母实验室糖化样品的酸度

表3 实验室产酸酵母糖化样品的酸度Table 3Acidity of laboratory-prepared saccharified samples inoculated with acid-producing yeast mg/100 g
如表3所示,A和B两种制备方法都表明接种产酸酵母的糖化样品酸度值明显高于不接种微生物的对照组样品,验证了所接种酵母在40 h内的产酸能力。B制备方法相对于A增加了利用α-淀粉酶和糖化酶进行糖化处理的步骤,该步骤可以提高产酸酵母的产酸能力,因为A方法接种产酸酵母的糖化样品酸度值高于对照组26.1~52.14 mg/100 g,而B方法中接种产酸酵母的糖化样品酸度值高于对照组52~60 mg/100 g。糖化处理也明显增加了对照组的酸度值,主要是由所使用的两种酶本身酸度引起,这已通过指示剂法检测两种酶溶液的酸度值得到验证。此外,所有实验室糖化样品的微生物培养实验验证了最终样品中微生物与所接种酵母的菌落形态一致,对照组中未检出微生物。扣囊复膜酵母在以往的研究报道中主要体现了产淀粉酶、β-糖苷酶和酸性蛋白酶的活性[27-30],主要贡献于淀粉的糖化水解过程。本研究首次指出扣囊复膜酵母在糖化过程中的产乙酸能力,为白酒中酸类物质的形成提供了新的思路。
酒厂制备的成品曲糖化样品酸度值(表1)高于实验室产酸酵母糖化样品的酸度值(表3),可能由于成品曲中微生物种类丰富,不仅存在产乙酸的酵母菌,而且存在产乳酸的细菌,此外,成品曲糖化效果可能不同于实验室酶糖化效果,对产酸的影响也不同。
2.4 成品曲中细菌的高通量测序检测结果
3 个不同曲房所取成品曲Q1、Q2和Q3的高通量测序结果显示,有效序列的数量为29 496、34 277和28 696,序列的平均长度为271~312 bp,检测到的菌种数量分别为1 557、1 547和315。α多样性分析表明,Q1的Chao1指数略低于Q2,Shannon指数和InvSimpson指数略高于Q2,即这两种成品曲的细菌多样性类似,Q1的细菌物种丰度略低于Q2,而细菌物种分布均匀性略高于Q2。Q3的Chao1指数、Shannon指数和InvSimpson指数明显低于Q1和Q2,表现出了较低的细菌多样性。

图2 成品曲Q1、Q2和Q3中的细菌相对丰度Fig.2 Relative abundance of bacteria with relative abundance above 1% in mature Qu Q1, Q2 and Q3
如图2所示,3 种成品曲中相对丰度大于1%的细菌属为40 种,其中Q1中检测到13 种、Q2为18 种、Q3为22 种,其中相对丰度大于5%的细菌属有乳杆菌属(Lactobacillus,Q3)、拟杆菌科(Bacteroidetes vadinHA17,Q1和Q2)、片球菌属(Pediococcus,Q2)、Lentimicrobiaceae(Q1和Q2)、埃希氏菌属(Escherichia-Shigella,Q3)、泛菌属(Pantoea,Q3)和拟杆菌属(Bacteroides,Q3)。3 种成品曲中都检测到一定比例的乳酸菌,主要包括乳杆菌属、魏斯氏菌属和片球菌属,如图2所示,Q3中乳酸菌含量最高,包含17.92%乳杆菌属、2.38%魏斯氏菌和0.76%片球菌属,其次为Q2包含2.69%乳杆菌属、0.60%魏斯氏菌和5.01%片球菌属,Q1中乳酸菌含量最低,包含0.44%乳杆菌属、0.09%魏斯氏菌和0.81%片球菌属。3 种成品曲中检测到的乳杆菌属包含6 个主导菌种:香肠乳杆菌(L.farciminis)、唾液乳杆菌(L.salivarius)、植物乳杆菌(L.plantarum)、卷曲乳杆菌(L.crispatus)、短乳杆菌(L.brevis)和约氏乳杆菌(L.johnsonii),检测到的魏斯氏菌主要为食窦魏斯氏菌(W.cibaria),检测到的片球菌主要为戊糖片球菌(P.pentosaceus)。此外,只在Q2中检测到少量醋酸杆菌属(Acetobacterium,0.02%)细菌,Q1和Q3中未检测到醋酸菌存在。
3 结 论
本研究发现小曲白酒成品曲糖化样品中主要的酸类物质为乳酸和乙酸,且乳酸含量大多高于乙酸。高通量测序检测到成品曲中主要的乳酸产生菌为香肠乳杆菌、唾液乳杆菌、植物乳杆菌、卷曲乳杆菌、短乳杆菌、约氏乳杆菌、食窦魏斯氏菌和戊糖片球菌。通过分离筛选实验发现制曲环境和成品曲糖化样品中主要的乙酸产生菌为扣囊复膜酵母,该酵母在实验室纯种糖化样品制备中体现了其产酸能力。本研究在成品曲、成品曲糖化样品和制曲环境中未发现醋酸菌的大量存在,首次报道了扣囊复膜酵母在乙酸形成中的作用,为利用扣囊覆膜酵母发酵产酸提供了一定的理论依据。
——酸度

