泡菜中亚硝酸盐形成、还原相关微生物的研究
燕平梅,王炫月,赵文婧
(1.太原师范学院 生物系,太原 030619;2.土壤消毒活化绿色产业技术创新战略联盟,太原 030619)
蔬菜极易富集硝酸盐,硝酸盐远远高于亚硝酸盐的含量[1]。蔬菜发酵后亚硝酸盐含量远高于硝酸盐[2]。前人通过大量的试验证实了蔬菜发酵过程中的亚硝酸盐由硝酸盐转化而来[3-10]。且发酵液与组织蔬菜中均会形成“亚硝峰”,分析了“亚硝峰”的形成是由泡菜表面的微生物通过硝酸还原酶作用将蔬菜中的硝酸盐还原成亚硝酸盐。目前,泡菜中微生物研究采用纯培养方法,此方法基于培养基培养,对微生物识别和描述,由于脱离了微生物生长的原位环境,影响微生物的研究结果[11]。非培养的方法可以真实反映特定环境中微生物多样性,并且检测极限低、检测速度快、经济。非培养方法DGGE技术、克隆文库分析法和高通量测序技术[12-16]等被广泛应用于发酵甘蓝微生物检测中。基于高通量测序的宏基因组学方法较为全面和准确地反映泡菜生态系统微生物群落结构。而采用PCR-DGGE技术区别不同种群、群体变化和差异的信息、鉴定优势群落是其他技术无法比拟的。PCR-DGGE技术广泛用于发酵食品微生物群落的研究,如韩国泡菜、麦芽威士酒、意大利香肠、发酵玉米团[17-21]。燕平梅等[22]用培养和PCR-ARDRA的非培养方法研究酸白菜制品的乳酸菌多样性,结果表明非培养样品的乳酸菌多样性较培养方法丰富。付琳琳[23]以不同家庭制作的成熟期的泡菜液为材料,采用PCR-DGGE方法研究了泡菜液中乳酸菌多样性,说明DGGE方法检测优势菌群的优点。本研究利用PCR-DGGE-克隆的非培养方法分析甘蓝发酵过程中细菌、真菌、乳酸菌随发酵时间变化而演变的规律。根据DGGE电泳图谱中的相对含量(由凝胶成像系统的配套软件Quantity-One计算强度)做出随发酵时间的变化图。并和NO2-含量随发酵时间变化图相比较,推测与NO2-形成、还原相关优势微生物的基因片段。探明蔬菜发酵过程中与“亚硝峰”形成和降解的微生物,为发酵蔬菜的安全化生产条件的控制提供了技术原理和方法。
1 材料与方法
1.1 材料与试剂
泡菜所用的甘蓝:购自沃尔玛超市。细菌基因组DNA提取试剂盒和PCR所需试剂:天根时代生物有限公司。
1.2 仪器与设备
PCR仪 Mastereycler Gradient公司;凝胶成像系统(DcodeTM) Bio-Rad公司;Nanodrop分光光度计。
1.3 方法
1.3.1 发酵甘蓝的制备和取样
甘蓝发酵:采用干净灭菌的250 mL三角瓶为发酵容器,加入冲洗干净和切分的白菜以及4%、6%、8%食盐煮沸后冷却的盐水(菜∶盐水为1∶2,m/V),于20 ℃条件厌氧发酵。分别在第1,3,5,7,9,11,13天取发酵样品。
1.3.2 发酵甘蓝体系微生物DNA的提取
以试剂盒步骤提取基因组DNA,保存于4 ℃冰箱备用。
1.3.3 发酵甘蓝微生物16S rDNA V3基因片段DGGE
16S rDNA序列V3片段扩增引物为通用引物。引物序列341f-GC和534r。PCR反应体系 25 μL。反应条件:94 ℃预变性4 min,94 ℃ 30 s,48.8 ℃ 40 s,72 ℃ 50 s,72 ℃ 6 min,30个循环。
取 PCR产物20 μL进行DGGE实验,上层胶浓度为 8%,变性胶浓度为30%~50%。在 1×TAE 缓冲液中,在200 V 60 ℃下电泳 5 h。电泳后采用SYBR Green对凝胶染色1 h。回收特异电泳带,进一步扩增克隆测序,并进行序列分析。
1.3.4 18S rDNA片段DGGE
真菌的18S rDNA序列选用18sp2和18sp3。PCR反应条件:94 ℃预变性 4 min,94 ℃ 30 s,43 ℃ 30 s,72 ℃ 50 s,72 ℃ 6 min,30个循环。
取 PCR 产物 20 μL进行 DGGE 分析,上层胶浓度为 8%,变性胶浓度为18%~35%。在 1×TAE 缓冲液中,在200 V 60 ℃下电泳 4.5 h。电泳后采用SYBR Green对凝胶染色1 h。回收特异电泳带,进一步扩增克隆测序,并进行序列分析。
1.3.5 切胶回收
将DGGE凝胶上回收条带胶条碾碎,加约40 μL去离子水于4 ℃过夜。以此DNA为模板进行再次PCR反应。
1.3.6 16S rDNA V3片段的克隆测序
经纯化后的PCR产物与pGM-T Vector连接,连接操作参照pGM-T克隆试剂盒操作说明。转化大肠杆菌后检测,阳性克隆测序。
1.3.7 测定泡菜中硝酸盐和亚硝酸盐含量的方法
将不同样品5 mL置于自动取样器中,接通流路。按仪器工作条件基线调零,开始进样并采集吸光度信号。测定条件:波长600 nm,参比波长460 nm,125 ℃,速率30样/h。
2 结果与分析
2.1 4%食盐浓度发酵甘蓝亚硝酸盐、硝酸盐含量分析
发酵甘蓝亚硝酸盐和硝酸盐含量变化趋势一致,见图1。发酵第4天达到最高峰值,第6天为最小值,第10天达到次高峰值。亚硝酸最高峰值为561.59 mg/mL,次高峰值为137.34 mg/mL,亚硝酸盐浓度在5.65~561.59 mg/mL之间。发酵开始时硝酸盐含量高达119.23 g/mL,发酵甘蓝卤中硝酸盐和亚硝酸盐含量低,浓度范围为0.18~2.26 mg/mL。

图1 4%食盐浓度发酵甘蓝亚硝酸盐和硝酸盐含量变化Fig.1 Nitrite and nitrate content changes of fermented cabbage with 4% salt concentration
2.2 4%食盐浓度发酵甘蓝亚硝酸盐形成、还原相关的微生物分析
发酵甘蓝亚硝酸盐和硝酸盐含量变化与微生物的16S rDNA V3片段DGGE图谱(见图2中A)比对得出,E条带发酵初有荧光强度,发酵第7天最强;B条带从发酵开始到第5天前后亮度强,在后期(第13天)检测到D条带和G条带,4 d消失,其与亚硝酸盐最高峰、次高峰出现的时间一致,因此,推断E条带在发酵第7天荧光亮度最盛,与亚硝酸盐低谷时间大致吻合。 条带B(Pseudomonassp.)、条带D(Pantoeadispersa)和条带G(Staphylococcussciuri)和亚硝酸盐形成相关;因此,推断条带E(Leuconostocgasicomitatum)是和亚硝酸盐还原相关的微生物。

图2 发酵甘蓝微生物16S rDNA DGGE指纹图谱Fig.2 16S rDNA DGGE fingerprint of microorganisms in fermented cabbage
发酵甘蓝亚硝酸盐和硝酸盐含量变化与18S rDNA的DGGE图谱(见图3)对比,发酵开始有A条带,荧光强度由弱变强,第9天未检测到,与亚硝酸盐高峰和低谷出现时间对应,说明条带A(Aeromonassobria)可能和亚硝酸盐的形成有关。在发酵第5天检测到C条带,但很快消失,说明条带C(Meyerozymaguilliermondii)与亚硝酸盐形成有一定的关系,第13天检测到B条带,但之后未出现,说明条带B(Candidasp.)与亚硝酸盐还原有一定的关系。

图3 发酵甘蓝真菌18S rDNA DGGE指纹图谱Fig.3 18S rDNA DGGE fingerprint of fungi in fermented cabbage
2.3 食盐浓度6%的发酵甘蓝亚硝酸盐、硝酸盐含量分析

图4 6%食盐浓度发酵甘蓝亚硝酸盐和硝酸盐含量变化Fig.4 Nitrite and nitrate content changes of fermented cabbage with 6% salt concentration
由图4可知,甘蓝发酵中亚硝酸盐含量在第1天为最高峰,为10.57 mg/mL,然后下降,第5天平稳;硝酸盐含量在第13天最高,为8.40 mg/mL;而卤水中的亚硝酸盐含量和硝酸盐含量变化趋势不明显。
2.4 6%的食盐发酵甘蓝亚硝酸盐形成、还原相关的微生物分析
发酵甘蓝亚硝酸盐和硝酸盐含量变化与发酵甘蓝微生物的16S rDNA V3片段DGGE图谱(见图2中B)比对得出,发酵开始检测到G条带,第5天检测不到。发酵第13天时检测到A条带。G条带荧光亮度与亚硝酸盐含量趋于一致,说明G代表微生物(Enterobacteriaceaebacterium)与亚硝酸盐浓度有相关性。A条带为后期条带,说明条带A(Leuconostoccitreum)可能与亚硝酸盐的还原有关。
发酵甘蓝亚硝酸盐和硝酸盐含量变化与18S rDNA的DGGE图谱(见图3中B)对比,发酵开始检测到A条带,第3天未检测到,A条带与亚硝酸盐峰值出现时间相一致,说明条带A代表微生物(Leuconostocgasicomitatum)与亚硝酸盐形成相关;发酵初期检测到C条带,第13天未检测到,其与硝酸盐变化规律相一致,说明条带C(Pseudomonassp.)与亚硝酸盐还原相关。条带A代表微生物(Candidasaitoana)、条带F代表微生物(Pichiasorbitophila)和条带G代表微生物(Candidasp.)均是发酵后期(11 d后)出现的微生物,可能与硝酸盐峰值出现有关。
2.5 8%食盐浓度发酵甘蓝亚硝酸盐、硝酸盐含量分析
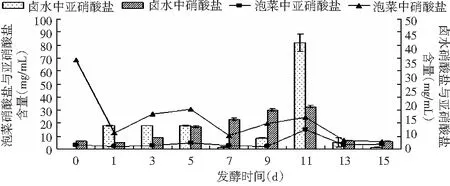
图5 8%食盐浓度发酵甘蓝亚硝酸盐和硝酸盐含量变化Fig.5 Nitrite and nitrate content changes of fermented cabbage with 8% salt concentration
由图5可知,甘蓝发酵初期硝酸盐含量为最大值68.25 mg/mL,之后下降,第5天达到第二次高峰(30.42 mg/mL);发酵甘蓝亚硝酸盐含量范围在2.22~14.77 mg/mL,第11天达到最高值;发酵甘蓝卤水中亚硝酸盐的含量第11天达到最高值40.95 mg/mL,硝酸盐含在第11天出现峰值16.43 mg/mL,亚硝酸盐峰值出现的时间较硝酸盐晚。
2.6 与食盐浓度8%的发酵甘蓝亚硝酸盐形成、还原相关的微生物分析
发酵甘蓝亚硝酸盐和硝酸盐含量变化趋势与发酵甘蓝细菌 V3片段DGGE图谱(见图2中C)比对,条带B(Serratiasp.)条带C(Staphylococcussciuri)条带D(Rahnellasp.)在甘蓝发酵初期,第9天未检测到,推测是硝酸还原菌,导致亚硝酸盐于发酵第11天出现峰值。
发酵甘蓝亚硝酸盐和硝酸盐含量变化与发酵甘蓝微生物18S rDNA的DGGE图谱(见图3中C)对比,发酵第11天前后检测到条带B(Debaryomycesoccidentalis)和条带C(Pichiasorbitophila),推测这些微生物与亚硝酸盐形成有关。
对与亚硝酸盐形成还原相关的微生物总结见表1。

表1 与亚硝酸盐形成还原相关的微生物序列比对结果Table 1 Microbial sequence alignment result related formation and reduction of nitrite
3 讨论
前人研究报道发酵蔬菜亚硝酸盐的形成是杂菌将蔬菜的硝酸盐还原为亚硝酸盐[24]。郭晓红等对甘蓝乳酸发酵初期微生物区系的细菌进行分类并用纯培养方法测定了它们的硝酸盐还原反应,结果表明,肠道细菌科、黄杆菌属、假单胞菌属、葡萄球菌属细菌多为硝酸盐还原反应阳性。纪淑娟等[25]研究显示革兰氏阴性菌、肠道细菌和黄杆菌是影响“亚硝峰”形成的主要微生物。作者前期的研究认为“亚硝峰”的形成主要是由肠杆菌和假单孢菌的硝酸还原酶将甘蓝中的硝酸盐还原成亚硝酸盐。发酵白菜中“亚硝峰”形成时的优势菌经鉴定为阴沟肠杆菌(Enterobactercloacae)。从上述研究结果得知引起亚硝酸盐生成的菌为乳酸菌之外的肠杆菌、假单孢菌、黄杆菌属和葡萄球菌属。
本研究通过PCR-DGGE-克隆的非培养方法分析甘蓝发酵过程中细菌、真菌随发酵时间变化而演变的规律。根据DGGE电泳图谱中的相对含量(由凝胶成像系统的配套软件Quantity-One计算强度)做出随发酵时间的变化图。并和NO2-含量随发酵时间变化图相比较,推测与NO2-形成、还原相关优势微生物的基因片段。分析优势微生物变化与亚硝酸盐含量变化的关系。从DGGE图谱一些特异性条带的出现与消失时间来看,与亚硝酸盐含量的变化趋势相关,通过分析电泳条带测序得出:亚硝酸盐形成的微生物有肠杆菌(Enterobacteriaceaebacterium)、泛菌(Pantoeadispersa)、假单胞菌(Pseudomonassp.)、毕赤酵母(Pichiasorbitophila)、松鼠葡萄球菌(Staphylococcussciuri)、德巴利氏酵母(Debaryomycesoccidentalis)。与亚硝酸盐还原相关的微生物为柠檬明串珠菌(Leuconostoccitreum)和明串珠菌(Leuconostoccitreumstrain)。研究结果与前人用纯培养方法检测的与亚硝酸盐形成相关的微生物(肠杆菌、假单孢菌、黄杆菌属和葡萄球菌属)和与亚硝酸盐还原相关的微生物(乳酸菌)一致,但非培养方法(PCR-DGGE-克隆方法)检测到泛菌、假丝酵母、毕赤酵母、德巴利氏酵母与发酵甘蓝亚硝酸盐形成相关。将来进一步采用纯培养和接种发酵的方法,研究优势菌与亚硝酸盐形成、还原的关系。
4 小结
由本实验研究结果可知,与亚硝酸盐形成相关的微生物主要是假单胞菌(Pseudomonassp.)、肠杆菌(Enterobacteriaceaebacterium)、松鼠葡萄球菌(Staphylococcussciuri)、泛菌(Pantoeadispersa)、德巴利氏酵母(Debaryomycesoccidentalis)、假丝酵母(Candidasp.)及毕赤酵母(Pichiasorbitophila)微生物。与亚硝酸盐还原相关的微生物为柠檬明串珠菌(Leuconostoccitreum)、明串珠菌(Leuconostoccitreumstrain)。

