皮肌炎伴发膀胱肿瘤1例报告
王将 徐冉 赵晓昆 蒋弘毅 张磊 涂门江
皮肌炎(dermatomyositis, DM)是一种少见的炎症性肌病,主要表现为近端肌肉疼痛、无力,以及多种皮肤症状。恶性肿瘤与DM的关系已有报道,与普通人群相比,DM患者恶性肿瘤的发病率更高。但DM合并泌尿生殖系统恶性肿瘤仅有少数报道,DM合并膀胱癌更是极为罕见[1]。中南大学湘雅二医院2018年收治了1例DM合并膀胱癌并最终死亡的患者,现结合相关文献复习报告如下。
患者,男,60岁,2018年3月以“膀胱部分切除术后5年,肉眼血尿40余d”收住院。患者于2013年6月在外院诊断为膀胱癌,接受了膀胱部分切除术及5次经尿道膀胱肿瘤电切术 (transurethral resection of bladder tumor, TURBT)联合膀胱灌注化疗。患者于2017年4月诊断为DM,随即接受了2个月的糖皮质激素治疗,初始剂量为波尼松67.5 mg/d晨起顿服[患者体重67 kg, 泼尼松剂量为1 mg/(kg·d)],维持4周后开始以每周减少5 mg总量的速度逐渐减至47.5 mg/d。但该患者在糖皮质激素治疗2个月后出现了DM相关症状,如起身困难,不能上下楼梯等,患者因此自行停用激素。本次入院后常规实验室检查基本正常。肌酸磷酸激酶(CPK)水平为583.9 U/L(参考值24~195 U/L),血清乳酸脱氢酶(LDH)578 U/L(参考值109~245 U/L),肌红蛋白1 052.6 μg/L(参考值20~70 μg /L)。包括抗双链DNA抗体、抗Jo-1、增殖细胞核抗原在内的自身免疫学相关指标均为阴性。膀胱镜检示膀胱后壁一2 cm×3 cm大小的实性肿瘤。F-18FDG PET提示膀胱癌局部进展并出现膀胱外浸润,但无明显远处转移。见图1。
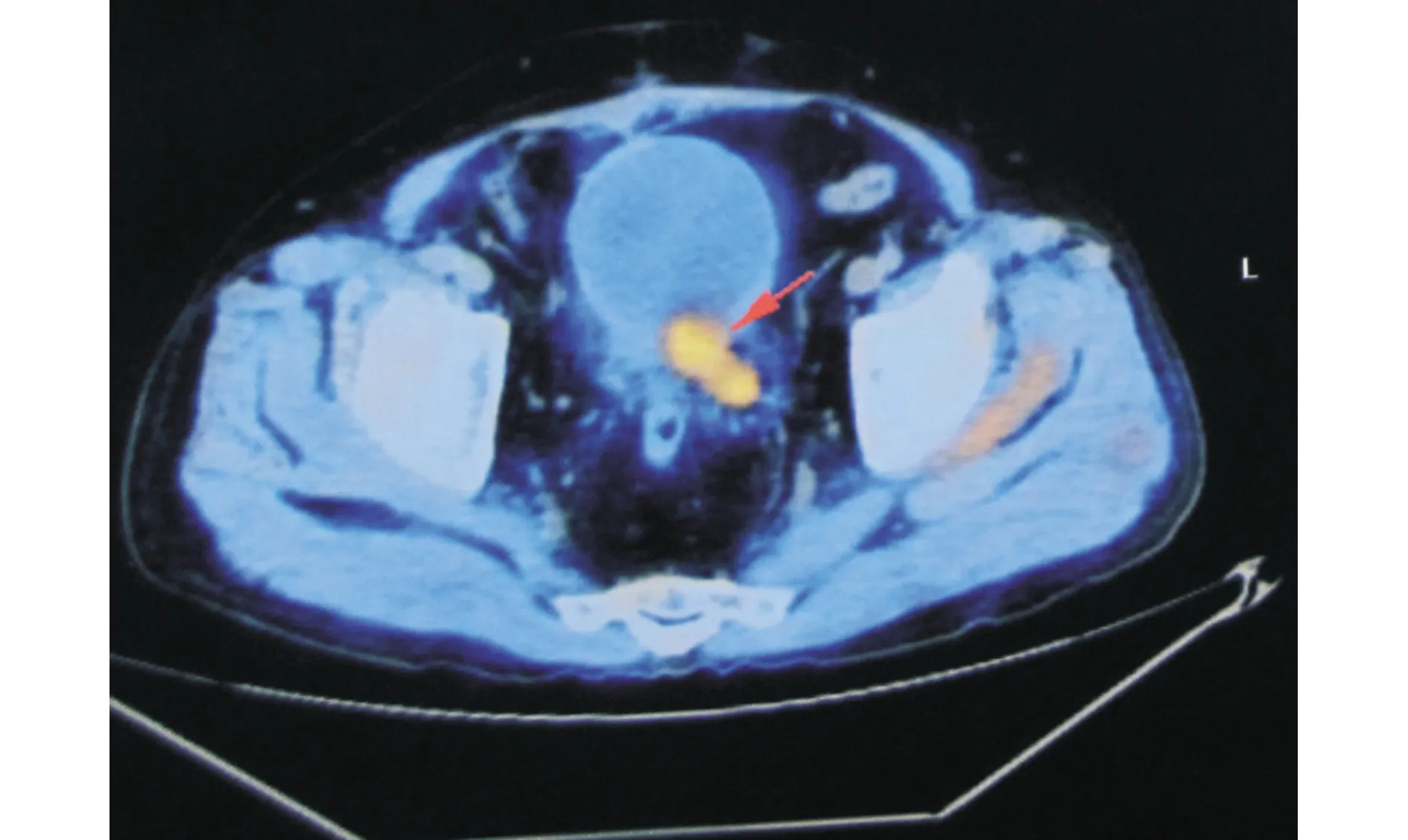
图1 F-18 FDG PET提示膀胱癌局部进展并出现膀胱外浸润
完善术前检查后行膀胱全切术,术中见肿瘤浸润膀胱壁全层。术后病检回报:尿路上皮癌Ⅲ级,浸润膀胱壁全层并侵犯周围脂肪组织。未发现直肠或盆腔淋巴结转移。考虑患者长期使用激素治疗可能影响伤口愈合,故采用双侧输尿管皮肤造口,而不是回肠代膀胱。患者术后恢复尚可,肌力有所好转,CPK、LDH、肌红蛋白水平均转为正常。患者术后3个月出现腹痛症状,肿瘤多发转移,其后2周死亡。
讨论
DM属于自身免疫介导性肌损伤特征的疾病,归类为炎性肌病,累及多个器官系统[1]。DM确切的发病机制尚不清楚。患者出现临床症状时可见几种独特的皮疹,如Gottron皮疹[对称性分布于掌指(趾)关节和指(趾)间关节伸面(背面)红色至紫罗兰色丘疹]、Gottron征(除手部以外的关节伸面出现的红色至紫罗兰色斑疹、斑片或丘疹)、向阳性皮疹(即上眼睑红色至紫罗兰色的皮疹),类似于红斑狼疮患者的面部红斑和按光照部位分布的皮肤异色症等。50%~60%的患者就诊时表现为近端骨骼肌无力。皮肤表现往往出现于肌无力之前或与之同时出现[2]。患者在就医前通常有隐匿性或亚急性起病的肌无力,并在数月内逐渐加重。典型的实验室检查包括肌酶升高、自身抗体和肌炎特异性自身抗体呈阳性、血清和尿液肌红蛋白水平增高。通过皮肤活检,可在光镜下发现与系统性红斑狼疮类似的表现,在组织学上与系统性红斑狼疮难以区分。患者肌电图可能显示膜应激性增加及插入电位延长和自发纤颤等异常表现。然而,由于相似的变化也可见于多种感染性、中毒性或代谢性肌病,故不以单纯肌电图表现诊断DM。DM的诊断通常依赖典型的临床和实验室表现,包括对称性近端肌无力和肌酶升高。DM患者可有高度特征性的皮肤表现,部分DM患者的皮肤表现可不伴肌无力[1]。本例患者首先出现特征性皮肤表现而无肌无力表现,因此于皮肤科就诊并接受实验室检测、皮肤活检及肌电图检测,最终确诊为DM,但由于是外院就诊资料,我们难以取得当时患者就诊时的检验报告。DM的治疗目标是改善肌力,并避免发生肌肉外并发症。糖皮质激素是作为DM的一线初始用药。通常的初始剂量是泼尼松1 mg/(kg·d),最大剂量为80 mg/d。对于病情严重的患者,可在治疗开始时给予甲泼尼龙冲击治疗[3]。本例患者在确诊DM后随即接受皮质醇治疗,但在治疗2个月后又出现了近端肌力下降的症状,因此放弃继续接受糖皮质激素治疗。
值得重视的是,20%~25%的DM患者合并有恶性肿瘤,且主要合并实体肿瘤,这也是患者最危险的合并症[4]。DM和恶性肿瘤之间的精确关联仍不十分明确,但部分患者的癌症发生与DM诊断具有时间关联。有观点认为这些患者的DM是一种与肿瘤发生以及自身免疫性有关的副肿瘤综合征。研究显示,DM可合并乳腺、卵巢、膀胱、宫颈、结直肠、肺和前列腺等多个脏器的肿瘤[5]。癌症可出现于炎性肌病诊断之前或之后,或同时诊断。本例患者在5年前出现膀胱癌,接受了5次TURBT联合膀胱灌注化疗,并在确诊DM后的1年再次出现膀胱癌复发,并因全身多发转移死亡。复习相关文献[6-15]发现,DM伴发膀胱癌的患者中男性发病多于女性(9∶1),这与单纯DM女性患者较常见不同。患者发病年龄范围为60~79岁,平均年龄67.8岁。50%的患者首先出现膀胱癌表现,只有30%的患者DM的诊断先于膀胱癌,另20%为同时发现。DM与膀胱癌的起病间隔时间波动于2周到3年。相较于DM,膀胱癌的症状通常是隐匿的。所有膀胱癌的病理类型均为尿路上皮癌,80%为高危组,40%在首诊时即存在淋巴结转移或远处转移,70%的患者接受了膀胱全切+术后辅助放疗或化疗,其他患者仅接受了TURBT+膀胱灌注免疫疗法或单纯化疗。所有接受治疗的患者,仅30%的患者DM症状得到了缓解。在有随访记录的患者中,几乎所有患者最终都因远处转移而死亡。
上述文献回顾提示,DM可表现为副瘤综合征。DM患者出现血尿时,应进行全面的泌尿系统检查,尤其是对于有膀胱癌病史的患者。与已有的报道不同,本例患者膀胱癌先于DM 5年发病,远超过现有的报道时限。在膀胱部分切除术后,患者出现多次膀胱肿瘤复发,并接受多次TURBT及膀胱灌注治疗。传统理论认为DM患者普遍存在免疫功能缺陷,尤其是免疫监视功能的下降,使得DM患者更易发生恶性肿瘤[16]。因此,尽管缺乏发病早期的手术及病理资料,我们仍可推测,患者在病程前期即存在膀胱癌根治性切除术的指征。在有效的预后资料中,7例患者在疾病被报道时出现高危膀胱癌的远处转移,其中6例已死亡。这些发现与DM合并恶性肿瘤预后较差的既往报道一致。本例患者即在诊断DM 1年后因膀胱癌远处转移死亡。一种可能的解释是,这些患者通常着重于DM的治疗,而忽略了潜在恶性肿瘤的筛查。另一方面,部分肿瘤患者在接受针对肿瘤的治疗后,DM症状得到部分缓解,本例患者同样在仅进行膀胱癌根治术后肌力及CPK、LDH、肌红蛋白水平均转为正常。有学者认为,这是因为肿瘤组织与肌肉、结缔组织等正常组织有交叉抗原性,从而产生各种自身抗体引起损害,在肿瘤得到有效治疗,尤其是瘤负荷减少的情况下,这种自身免疫损害能得到缓解[4,17]。而从本例得到的提示是,对于多次高级别膀胱癌复发的患者,尽早行膀胱癌根治性切除术可能改善预后。在出现DM的症状后,应警惕原有恶性肿瘤进展的可能。尽管与DM相关的自身免疫检查众多,但目前尚缺乏一种特异性较高的针对DM合并恶性肿瘤的标志物。
综上,DM伴发膀胱肿瘤患者多为>60岁的男性,合并的膀胱癌为尿路上皮癌,预后差。DM患者出现血尿时,应进行全面的泌尿系统检查,而有膀胱癌病史的DM患者应警惕膀胱癌复发。
现代泌尿生殖肿瘤杂志2020年2期
