205例肿瘤内科住院患者非甾体抗炎药的临床应用合理性和安全性分析
高榕荫,刘斐烨,徐 巍
(1.常州市第一人民医院/苏州大学附属第三医院药事科,江苏 常州 213003; 2.山东省千佛山医院药学部,山东 济南 250014; 3.山东大学药学院,山东 济南 250012)
非甾体抗炎药(nonsteroidal anti-inflammatory drug,NSAID)是一类结构各异,通过抑制环氧合酶的活性而具有强大的解热、镇痛和抗炎作用的药物。虽然NSAID在世界卫生组织“三阶梯镇痛指南”中具有重要地位,但对于慢性癌性疼痛患者的后续临床研究匮乏,近年来的系统评价结果提示,NSAID在癌性疼痛中的镇痛效果缺乏高质量的研究证据[1-2]。恶性肿瘤患者是一个特殊的群体,周期性的化疗等因素导致了更高的不良反应发生率,且NSAID大多属于非处方药,患者购买使用便利,因此,加强临床用药监护显得尤为重要。本研究针对山东省千佛山医院(以下简称“该院”)肿瘤内科住院患者NSAID的使用情况进行回顾性统计分析,为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
通过数字化病案系统,调取2019年该院使用NSAID的肿瘤内科正常出院患者病历,收集整理患者的基本资料,包括年龄、性别和入院诊断等。
1.2 方法
根据2009美国胃肠病学院《NSAID相关性消化道并发症的预防指南》[3]、《抗血小板药物消化道损伤的预防和治疗中国专家共识(2012更新版)》[4]和《抗栓治疗消化道损伤防治中国专家建议(2016·北京)》[5]等指南文献,整理NSAID相关的胃肠道和心血管不良反应危险因素[6-7],见表1—2。将患者按照低、中和高风险因素进行分层,记录患者住院期间使用的NSAID种类、用法及用量、疗程和不良反应;参照世界卫生组织推荐的限定日剂量(defined daily dose,DDD),计算NSAID的药物利用指数(drug utilization index,DUI),分析评价患者使用NSAID的合理性和安全性。DUI=DDDs/实际用药时间(d);其中,DDDs=某药的总用量(g或mg)/该药的DDD。

表1 NSAID相关胃肠道危险因素分层Tab 1 Layering of NSAID-related gastrointestinal risk factors

表2 NSAID相关心血管危险因素分层Tab 2 Layering of NSAID-related cardiovascular risk factors
2 结果
2.1 患者的基本情况
共纳入205例使用NSAID的肿瘤内科住院患者,其平均年龄为(62.89±12.82);84.39%(173/205)的患者存在1个以上胃肠道风险因素,其中57.07%(117/205)的患者被定义为胃肠道中风险,27.32%(56/205)的患者被定义为胃肠道高风险;55.12%(113/205)的患者属于心血管低危人群,44.88%(92/205)的患者属于心血管高危人群。胃肠道和心血管危险因素分层结果显示,随着胃肠道风险的增高,心血管高危人群的比例也随之升高,表明胃肠道风险与心血管风险呈正相关,见图1。胃肠道危险因素统计结果显示,高剂量NSAID(43.50%)、年龄(41.24%)和联合应用糖皮质激素(36.72%)是最主要的胃肠道危险因素,见图2。
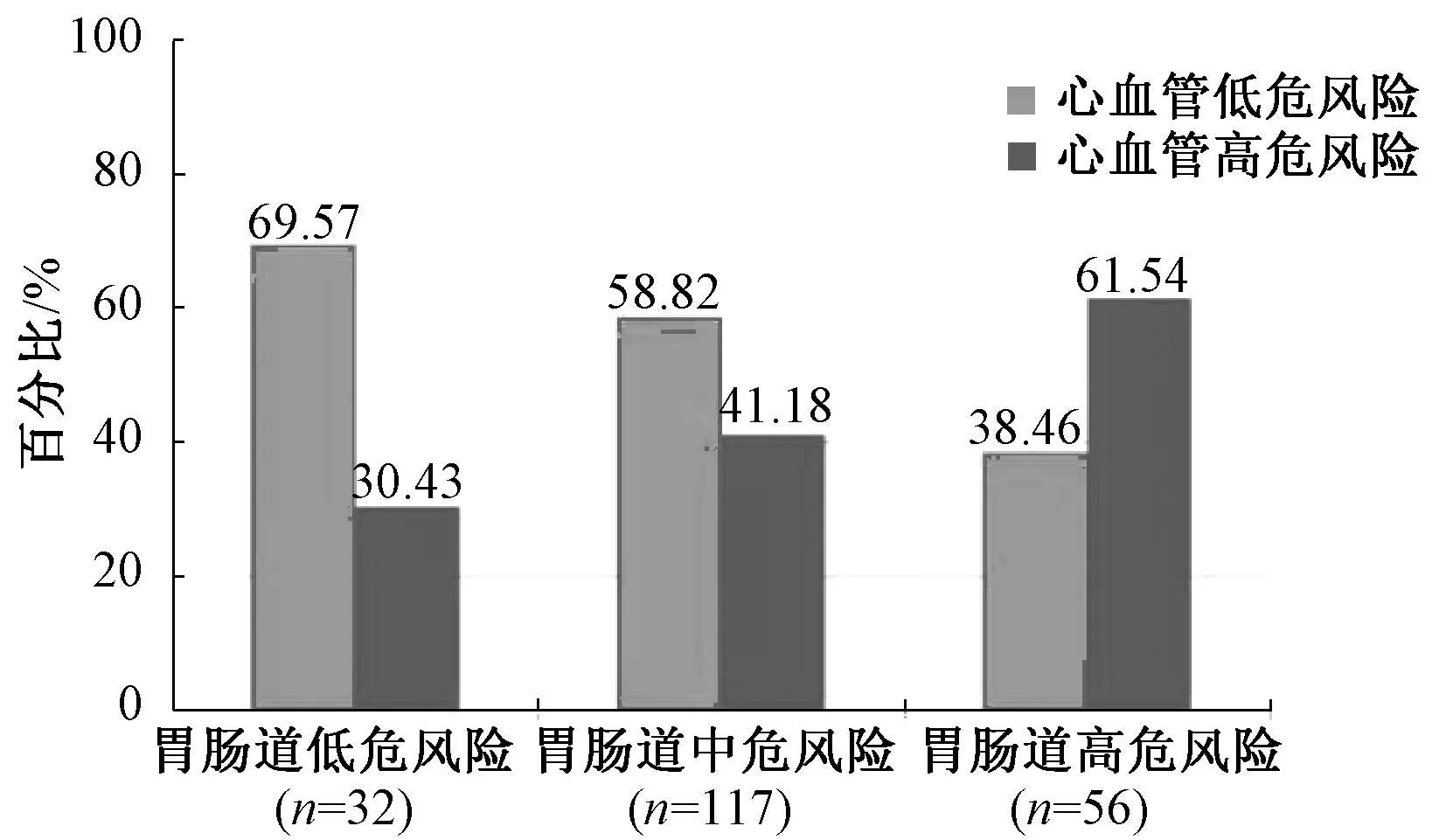
图1 205例肿瘤内科住院患者的胃肠道和心血管 危险因素分层Fig 1 Layering of NSAID-related gastrointestinal and vascular risk factors in 205 inpatients in department of medical oncology
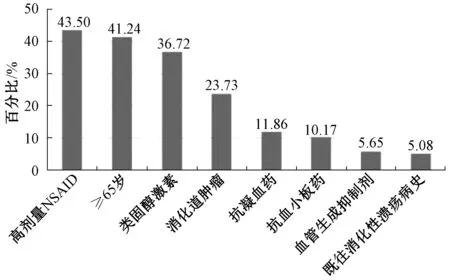
图2 205例肿瘤内科住院患者的胃肠道危险因素统计Fig 2 Gastrointestinal risk factors in 205 inpatients in department of medical oncology
2.2 NSAID的使用情况
NSAID处方中的适应证均为治疗轻中度癌性疼痛(疼痛的视觉模拟评分为2~4分)。使用频率最高的3种NSAID分别为双氯芬酸钠(使用频率为80.59%)、塞来昔布(使用频率为6.75%)和氟比洛芬酯(使用频率为6.33%);其中,双氯芬酸钠的DUI为1.57,表明其临床使用日剂量高于限定日剂量,使用存在不合理,见表3。205例患者使用NSADI存在的主要问题包括:(1)未按照胃肠道风险管理使用NSAID(占35.61%,73/205);(2)未按照心血管风险管理使用NSAID(占40.49%,83/205);(3)用法、用量不适宜(占4.39%,9/205);(4)疗程不适宜(占7.80%,16/205)。
2.3 NSAID的胃肠道和心血管风险管理情况
根据胃肠道和心血管风险分层统计各类NSAID的使用情况,结果见表4。205例患者中,74.58%(153/205)的患者均使用了质子泵抑制剂(proton pump inhibitor,PPI),这可能是因为肿瘤内科患者进行周期化疗,因此多常规应用PPI治疗。(1)心血管低危风险患者中:胃肠道低危风险患者多单用非选择性NSAID(non-selective NSAID,Ns-NSAID)或联合应用PPI,用药基本合理;胃肠道中危风险患者中,85.51%(59/69)的患者选用Ns-NSAID+PPI/H2受体拮抗剂,8.70%(6/69)的患者单用Ns-NSAID;5.80%(4/69)的患者使用选择性环氧酶2(COX-2)抑制剂;根据指南推荐,胃肠道高危风险患者应选择选择性COX-2抑制剂+PPI,但本研究中无1例用药合理。(2)心血管高危风险患者:指南建议,可选择心血管风险较小的萘普生[3]。但本研究中,无1例患者使用该药。(3)16.59%(34/205)的患者被定义为胃肠道高危风险和心血管高危风险人群,应尽量避免使用NSAID,但上述患者均未避免NSAID。
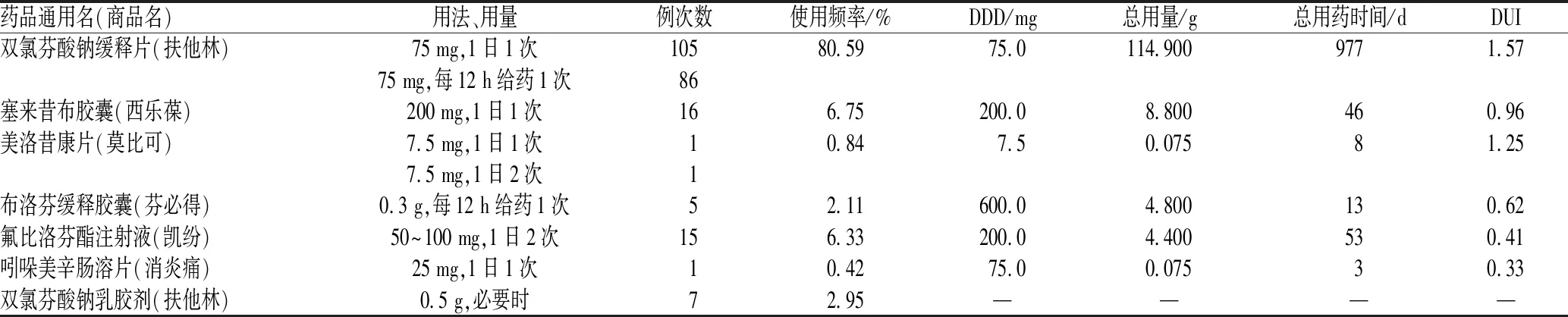
表3 205例肿瘤内科住院患者NSAID的使用情况Tab 3 Application of NSAID in 205 inpatients in department of medical oncology

表4 根据胃肠道和心血管风险分层统计各类NSAID的 使用情况(例)Tab 4 Application of various NSAID according to the layering of gastrointestinal and vascular risk factors(cases)
2.4 NSAID的用法、用量
NSAID具有天花板效应,不宜超过最大推荐日剂量使用。高剂量NSAID的使用本身也是胃肠道出血的危险因素。本调查中,42.44%(87/205)的患者使用了最大推荐日剂量。另外,双氯芬酸钠缓释片和布洛芬缓释胶囊均为缓释制剂,药物在体内可逐渐释放,服用1次可持续12 h镇痛,因此,推荐常规用法为每12 h给药1次。本调查中,共有9例患者为1日2次给药。
2.5 NSAID的使用疗程
使用NSAID治疗中的任何时候都可能出现胃肠道出血、穿孔等不良反应,其风险可能是致命的。尤其在高剂量长期用药的情况下,还可能会导致严重心血管血栓事件风险增加。因此,应根据需要,在最短治疗时间内使用最低有效剂量的NSAID,将不良反应发生率降至最低。本调查中,NSAID平均使用时间为(6.78±5.30) d,其中有16例患者使用疗程>15 d,疗程最长为35 d。此外,NSAID多为非处方药,患者购买便利。临床实践中发现,有多例患者存在自行购买长期用药的现象。
2.6 不良反应
205例患者中,共发生不良反应9例,不良反应发生率为4.39%;其中,上消化道出血3例,下消化道出血5例,肝损伤1例。
3 讨论
3.1 NSAID胃肠道风险的综合管理
肿瘤内科患者往往合并多个胃肠道毒性的危险因素,导致NSAID的使用需格外谨慎。尤其大剂量、长疗程的使用导致相关的胃肠道和心血管不良反应进一步加重,因此,加强临床上的用药监护尤为重要。根据指南推荐,胃肠道低危风险患者无需考虑使用抑制胃酸分泌的药物[3,8]。胃肠道中危风险患者可考虑选择性COX-2抑制剂或者Ns-NSAID+PPI。对于胃肠道高危风险患者,选择性COX-2抑制剂+PPI(1日2次)是预防NSAID消化性溃疡出血最安全有效的方案[9]。此外,H2受体拮抗剂也是最具经济效益的一项选择,但系统评价结果提示需给予2倍常规剂量(如法莫替丁40 mg,1日2次)才能有效预防NSAID相关性溃疡出血[10]。本调查中发现,肿瘤内科对于NSAID品种的选择基本为习惯性用药(主要为双氯芬酸钠,占83.77%),选择性COX-2抑制剂的使用频率仅为7.90%。胃肠道中危风险患者大多都使用了Ns-NSAID+PPI,但胃肠道高危风险患者中仅2例使用了选择性COX-2抑制剂+PPI;而且,几乎所有PPI和H2受体拮抗剂的用法、用量均为常规推荐剂量,并未增加剂量。此外,NSAID引起的消化道不良反应涵盖整个胃肠道。近年来的研究结果显示,NSAID引起的下消化道不良反应发生率逐渐升高[11]。本调查中,5例患者发生NSAID相关的下消化道出血,其均为胃肠道中危风险人群,采用Ns-NSAID+PPI镇痛治疗。研究结果表明,PPI对NSAID引起的下消化道不良反应没有保护作用,相较而言,塞来昔布是对整个胃肠道不良反应风险最小的药物[12]。因此,塞来昔布可能是胃肠道中危风险人群更可靠的选择。
3.2 NSAID心血管风险的综合管理
无论Ns-NSAID还是选择性COX-2抑制剂,都会对心血管系统产生影响。萘普生可能是唯一不增加心血管事件发生概率的NSAID[3,13]。但因国内市场供应不足,且其胃肠道风险相对较高,在本调查中无患者使用萘普生。临床上也可选择心血管风险相对较小的布洛芬和塞来昔布,但需注意不能超过日限制剂量(布洛芬1 200 mg/d,塞来昔布200 mg/d),否则心血管风险会随剂量的增加而增加[14];不建议选择风险较大的双氯芬酸钠或吲哚美辛[15]。心血管疾病作为伴随疾病在肿瘤内科患者中很常见,本调查中,44.88%的患者属于心血管高危人群,而其中90.12%(83/92)的患者均使用了双氯芬酸钠,且大多数为高剂量(150 mg/d)镇痛治疗,临床用药存在明显的不合理性。此外,10.17%的患者长期服用小剂量阿司匹林预防心血管事件。所有的Ns-NSAID均能抑制环氧酶1(COX-1)依赖性的血栓素A2的合成,从而抑制血小板的聚集,因此,选择性COX-2抑制剂应该是低剂量阿司匹林患者预防心血管事件的首选药物。特别重要的是,研究结果表明,与Ns-NSAID联合小剂量阿司匹林相比,塞来昔布联合小剂量阿司匹林可明显降低上消化道不良事件的发生风险[12,16]。因此,综合考虑,小剂量塞来昔布(200 mg/d)可能是目前临床上心血管高危人群的优先选择。
3.3 NSAID在慢性癌性疼痛中的应用
本调查中发现,肿瘤内科NSAID的使用未严格执行相关的指南推荐意见,主要问题是没有重视患者的胃肠道和心血管危险因素分层管理。此外,NSAID大多属于非处方药,患者购买便利,多例患者存在长期购买NSAID用于镇痛的现象。大多数需要NSAID控制癌性疼痛的患者都有胃肠道和心血管相关危险因素,或两者兼而有之,因此,NSAID镇痛治疗的处方应慎重考虑。目前,NSAID相关的指南是都由风湿病学家、胃肠病学家和心脏病学家制定,研究人群以骨关节炎、类风湿性关节炎等患者为主,对于慢性癌性疼痛患者的使用存在一定的局限性。2018年,欧洲肿瘤内科学会发布的《临床实践指南:成人癌性疼痛的管理》[17]提出,基于2017年Cochrone系统评价结果,目前没有确凿的证据支持或反对NSAID用于治疗轻中度癌性疼痛。鉴于NSAID的胃肠道和心血管毒性,对长期使用NSAID的患者进行定期监测和重新评估获益与风险是非常必要的。而世界卫生组织的“三阶梯原则”并不完全适用于慢性癌性疼痛的治疗。目前,各癌性疼痛指南也越来越提倡可以“提前”使用阿片类药物进行镇痛治疗,轻中度癌性疼痛可考虑选择弱阿片类或小剂量的强阿片类药物[18-20]。本调查中,3个主要的胃肠道危险因素中只有高剂量NSAID是可调控因素,但鉴于癌性疼痛是一种慢性、持续性疼痛,减小NSAID的剂量可能并不是一个好的选择,因此,对于该类患者,阿片类药物可能是较NSAID更为安全有效的替代镇痛药。
4 结论
近年来,临床医师对阿片类药物的使用比较重视,经验日渐丰富,但对于NSAID的使用缺乏关注。NSAID是一类历史悠久、临床效益显著且相对安全的解热镇痛药,但对于肿瘤内科患者这个特殊群体而言,却需要谨慎使用NSAID。综上所述,本调查结果提示,应加强对肿瘤内科患者使用NSAID的胃肠道和心血管风险分层管理。提出以下几点建议:(1)临床医师在开具NSAID处方前,应重视对患者的胃肠道和心血管风险评估,权衡获益与风险。(2)NSAID引起的消化道不良反应是涵盖整个胃肠道的,而研究结果表明PPI对下消化道不良反应没有保护作用,因此,选择性COX-2抑制剂可能是更为可靠的选择。(3)对于胃肠道高危风险患者,PPI和H2受体拮抗剂需要使用2倍常规用量,才能有效保护胃肠道。(4)所有NSAID均会对心血管系统产生影响,其风险可能是致命的。因此,医师和患者应对此类事件保持警惕,对于心血管高危人群,应选择风险相对较小的布洛芬和塞来昔布,并注意不要超过日限制剂量。(5)癌性疼痛是一种慢性、持续性疼痛,鉴于NSAID的靶器官损害作用,可以考虑“提前”使用阿片类药物进行镇痛治疗,轻中度癌性疼痛可考虑选择弱阿片类药物或小剂量强阿片类药物。

