CT 和腹腔镜引导下射频消融术治疗膈顶部复发性小肝癌的疗效分析
张弋,李强,赵斌
部分复发性肝癌由于肝功能受损、肝内或肝外多灶性复发以及难切除部位肿瘤等原因,再次手术可能造成的损伤、并发症增多,且危险性大,并不能延长患者的生存期。当手术无法进行时,射频消融(RFA)治疗癌症是一种典型的选择,可采用经皮、腹腔镜或开放手术方法[1],其中影像(超声、CT 或MRI)引导下经皮RFA(US⁃RFA、CT⁃RFA 和MR⁃RFA)和腹腔镜射频消融(L⁃RFA)使用更多[2],两种方法都有各自的优点和缺点[3]。影像引导的RFA 方便、廉价和微创,然而,它也存在一些缺点,如空间分辨率、对横膈有很高的间接热损伤风险[4]。而超声引导的射频消融术因超声显示不佳及穿刺难度大,不适用于膈下肝肿瘤。L⁃RFA可降低副损伤的风险,能够处理肝外疾病,提高了术中超声的检测灵敏度[5]。然而,如果患者有广泛的腹腔粘连,L⁃RFA 很难实施。对于不适合超声引导消融的患者,采用更复杂和有创性的治疗方法,如在CT 引导下的经胸消融和腹腔镜或剖腹手术下的消融被认为是适合此类肿瘤的治疗方法[6,7]。本研究选取我院膈顶部复发性小肝癌患者69 例,分别采用CT⁃FRA 和L⁃RFA 治疗,结果报道如下。
1 资料与方法
1.1 一般资料
选取我院2013 年2 月~2015 年4 月所有符合纳入标准的膈顶部复发性小肝癌的连续性病例,根据采取的治疗方法,将患者分为CT⁃FRA 组和L⁃RFA 组。纳入标准:①均经病理组织学与细胞学检查确诊;②Child⁃Pugh 分级为A 级或B 级;③病灶的最大径不超过3 cm;④无肝癌手术治疗指征或不愿意手术,适合进行FRA 治疗;⑤凝血酶原时间国际标准化比值<1.7;⑥患者及家属知情并签署知情承诺书。排除标准:①肝外转移;②侵犯血管、胆管和邻近器官;③门静脉癌栓或癌性顽固腹水形成;④多次腹部手术,或估计腹腔粘连严重。
共69 例入 组,其 中L⁃FRA 组33 例,包 括女14 例,男19 例,年龄35~74 岁,平均年龄(52.08±7.39)岁,Child⁃Pugh 分级:A 级18 例,B 级15 例;CT⁃FRA 组36 例,包括女15 例,男21 例,年龄35~76 岁,平均年龄(53.12±8.25)岁,Child⁃Pugh 分级:A 级20 例,B 级16 例。两组基线资 料 均 衡可比(P>0.05)。
1.2 方法
仪器:飞利浦64 排Brilliance CT 扫描仪;Med⁃sphere S⁃1500(480⁃千赫)消融仪。术前完善血生化、血常规、凝血酶原时间及活动度、心肺功能、甲胎蛋白(AFP)等检查。术前12 h 禁水、禁食。术前行CT 三期增强扫描,明确病灶大小、病灶膈顶分区、病灶与周围组织关系、穿刺途径。
CT⁃FRA 组:给予CT⁃FRA 治疗。术前0.5 h 给予吗啡10 mg,皮下注射,确认穿刺点。定位后,获取动脉期和门静脉期的非增强和增强CT 图像。选择合适的入路后,射频电极的放置由重复CT 成像引导,将17⁃gauge 电极针穿刺至病灶部位,CT 扫描确认有无附近器官损伤,确定无误后,以95℃、40~100 W 消融6~12 min。如果消融不完全,则重新定位射频电极进行重复消融。
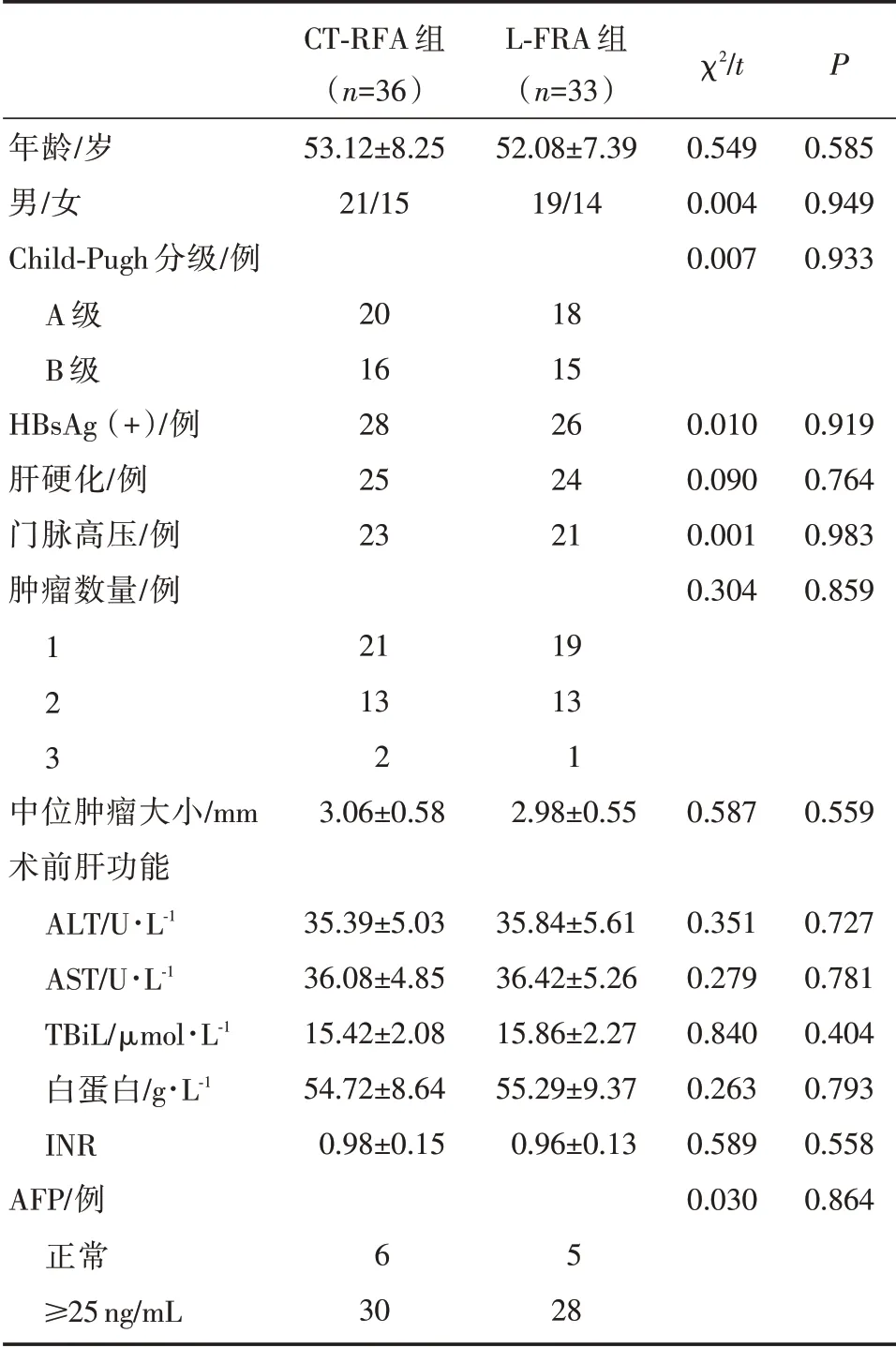
表1 CT⁃RFA 组和CT⁃RFA 组患者基本资料
L⁃FRA 组:给予L⁃FRA 治疗。全麻,仰卧位,建立二氧化碳(CO2)气腹(压力维持约1.3 kPa),在右肋缘放置2 个11 mm 套管针。腹腔镜超声(7.5~10 mHz)识别肝脏病变,彩色超声血流成像用来评估血管分布。超声引导下将18⁃gauge 针芯穿刺到病灶位置,吸取活组织(活检枪),检查病灶,以确认病变。随后,消融针经皮进入病灶开始消融,方法同CT⁃FRA 组。
1.3 观察指标
平均消融时间、活性肿瘤残留率;并发症;住院时间和住院费用;平均存活时间及1、3 年肿瘤局部进展率、总体生存率。
1.4 统计学分析
运用SPSS 21.0 分析,计量资料以(x±s)表示,t检验,计数资料以n(%)表示,χ2检验,P<0.05 表示差异有统计学意义。
2 结 果
2.1 平均消融时间、活性肿瘤残留率
CT⁃FRA 组36 例患者,总计有53 个病灶,平均消融时间(9.95±1.48)min,CT 评估消融效果,53 个病灶中有1 个未彻底消融(2.22%),原因主要是病灶与膈肌过于接近,消融过程中疼痛剧烈,要求停止治疗,此患者随后接受了介入治疗。1 个月后增强CT 扫描显示,53 个病灶中有3 个有活性肿瘤残留(5.7%),接受第2 次消融治疗。L⁃FRA 组33 例患者,总计有48 个病灶,平均消融时间(9.68±1.52)min,1 个月后复查发现,所有病灶中有1 个有活性肿瘤残余(2.1%),再次接受L⁃FRA 治疗。两组平均消融时间、活性肿瘤残留率无显著差异。
2.2 两组住院时间、费用及并发症
两组均无患者死亡,且无胆瘘、膈肌穿孔、气胸、腹腔内出血、肠穿孔、血胸等严重并发症发生;两组发生短期胸腔积液、肝功能异常、短期肝周积液、短暂性呼衰、一过性心衰、肝脏脓肿发生率无显著差异(P>0.05)。两组食欲不振、恶心呕吐、伤口疼痛、肝周脓肿发生率无显著差异(P>0.05);CT⁃FRA 组肩背部疼痛发生率低于L⁃FRA 组(P<0.05)。以上所有并发症除肝周脓肿,均在7 d 左右消失。见表1、2。
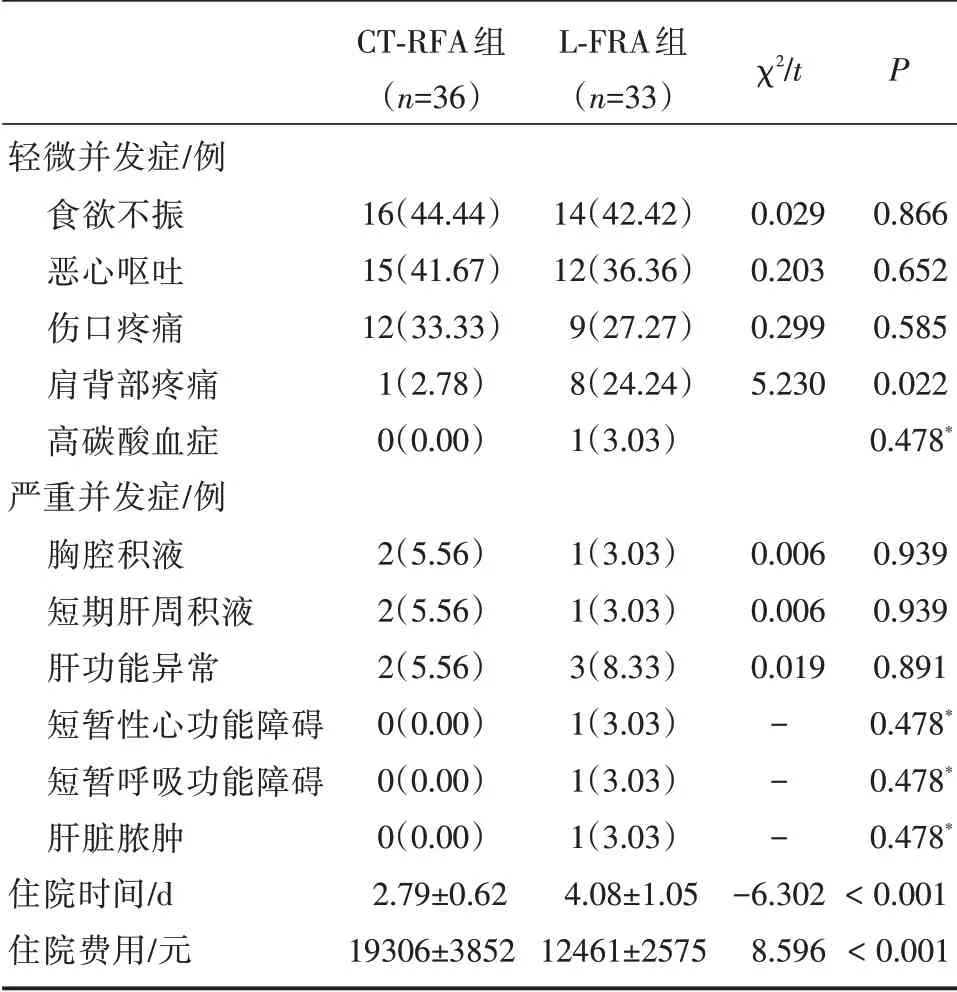
表2 两组严重并发症
2.3 平均存活时间及1、3 年肿瘤局部进展率、总体生存率
CT⁃FRA 组平均存活45 个月,1、3 年肿瘤局部进展率分别是11.11%(4/36)、61.11%(22/36),总体生存率分别是94.44%(34/36)、58.33%(21/36)。L⁃FRA 组平均存活56 个月,1、3 年肿瘤局部进展率分别是6.06%(2/33)、57.58%(19/33),总体生存率分别是96.97%(32/33)、63.64%(21/33)。两组1、3 年肿瘤局部进展率、总体生存率无显著差异(χ21=0.100,P1=0.752;χ22=0.089,P2=0.765;χ23=0.006,P3=0.939;χ24=0.203,P4=0.652)。
3 讨 论
虽然超声引导射频消融是治疗原发性和转移性肝脏恶性肿瘤的公认治疗理念,但肿瘤组织的可视化能力有限和监测由汽化产生的热效应有限[8,9]。CT⁃FRA 和L⁃FRA 方法提供了治疗难治性肝脏肿瘤的途径,尤其是当肿瘤位于肝包膜、邻近胆囊或膈肌下方时[10,11]。本研究中,CT⁃FRA 和L⁃FRA 的疗效、并发症发生和预后的结果表明,两种消融的方法具有较高的成功率和较低的并发症,与文献报道的经皮射频消融治疗肝癌结节的结果相似[12,13]。在复发率、无病生存率和总生存率方面,消融组之间没有发现显著差异。但CT⁃FRA可减少并发症,缩短住院时间,降低住院费用,相对经济、简便、安全。
FRA 可实现消融范围内靶病灶完全坏死,具有微创、有效、可重复性好、住院时间短等优点,明显改善无法手术治疗的肝癌患者预后,且对于可手术的单病灶小肝癌,其疗效与手术切除相当[5]。与传统的超声引导相比,CT⁃FRA、L⁃FRA 在定位肿瘤、划定消融区域方面更精确。L⁃FRA 可更灵敏发现小肿瘤结节,且消融边界更大,理论上可更彻底清除,但要求全麻,医生不能获得患者主诉,无法及时发现、处理术中并发症(膈肌损伤等)[14]。CT⁃FRA 仅需局麻,患者可口头表达不适程度,以及时调整消融,防止严重并发症[7]。但CT⁃FRA 无法实时监测穿刺过程,术前须反复确认穿刺路径、深度、角度。
既往研究显示,影像引导下RFA 完全消融率可达90%~98%,而L⁃FRA 完全消融率为90%~100%[8]。本研究结果显示,L⁃FRA 与CT⁃FRA 完全消融率分别是97.72%(43/44)、93.18%(41/44),组间对比无显著差异(P>0.05)。同时,L⁃FRA 组平均存活时间比CT⁃FRA 组更长,但两组1、3 年肿瘤局部进展率、总体生存率无显著差异(P>0.05)。提示CT⁃FRA、L⁃FRA 均是治疗膈顶部复发性小肝癌的有效手段。
本研究中,两组严重并发症主要为一过性胸腔积液、肝功能异常、一过性肝周积液;L⁃FRA 组发生一过性心衰1 例及可能由CO2气腹引起的一过性呼衰1 例,发生肝脏脓肿1 例,考虑与糖尿病病史有关。轻微并发症方面,CT⁃FRA 组肩背部疼痛发生率低于L⁃FRA 组(P<0.05)。肩背部疼痛发生考虑与膈肌伤害有关,而L⁃FRA 组气腹建立及更彻底消融可能是肩背部疼痛发生更高的原因。但本研究并未发生严重膈肌损伤。此外,L⁃FRA组1 例发生高碳酸血症,考虑由气腹建立引发。本研究结果还显示,CT⁃FRA 组住院时间短于L⁃FRA 组,住院费用低于L⁃FRA 组(P<0.05)。提示CT⁃FRA 可缩短住院时间,降低住院费用。
综上可知,CT⁃FRA、L⁃FRA 均是治疗膈顶部复发性小肝癌的有效手段,但CT⁃FRA 可减少并发症,缩短住院时间,降低住院费用,相对经济、简便、安全。

