SIRT1在5-FU耐药胃癌细胞中的表达及其对细胞化疗耐药的影响
邓晓晶,郑海伦,燕善军,李大鹏
(蚌埠医学院第一附属医院消化内科,安徽 蚌埠 233004)
胃癌是一类病因复杂的消化道恶性肿瘤,我国因胃癌致死人数约占世界胃癌总死亡人数的50%[1]。化疗是不能接受手术治疗时的主要治疗方法之一[2],但肿瘤对化疗药物的单药甚至多药耐药(multi-drug resistance,MDR)引起的化疗失败是影响患者治疗效果和生存质量的主要原因之一[3]。目前,关于耐药产生的关键作用基因及相关作用机制尚无明确定论,且无彻底扭转化疗耐药的相关解决方案与治疗药物。据报道人Ⅲ类组蛋白去乙酰化酶/沉默信息调节因子1(silent information regulator 1, SIRT1)的表达水平在肝癌耐药细胞中异常升高[4],且一系列研究结果表明SIRT1的异常表达与肿瘤耐药相关。SIRT1在胃癌耐药细胞的表达以及对化疗耐药的影响鲜有报道,我们检测了SIRT1在5-FU耐药胃癌细胞(SGC-7901/5-FU)中的表达,并通过SIRT1-siRNA转染SGC-7901/5-FU细胞干扰SIRT1表达后,进行一系列检测,以期对SIRT1在胃癌耐药中的作用及其机理进行初步探讨。
1 材料与方法
1.1 细胞来源
细胞株:SGC-7901细胞株,货号:ZQ0062,购自中乔新舟;SGC-7901/5-FU细胞株,货号:BNCC351837,购自北纳生物。
1.2 试剂与仪器
试剂:总RNA抽提试剂盒Trizol Reagent,货号:15596026,购自Invitrogen公司;qPCR定量试剂盒POWER SYBR GREEN PCR MASTER,货号:4368708,购自Applied Biosystems公司;反转录试剂盒ReverTra Ace qPCR RT Kit,货号:FSQ-101,购自TOYOBO公司;GAPDH抗体,货号:60004-1-1,购自Proteintec公司。重组Anti-Akt1+Akt2+Akt3抗体[EPR16798],货号:ab179463;Anti-Akt(phospho T308)抗体,货号:ab38449;重组Anti-Bax抗体[E63],货号:ab32503;重组Anti-Bcl-2抗体[EPR17509],货号:ab182858;Anti-P-gp抗体,货号:ab242104,购自Abcam公司。HRP标记山羊抗小鼠IgG(H+L)及山羊抗兔IgG(H+L)等购自碧云天生物科技公司;干扰SIRT1表达的siRNA购自广东锐博生物科技有限公司;细胞凋亡检测试剂盒Annexin V-FITC,货号:C1062S,购自Beyotime公司;细胞活性检测试剂盒Cell Counting Kit-8,货号:C0037,购自Beyotime公司;氟尿嘧啶,货号:CSN19496,购自CSNpharm公司。
仪器:实时定量PCR仪,货号:ABI7500,购自ABI公司;高速冷冻离心机,货号:5417R,购自Eppendoff公司;电泳仪,货号:VE180,购自上海天能公司;转膜仪,货号:VE186,购自上海天能公司;OLYMPAS-IX71倒置荧光显微镜,购自OLYMPAS公司;流式细胞仪,购自BD Bioscience公司。
1.3 实验方法
1.3.1 细胞培养
常规方法对SGC-7901及SGC-7901/5-FU细胞进行离心、消化与接种,于37℃的5% CO2培养箱中进行培养。每3天更换1次培养基,待细胞融合度达60%~80%后,胰蛋白酶消化,并按1:3比例进行传代培养。
1.3.2 qPCR实验
收集细胞,Trizol试剂盒提取细胞总RNA,测定其纯度和浓度,按照反转录试剂盒说明书通过反转录酶将其合成cDNA。再以cDNA为模板,GADPH作为内参,制定20 μL反应体系,进行PCR反应,分别检测不同分组细胞中SIRT1mRNA表达量。SIRT1上/下游引物序列为5′-GACTTCAGGTCAAGGGAT-3′/5′-CGTGTCTATGTTCTGGGTA-3′,GAPDH上/下游引物序列为5′-TGACTTCAACAGCGACACCCA-3′/5′-CACCCTGTTGCTGTAGCCAAA-3′。独立重复试验3次,SIRT1 mRNA表达丰度通过2-Ct方法进行测定。
1.3.3 Western blot实验
收集细胞,蛋白质裂解液裂解,离心,BCA试剂盒测定提取的蛋白质浓度,制备SDS-PAGE胶,电泳分离后,将凝胶中的蛋白质由转移电泳槽转至PVDF膜,5%脱脂奶粉封闭PVDF膜2 h,加入待测一抗于4 ℃摇床孵育过夜。第2天加入相应浓度的二抗,于室温条件下孵育2 h。在膜上加200 μL发光液(100 μL A液+100 μL B液),2 min后放入显影仪显影。使用Image J分析条带的灰度值。
1.3.4 CCK8实验
SIRT1-siRNA瞬转SGC-7901/5-FU细胞48 h,加5-FU作用24 h后进行CCK8实验。细胞弃去原培养基,消化,离心,向96孔板中每孔加入100 μL 2 000个细胞,于37 ℃的CO2培养箱中培养。使用移液器向96孔板的每个孔中加入10 μL的CCK-8溶液,将培养板在培养箱中孵育0.5~4 h,使用酶标仪测量450 nm处的吸光度(A),比较不同处理组中细胞存活百分数。存活细胞%=(A实验/A对照)×100%。
1.3.5 流式细胞实验
SIRT1-siRNA瞬转SGC-7901/5-FU细胞48 h,加5-FU作用24 h后进行流式细胞检测。取第3代细胞,弃去原培养基,消化,离心,制成细胞悬液,加入适量Annexin V-FITC溶液与碘化丙啶染色液,轻轻混匀,转移至上样管中,通过流式细胞仪检测细胞待测表面抗原的表达。
1.4 统计学方法
采用SPSS 13.0对实验结果进行处理,实验数据以均数±标准差表示,两组间实验数据比较采用t检验,多组间实验数据比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 实验结果
2.1 SGC-7901和SGC-7901/5-FU细胞中SIRT1 mRNA表达水平
通过qPCR实验检测SGC-7901和SGC-7901/5-FU细胞中SIRT1 mRNA表达水平发现:与SGC-7901细胞相比,SGC-7901/5-FU细胞中SIRT1的mRNA表达水平明显升高,差异有统计学意义(P<0.001)(图1),表明SIRT1基因过表达可能与胃癌细胞耐药相关。
2.2 SGC-7901和SGC-7901/5-FU细胞中SIRT1蛋白表达水平
通过Western blot实验检测SGC-7901和SGC-7901/5-FU细胞中SIRT1蛋白表达水平发现:与SGC-7901细胞相比,SGC-7901/5-FU细胞中SIRT1蛋白表达水平明显升高,差异有统计学意义(P<0.001)(图2),表明SIRT1蛋白过表达可能与胃癌细胞耐药相关。
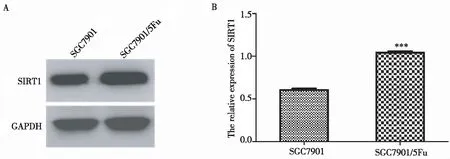
A:Western blot条带;B:SIRT1蛋白相对表达量统计注:与SGC-7901细胞相比***P<0.001图2 SIRT1蛋白在SGC-7901和SGC-7901/5-FU细胞的表达
2.3 转染SIRT1-siRNA后SGC-7901/5-FU细胞中SIRT1 mRNA表达
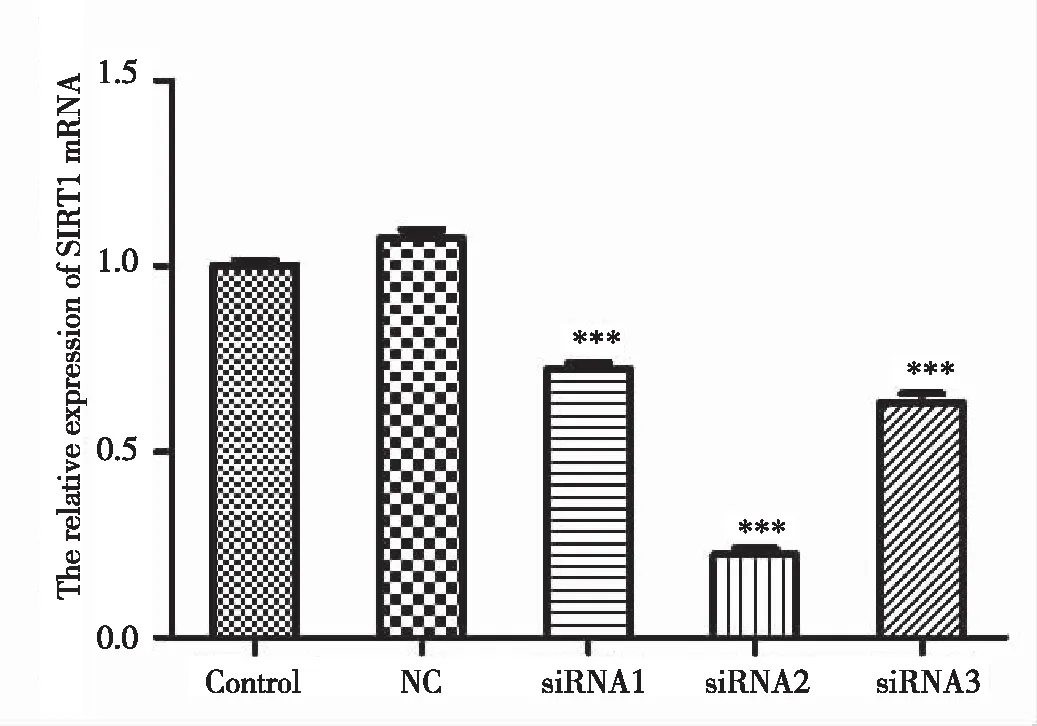
注:与对照组相比***P<0.001
将第3代SGC-7901/5-FU细胞随机分为5组,一组为空白对照(control group),一组为阴性质粒转染组(negative control group,NC),其余3组用不同SIRT1-siRNA转染干扰SGC-7901/5-FU细胞48 h。qPCR实验检测不同组SGC-7901/5-FU细胞中SIRT1 mRNA验证干扰率发现:与未干扰对照组相比,干扰组细胞的SIRT1 mRNA表达水平呈不同程度的降低,差异均有统计学意义(P<0.001)(图3),表明SIRT1-siRNA成功干扰了SGC-7901/5-FU细胞中SIRT1基因的表达,其中第2条siRNA干扰效果最好。
2.4 转染SIRT1-siRNA后SGC-7901/5-FU细胞中SIRT1蛋白表达
不同SIRT1-siRNA转染干扰SGC-7901/5-FU细胞48 h后,Western blot法检测SGC-7901/5-FU细胞中SIRT1蛋白表达水平验证干扰效率发现:与未干扰对照组相比,干扰组细胞SIRT1蛋白表达水平不同程度降低,差异均有统计学意义(P<0.001)(图4),表明SIRT1-siRNA成功干扰了SGC-7901/5-FU细胞中SIRT1蛋白的表达,其中第2条siRNA干扰效果最好。即选择siRNA2进行后续功能实验。

A:Western blot条带;B:SIRT1蛋白相对表达量统计注:与对照组相比***P<0.001
2.5 5-FU对SGC-7901/5-FU细胞存活率的影响
将SGC-7901/5-FU细胞随机分为3组,一组为空白对照(control group),一组为阴性质粒转染对照组(negative control group,NC),干扰组用第2条SIRT1-siRNA转染SGC-7901/5-FU细胞48 h,加5-FU作用各组细胞24 h。CCK8法检测各组A值计算细胞存活率发现:与未干扰对照组相比,干扰组细胞存活率明显降低,差异有统计学意义(P<0.001)(图5),表明干扰SGC-7901/5-FU细胞中的SIRT1表达能够显著提高化疗药物5-FU对胃癌耐药细胞增殖的抑制作用,提示SIRT1表达参与胃癌耐药的形成。

注:与对照组相比***P<0.001
2.6 5-FU对SGC-7901/5-FU细胞凋亡水平的影响
SIRT1-siRNA2转染SGC-7901/5-FU细胞干扰SIRT1表达48 h后,加5-FU作用24 h后,细胞流式实验检测各组细胞凋亡水平发现:与未干扰对照组相比,干扰组细胞凋亡水平显著升高,差异有统计学意义(P<0.001)(图6),表明干扰SGC-7901/5-FU细胞中的SIRT1表达能够显著提高化疗药物5-FU对胃癌耐药细胞凋亡的诱导作用,提示SIRT1表达参与胃癌耐药的形成。
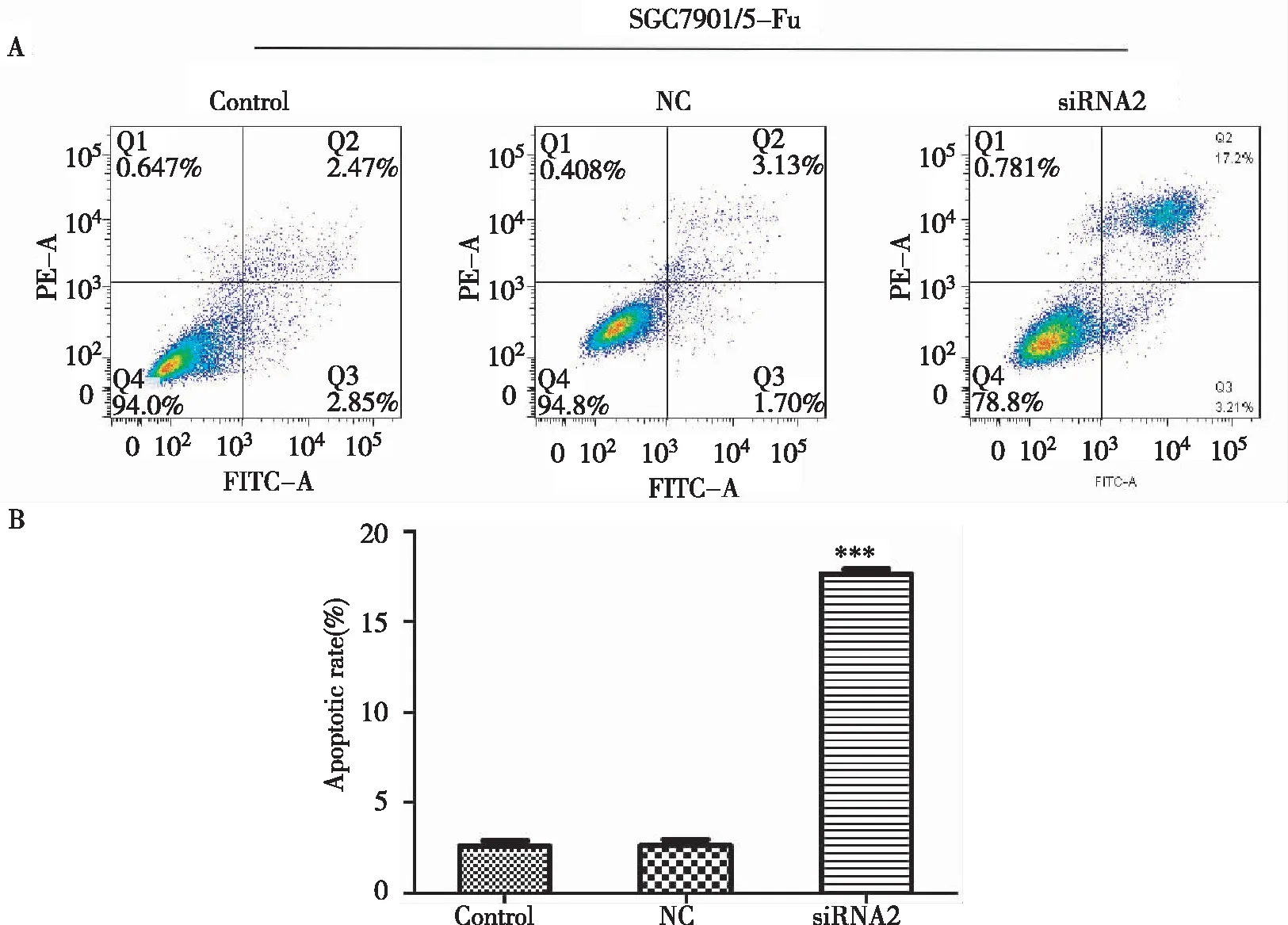
A:细胞凋亡流式结果;B:凋亡率统计注:与对照组相比***P<0.001
图6 5-FU作用于干扰SIRT1表达的SGC-7901/5-FU后细胞凋亡水平变化
2.7 5-FU对SGC-7901/5-FU相关蛋白表达水平的影响

A:Western blot条带;B:相对表达量统计结果注:与对照组相比***P<0.001图7 5-FU作用于干扰SIRT1表达的SGC-7901/5-FU后细胞相关蛋白水平变化
SIRT1-siRNA2转染SGC-7901/5-FU细胞干扰SIRT1表达后,加5-FU作用24 h,Western blot实验检测各组Akt、p-Akt、Bax、Bcl-2和P-pg水平发现:与未干扰对照组相比,干扰组细胞的p-Akt、Bcl-2和P-pg蛋白水平表达显著降低,Bax蛋白水平表达显著升高,差异均有统计学意义(P<0.001)(图7),表明干扰SGC-7901/5-FU中SIRT1的表达能够显著影响5-FU对胃癌细胞增殖、凋亡以及耐药相关蛋白的表达,提示SIRT1可能通过影响细胞增殖、凋亡以及耐药相关蛋白参与胃癌耐药的形成。
3 讨 论
胃癌是全球发病率与致死率较高的恶性肿瘤,尽管目前已有手术、放化疗、生物靶向治疗等多种治疗方法,但其5年生存率仍不到30%[5]。5-FU属于抗代谢类药物,不但可以通过细胞内酶作用影响DNA的复制,也可转化为氟尿嘧啶核苷掺入细胞RNA,干扰蛋白质的合成,从而发挥细胞毒作用,抑制肿瘤细胞功能,常被作为胃癌治疗的标准一线药物,但近年来其易引起化疗耐药甚至MDR严重影响了胃癌化疗疗效[6]。因此,寻找胃癌耐药的可能作用机制,探讨其相关靶点基因成为提高胃癌化疗药物敏感性研究的的热点。
SIRT1是人Ⅲ类组蛋白去乙酰化酶,依赖辅酶NAD+发挥组蛋白去乙酰化作用,参与调节细胞应激反应、DNA修复、染色质重组、代谢、衰老及凋亡过程。在正常细胞中,SIRT1能起到抗衰老、抗代谢性疾病及肿瘤发生等正向作用[7],但肿瘤细胞中SIRT1作用尚无定论。有研究表明SIRT1可以通过阻断一些致癌通路发挥抗肿瘤作用[8]。但也有报道称SIRT1可以对P53等转录因子发挥脱乙酰化作用,削弱其介导的细胞增殖抑制、细胞周期停滞及凋亡过程,此外还可以通过直接抑制部分促凋亡蛋白而起到促肿瘤作用[9]。近年来大量研究表明SIRT1在乳腺癌、肺癌等恶性肿瘤组织中高表达[10-11],可能与肿瘤的恶性程度及预后相关。有报道称70%的胃癌组织出现SIRT1阳性表达,且与胃癌的组织学分型、分期扩散及转移等临床病理参数显著相关[12]。也有报道称SIRTl在胃癌组织中低表达,能够诱导胃癌细胞生长周期停滞,从而抑制胃癌发展[13];还可以通过下调癌基因ARHGAP5的表达抑制胃癌的浸润转移[14]。目前SIRT1在肿瘤细胞中的表达与功能以及相关作用机制还在不断的研究更新中,尚未明确。
化疗耐药主要由药物滥用、肿瘤细胞基因表达异质性和不稳定性等原因导致,可引发肿瘤化疗失败及肿瘤复发,虽然近年来肿瘤化疗药物不断推陈出新,但相较于不断升级化疗方案,探明化疗耐药机制并加以控制、逆转收益更大。近期研究证实SIRT1的异常表达与化疗耐药有关,经化疗药物处理过的肿瘤细胞,即使产生的耐药性比较低,其SIRT1表达水平也会升高[15];如果抑制SIRT1的过表达,化疗药物诱导的肿瘤细胞凋亡则会增加,从而增强肿瘤细胞对化疗药物的敏感性[16]。本研究表明SIRTl在SGC-7901和SGC-7901/5-FU细胞均有表达,但其mRNA与蛋白在胃癌耐药株SGC-7901/5-FU中表达明显升高,提示SIRTl可能与胃癌细胞耐药的产生有关。SIRT1-siRNA干扰SIRT1的表达后,能够明显增强5-FU对SGC-7901/5-FU细胞增殖的抑制作用,提高其对细胞凋亡的促进作用,提示SIRTl可以作为提高胃癌化疗敏感性的有效作用靶点,对其相关作用机制的研究比较有意义。
磷脂酰肌醇 3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路的激活在肿瘤细胞的产生、增殖、发展与凋亡等过程中起到重要作用。Akt在以胃癌为代表的恶性肿瘤中高表达,通过调控凋亡相关蛋白的表达水平,抑制肿瘤细胞的凋亡,从而增加胃癌细胞对5-FU等化疗药物的耐受性[17-18]。PI3K抑制剂预处理胃癌细胞能阻断Akt的磷酸化,增强肿瘤细胞对化疗药物的敏感性[19]。此类研究表明Akt的活化与胃癌耐药的产生密切相关。Bax与Bcl-2是细胞凋亡相关基因,在肿瘤细胞的生长增殖过程中细胞凋亡程序被不同程度的抑制,从而引起线粒体膜上Bcl-2的激活以及细胞质中Bax的失活[20]。P-糖蛋白(P-glycoprotein,P-gp)是主要存在细胞膜上由MDR1基因编码的ATP依赖性跨膜蛋白,通过将化疗药物泵出细胞,引起药物浓度下降从而使肿瘤细胞产生MDR[21]。耐药发生后,P-gp和多药耐药相关蛋白1(MRP1)的表达量显著升高[22],而过表达的SIRTl能促进P-gp蛋白表达[23];干扰SIRT1表达后,P-gp表达量也明显下降[22],提示SIRT1可能通过作用P-gp与胃癌的多药耐药密切相关。本研究中SIRT1-siRNA干扰SIRT1的表达后,p-Akt、Bcl-2和P-pg表达水平显著降低,Bax表达水平显著升高,表明干扰SIRT1的表达后,5-FU通过作用于细胞的P13K/Akt信号通路、凋亡通路以及P-gp的表达,提高了其对胃癌耐药株细胞的杀伤作用。
综上,SIRT1在胃癌耐药细胞中高表达,可能与胃癌耐药的产生密切相关。可通过活化PI3K/Akt细胞信号通路、Bcl-2介导的细胞凋亡控制通路以及上调P-gp的表达,促进胃癌细胞的增殖和抑制细胞凋亡来参与化疗耐药甚至多药耐药的发生。因此,SIRT1有望成为提高胃癌细胞化疗敏感性的一个有效作用靶点,但关于其在化疗耐药中的具体作用机制,尚需深入研究。SIRT1在MDR中的作用亦需纳入更多种类化疗药物的研究进一步验证。

