反复呼吸道感染婴儿型糖原累积病Ⅱ型1例
许津莉,李伟铭,朱 雷,郭华贤
(1.河北北方学院附属第一医院新生儿科,河北 张家口 075000;2.河北北方学院研究生院,河北 张家口 075000)
糖原累积病Ⅱ型(glycogen storage disease typeⅡ,GSDⅡ)又称Pompe病,是一种罕见的糖原代谢障碍性疾病。我们收治了1例以“反复性呼吸道感染、肥厚性心脏病、低肌力”为主要表现后确诊为Pompe病的5月龄婴儿,现报道如下。
1 病例介绍
患儿男,5月龄,第一次就诊时以“咳嗽3 d”入院。患儿晨起咳嗽,程度及频率适中,有痰咳不出,无明显呼吸困难。无发热、腹泻、皮疹及淋巴结肿大。自发病以来,食欲差,精神欠佳,大小便较平常略减少。患儿为第二胎、第二产,足月顺产,母亲妊娠时身体健康,无其他疾病史。人工喂养。患儿无法自行抬头,上肢活动度好于下肢,但仍有“费力感”。3月后未按时接种疫苗。既往无疾病史,无家族遗传病史。父母及10岁姐姐均身体健康。体质量6 kg,发育及营养一般,哭声较低,全身皮肤无苍白、黄染、出血点及皮疹,全身浅表淋巴结未触及。头颅外形正常,无斑秃,无颅骨软化。双侧眼睑无水肿,双侧瞳孔等大等圆。口周红润无发绀及皲裂,口腔黏膜光滑,舌苔薄白,舌外伸,舌乳头无充血,悬雍垂居中,咽部充血,扁桃体不大。听诊两肺呼吸音粗,未闻及啰音。心前区平坦,心尖搏动正常,未触及震颤,心界不大,听诊心音有力,律齐,可闻及心前区杂音。四肢无畸形,全身肌张力弱,双侧肱二、三头肌反射不明显,跟腱反射不明显。克氏征、布氏征及巴宾斯基征阴性。
患儿入院后考虑为急性支气管炎,考虑可能并存先天性心脏病。给予抗感染、雾化等对症治疗,并予以胸部平片及心脏彩超检查。后胸部平片回报:心影增大(图1);心脏彩超示:室间隔、左室壁及右室流出道室壁明显增厚,房间隔缺损2处,分别为2.3 mm、1.8 mm。考虑患儿症状,行先天性遗传代谢病检测,遗传代谢43种串联质谱报告:阴性;染色体核型报告:未发现染色体数目或结构异常。肝胆胰脾门静脉彩超示无结构及血流异常。生化检查无异常。因患儿具有特殊面容,生后肌张力低下,结合心脏彩超及胸片结果,考虑糖原累积症可能,建议进一步行基因检查。
患儿家属为查明病因后就诊于北京儿童医院,行胸部CT:双肺支气管血管未增粗,双肺透光度不均等,双肺少许实质病变。心影增大,心肌增厚,气管变窄、迂回,隆凸略偏右。心脏彩超:双心室腔内径偏小,室间隔及室壁明显增厚,左右流出道狭窄,房间隔缺损(继发孔)。AST(谷草转氨酶):309 U·L-1,ALT(谷丙转氨酶):209 U·L-1,CK(肌酸肌酶):1 319 U·L-1,CK-MB(肌酸肌酶同工酶):39 U·L-1,LDH(乳酸脱氢酶):1 213 U·L-1,BNP(B型钠尿肽)>35 000 pg·mL-1。考虑GSDⅡ可能,行代谢筛查及基因检测。
1月余后患儿再次因发热就诊,热峰39.6 ℃。伴有咳嗽,呼吸稍急促,稍有呻吟。心率160次·min-1,胸骨左缘约2-3肋处可闻及三级收缩期杂音。三凹征(-),双足可见非凹陷性水肿(图2~3)。B型钠尿肽>5 000.00 pg·mL-1。予以心电血氧饱和度检测,在原有抗感染的基础上加用小剂量西地兰,治疗后患儿双足水肿减轻。
北京儿童医院代谢筛查及基因检测结果:根据临床表现型高度相关,且致病性证据充分的基因变异,关联疾病:糖原累积症型Ⅱ型。患儿GAA基因有2个杂合突变,第1个杂合突变的染色体位置:chr17.780 92467,基因突变信息c.2662G>T(p.E888X);第2个杂合突变的染色体位置:chr17.780 82511,基因突变信息c.1210G>C(p.D404H),且经家系验证分析,1处为自发突变,2处变异来自母亲。
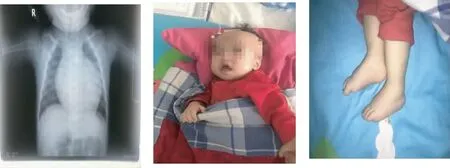
图1 患儿胸片示心影增大 图2 患儿张口呼吸、舌体增大 图3 患儿双足非凹陷性水肿
2 讨 论
GSDⅡ是因先天性缺乏酸性α-葡萄糖苷酶(acid-alpha-glucosidase,GAA)所导致的一种常染色体隐性遗传性疾病,由于GAA基因突变导致溶酶体糖原累积导致心肌、骨骼肌及肝脏的损害[1]。GSDⅡ作为一种罕见病,可根据发病年龄分为婴儿型和迟发型,存活婴儿中发病率约为1/40 000~1/50 000,且婴儿型GSDⅡ患儿存活率极低[2],常因肌张力低引起呼吸功能不全、误吸甚至肺炎[3],伴有心肌病及肝脏损害,多在1岁内死亡。观察本例患儿临床症状,发现患儿肌力明显低于同龄儿,且在数月内没有明显改变。最后一次就诊时出现明显的呼吸呻吟及双足非凹陷性水肿等心衰症状。胸部平片可见心脏整体增大。
GSDⅡ发病率较低,且多数病例起病隐匿或是症状不典型,临床上易出现漏诊及误诊。据国内外报道,早期、足量的酶替代治疗是目前GSDⅡ唯一可能的治疗手段[4-5],可显著延长生存期、改善运动、发育及心脏功能。但在我国现有医疗条件下,多数地区及医院很难对这种低发病率的疾病进行有效诊断和治疗。部分国家已经实施GSDⅡ的产前诊断和筛查,对携带该基因以及生育出GSDⅡ患儿的父母,可通过检测绒毛和羊水样本对胎儿DNA进行变异分析[6]。新生儿筛查的常用方法包括:串联质谱法、荧光法及多免疫定量法。有报道称串联质谱技术可用于GSDⅡ患儿用药后的酶活监测[7]。1963年荷兰医生发现检测患者外周血白细胞GGA活性降低程度可用于诊断GSDⅡ,但该检测方法存在偏倚的可能[8]。随着研究的深入,科研工作者们发现GSDⅡ患者的外周血涂片中空泡样及PAS染色为阳性的淋巴细胞数量有所增加,这种简单易行的方法可能会对GSDⅡ的诊断有所帮助[9]。由于先天代谢异常容易导致患儿心脏改变,可通过心电图或超声心动图等常规心脏检查诊断GSDⅡ[10],近年来也有研究人员将心脏磁共振及CT检查用于先天代谢性疾病导致的心脏病的协助诊断[11]。土耳其的一项研究[12]表明GSDⅡ患者尿中6-α-D-吡喃葡萄糖基麦芽三糖(Glc4)水平高于健康对照组,提示Glc4可能成为GSDⅡ的新型诊断标志物。目前GSDⅡ诊断“金标准”仍为通过皮肤成纤维细胞和肌肉组织测定GAA活性。本例患儿通过高通量测序方法进行基因检测,但存在检查周期相对较长的缺点,可能会错失治疗时间,影响治疗及预后;并且因为仪器昂贵及操作难度大,多数医院无法有效实施酶学检测及基因检测。随着研究的深入,科研人员发现GSDⅡ患儿不仅存在心脏与骨骼肌方面的问题,还会出现呼吸、言语及听力、口咽及胃肠道、神经认知等方面的问题。
该患儿以全身肌张力低并伴有心脏功能及影像学改变为特征,并伴随GSDⅡ典型的舌体增大、心肌酶高、肝功能异常等临床表现,后通过基因组测序诊断为GSDⅡ,考虑到如果早期对该患儿进行基因检测可能会对后续治疗及预后产生积极影响。利用现有血涂片及影像学检查等基础检查方法对GSDⅡ进行辅助诊断具有较高的临床价值。

