茶树己糖激酶基因CsHXK2的启动子克隆及表达特性分析
李娜娜 刘 莹,2 张豪杰 王 璐 郝心愿 张伟富 王玉春 熊 飞,3 杨亚军,* 王新超,*
研究简报
茶树己糖激酶基因的启动子克隆及表达特性分析
李娜娜1刘 莹1,2张豪杰1王 璐1郝心愿1张伟富1王玉春1熊 飞1,3杨亚军1,*王新超1,*
1中国农业科学院茶叶研究所 / 国家茶树改良中心 / 农业农村部茶树生物学与资源利用重点实验室, 浙江杭州 310008;2西北农林科技大学园艺学院, 陕西杨凌 712100;3南京农业大学园艺学院, 江苏南京 210095
植物己糖激酶是双功能蛋白, 具有磷酸化己糖和介导糖信号的关键性作用。前期研究中, 我们从茶树中克隆获得4个己糖激酶基因, 其中基因编码492个氨基酸残基, 与拟南芥、番茄归为Type A类HXKs。利用RT-PCR技术, 克隆获得长度为2029 bp的基因启动子。基因可能受到光照、低温、病原菌、糖和多种激素等信号的调控, 且可能特异性表达于叶、花、种子、根系、腋芽等组织。CsHXK2蛋白定位于叶绿体内。酵母突变体功能互补试验表明, 去除叶绿体转运信号肽的CsHXK2成熟蛋白具有葡萄糖和果糖磷酸化活性。茶树组织特异性表达分析显示,基因在根和茎中表达量最高, 而在老叶中表达量最低。基因的表达受低温胁迫而显著下调, 经炭疽菌侵染的茶树叶片内基因的表达也受到显著抑制, 而外源赤霉素(GA3)处理的茶树叶片内基因表达显著上调。本研究结果表明,基因在茶树的生长发育过程和逆境胁迫响应中发挥重要的调控作用。
茶树; 己糖激酶; 启动子; 亚细胞定位; 表达调控
植物己糖激酶HXK (hexokinase, EC: 2.7.1.1)是兼职双功能蛋白。源库组织内, 由淀粉和蔗糖产生的葡萄糖和果糖, 经HXK磷酸化形成葡萄糖-6-磷酸和果糖-6-磷酸, 进而参与糖酵解、呼吸作用、分解与合成等代谢过程, 为植物的生理活动提供能量和中间代谢产物; 此外, HXK在植物糖信号感知中具有重要作用[1-2], 其作为糖传感蛋白, 参与糖信号转导, 感知胁迫、光照、激素和养分等条件, 进而调控植株的基因表达与生长发育[3]。
Dai等[4]利用酵母三重突变体(), 通过功能互补策略, 首次分离获得植物拟南芥基因。随后, 玉米、番茄、水稻、葡萄、马铃薯、烟草、木薯、油菜、梨、麻风树等多种植物的基因相继被分离克隆[5-9]。在双子叶和单子叶植物中均以多基因家族形式存在, 拟南芥有6个[10], 烟草有9个[11], 木薯有7个[6], 水稻有10个[12]。根据N-末端氨基酸序列的保守性和定位信号肽的预测结果, 植物中的HXK蛋白可分为2种类型, 即含有叶绿体转运肽的type A类和具有膜锚定区域的type B类[13-14]。依据HXK是否具有己糖磷酸化功能, HXK蛋白划分为具有磷酸化活性的HXK和缺乏磷酸化活性的HXKL(HXK-like) 2类。如AtHXK1-3蛋白属催化活跃的HXK类, AtHXKL1-3蛋白和NtHXKL1蛋白属催化失活的HXKL类[10-11]。
目前, 对植物己糖激酶的研究主要集中于基因在植物生长发育过程中的作用, 关于其在抗逆胁迫方面的研究则相对较少。组织内超表达拟南芥基因, 植株表现出生长抑制、叶绿素含量减少、光合作用减弱、可溶性固形物和淀粉含量降低、叶片加速衰老以及光合作用相关基因和表达下调等现象[15-16]。利用拟南芥葡萄糖非敏感突变体()研究基因的生理功能[17], 缺乏HXK1葡萄糖催化功能的突变体仍具有多种信号功能, 可调控光合作用基因和表达、细胞增殖、根叶生长、开花和衰老等,突变体表现出对生长素(IAA)不敏感而对细胞分裂素2IP超敏感, 表明植物利用HXK为葡萄糖感受体, 使得养分、光照和激素信号网络相互关联, 从而调控植物的生长与发育。通过RNAi技术抑制基因在油菜籽苗内的表达, 植株具有生长迟缓、矮化、叶片卷曲特征, 表明参与植物的生长发育过程[7]。胁迫过程中,、和基因能响应甲基紫精和病原体侵染诱导的氧化胁迫, 高水平的HXK能增强对氧化胁迫的抵抗力[18];和基因能在低温、高盐处理下表达上调[14]; 麻风树、和基因在叶片内同样能响应低温而诱导表达[9]; 油菜、和基因能响应核盘菌在抗性品种内的侵染而表达显著上调[7]。
茶树[(L.) O. Kuntze]是我国重要的经济叶用型作物, 在其生长过程中频受低温、干旱、高盐、病原菌等胁迫。因此, 挖掘茶树重要抗性基因、阐明茶树抗逆分子机制、选育强抗逆茶树品种, 是减少环境胁迫造成茶产业经济损失的重要举措。基于基因在拟南芥等植物中的重要作用, 本研究开展了茶树基因的分析研究, 以期获得基因在茶树生长发育及抵御胁迫过程中的生理功能。本课题组前期已从茶树‘龙井43’组织内克隆获得4个己糖激酶基因~。基因(NCBI登录号为KX159478)的开放阅读框(open reading frame, ORF)长度为1479 bp, 编码492个氨基酸; CsHXK2蛋白含有叶绿体转运信号肽而不具备跨膜螺旋结构, 且具有保守的ATP结合和糖结合区域, 属于type A类和磷酸化功能活跃的HXK类[19]。本研究进而对基因启动子进行克隆, 并深入分析该段启动子的顺式作用元件构成, 探明该编码蛋白的亚细胞作用位点以及己糖磷酸化活性,并检测该基因在茶树不同组织器官内以及低温、炭疽菌、赤霉素处理下的表达变化。以期为阐明基因在茶树中的生理功能提供理论依据。
1 材料与方法
1.1 试验材料
茶树苗栽培于中国农业科学院茶叶研究所试验地(30.18°N, 120.09°E)。室内赤霉素、低温处理以及不同组织器官取样的茶苗为同一批盆栽的‘龙井43’, 即于2015年移栽入花盆内的一年生茶苗。2016年, 待盆栽苗在自然条件下新梢萌展至一芽二叶, 将茶苗移至人工气候室内适应性培养14 d [14 h光照/10 h黑暗; (24 ± 0.5)℃; 相对湿度为75%], 把配置好的浓度为50 μmol L-1的GA3溶液均匀喷施至新梢蓬面, 同时以喷施ddH2O作为对照处理, 采摘处理0、1、2、3、5 d的一芽二叶, 用于基因表达分析。2017年, 待盆栽苗在自然环境下新梢萌展至一芽三叶, 将茶苗移至人工气候室内适应性生长7 d [14 h光照/10 h黑暗; (25 ± 0.5)℃; 相对湿度为75%], 随后将温度降至4℃, 低温处理8 d, 再将温度恢复至25℃生长2 d, 采摘低温和常温恢复阶段的一芽三/四叶, 用于基因表达分析。2018年4月, 采集盆栽苗顶芽、第一叶、第二叶、第三叶、老叶、茎和根, 11月采集顶芽、腋芽、花蕾、盛花、老叶、茎和根, 用于基因启动子克隆和组织特异性表达检测。
室内炭疽菌接种的材料为2013年移栽入花盆内的一年生‘龙井43’茶苗。2018年, 待盆栽苗新梢萌展至一芽二叶, 采集离体枝条做针刺叶片有伤处理, 将浓度为1×107个 mL-1的茶树炭疽菌()孢子悬浮液均匀喷施至供试枝条, 并以喷施无菌ddH2O作为对照, 随后保湿培养于光照培养箱内[12 h光照/12 h黑暗; (25 ± 0.4)℃], 处理0、12和24 h后取样, 用于基因表达检测。2017年11月至2018年3月, 每1个月左右, 于上午9: 00—10: 00采集成龄茶树品种‘龙井43’、‘大面白’、‘浙农12’、‘浙农113’的健康成熟叶片(第二、三、四叶), 用于基因表达检测。以上试验均设置3个生物学重复。所有采集的样品立即用液氮速冻, 置于-80°C保存待用。
1.2 基因组DNA、总RNA的提取及cDNA的合成
使用植物基因组DNA提取试剂盒(DP305, 北京天根生化科技有限公司)提取茶树组织DNA, 使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441, 北京天根生化科技有限公司)提取总RNA。利用分光光度计NanoDrop 2000C (Thermo Scientific, 美国)检测DNA和RNA的浓度和纯度, 并分别用1.0%和1.5%琼脂糖凝胶电泳检测DNA和RNA的完整性。随后, 使用PrimeScript RT Reagent Kit with gDNA Eraser试剂盒(TaKaRa, 中国), 取1 μg总RNA为模板合成cDNA第1链。
1.3 CsHXK2基因启动子克隆及生物信息学分析
根据已公布的茶树基因组信息[20], 查找获得基因上游启动子模板序列, 并设计扩增引物(表1)。以‘龙井43’组织DNA为模板, 使用高保真酶PrimeSTAR HS DNA Polymerase (TaKaRa, 中国)进行PCR扩增。PCR产物经琼脂糖凝胶电泳、目的条带回收纯化、连接至PMD18-T载体、转化至感受态细胞后, 取适量转化产物涂板于LB+氨苄青霉素(Amp)的固体培养基, 随机挑选阳性单克隆送测序, 获得目的启动子序列。在New PLACE数据库(A Database of Plant Cis-acting Regulatory DNA Elements; https://www.dna.affrc.go.jp/PLACE/?action=newplace)[21]预测分析启动子序列所含的顺式作用元件。
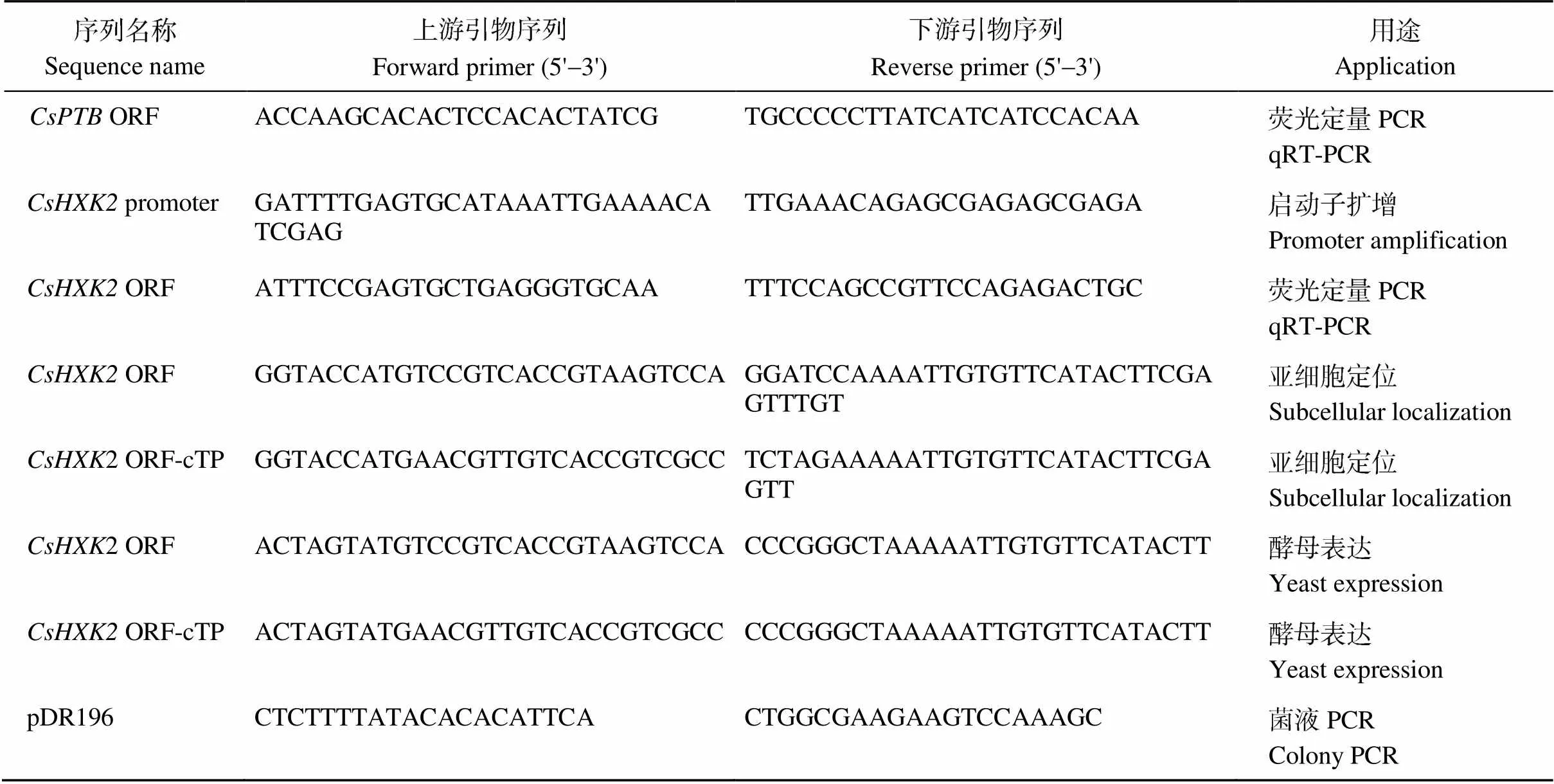
表1 引物信息
ORF: 开放阅读框; cTP: 叶绿体转运信号肽。
ORF: open reading frame; cTP: chloroplast transit peptide.
1.4 CsHXK2基因系列载体构建
以‘龙井43’组织cDNA为模板, 表1对应序列为载体构建引物, 利用高保真酶PrimeSTAR HS DNA Polymerase (TaKaRa, 中国)进行qRT-PCR, 扩增片段经琼脂糖凝胶电泳后切割、回收, 连接至-Blunt Zero中间载体(CB501, Transgen, 中国), 连接反应详见说明书。连接产物转化至感受态细胞DH5α, 菌液涂板于LB+卡那霉素(Kan)的固体培养基上, 筛选阳性单克隆菌液送测序。
使用相对应的限制性内切酶(I和H I,I和I,I和9 I; Thermo scientific, 美国)对中间连接载体CsHXK2::-Blunt Zero、CsHXK2-cTP::- Blunt Zero和终载体35S::sGFP、pDR196进行双酶切, 反应体系详见说明书。酶切产物进行琼脂糖凝胶电泳, 切割、回收目的片段。使用T4 DNA连接酶(M0202, New England Biolabs, 美国)将目的片段与终载体骨架按照3∶1摩尔比进行连接反应, 反应体系详见说明书。连接产物转化至感受态细胞DH5α, 菌液涂板于LB+Kan/Amp的固体培养基上, 鉴定阳性单克隆菌液并送测序。最后, 提取正确的终载体质粒, 即::::、::::、::和::。
1.5 CsHXK2蛋白亚细胞定位
采用农杆菌介导的烟草瞬时表达方法。用冻融法将表达载体::::、::::以及空载体35S::sGFP转化至感受态农杆菌GV3101; 然后将携带目的质粒的农杆菌在10 mL LB+Kan+利福平(Rif)的液体培养基中震荡培养(28℃和220´), 使OD600=1.0~1.2; 取适量菌液, 室温5000´离心5 min后弃上清; 用转化缓冲液(50 mmol L-1MES, 2 mmol L-1Na3PO4, 0.5%葡萄糖, 100 μmol L-1乙酰丁香酮)重悬, 使OD600=0.8~1.0; 用无菌针管将悬浮液注射至烟草叶片, 正常条件下培养48 h后, 用激光共聚焦显微镜(Zeiss, 德国)观察并照相。
1.6 CsHXK2蛋白酵母功能互补验证
采用化学转化法将载体::、::以及空载体pDR196转化至新鲜制备的感受态酵母突变体菌株YSH7.4-3C(己糖激酶//三重缺失)[22]。随后, 将含有重组质粒和空载体质粒的酵母分别稀释至OD600=0.2、OD600=0.04、OD600=0.008和OD600=0.0016, 然后点板生长于含有不同碳源的SD/-Ura选择性培养基上(0.67% yeast nitrogen base, 0.077%-Ura DO Supplement, 2%琼脂, 2% ddH2O/2%半乳糖/2%葡萄糖/2%果糖)[12]。置于30℃恒温培养箱内暗培养4 d后观察、记录并照相。
1.7 CsHXK2基因表达分析
采用实时荧光定量PCR法(qRT-PCR)检测在茶树不同组织器官内和不同处理下的表达情况。基于基因序列[19], 在NCBI的Primer-BLAST网页(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计荧光定量引物(表1), 并用常规qRT-PCR和琼脂糖凝胶电泳检测引物的特异性。选用作为内参基因[23]; 使用LightCycler 480 SYBR Green I Master试剂和LightCycler 480 II仪器(Roche, 瑞士)进行qRT-PCR反应。采用2–∆CT或2–∆∆CT法[24]计算该基因相对表达水平。
1.8 数据获取、处理及分析
使用TPIA数据库http://tpia.teaplant.org/index.html[25]下载茶树品种‘舒茶早’不同组织器官内基因(TEA022532)表达量数据。采用“平均值±标准误”表示; 使用Prism 6.0 (GraphPad, 美国)制作柱状图; 使用SPSS Statistics 20.0软件(IBM, 美国)对数据进行单因素方差分析。
2 结果与分析
2.1 CsHXK2基因启动子克隆及分析
通过qRT-PCR扩增, 获得了特异性的目的条带(图1-A)。经克隆、测序得到基因起始密码子ATG上游−2097 bp至−69 bp启动子序列(图1-B), 其中腺嘌呤(A)数为785个, 占38.69%; 鸟嘌呤(G)数为193, 占9.51%; 胞嘧啶(C)数为228, 占11.24%; 胸腺嘧啶(T)数为823, 占40.56%。
利用New PLACE数据库分析该段2029 bp序列所含的关键顺式作用调控DNA元件。由表2可知, 该启动子含有多种调控茶树响应外在信号的顺式作用元件, 如感知光照、热击、氧气、病菌、创伤、低温、干旱的响应元件, 即-10PEHVPSBD、GATABOX、CCAATBOX1、CURECORECR、ELRECOREPCRP1、LTRE1HVBLT49、MYCCONSENSUSAT等; 如响应生长素、细胞分裂素、水杨酸、乙烯、赤霉素、脱落酸的作用元件, 即ARFAT、ARR1AT、ELRECOREPCRP1、ERELEE4、GARE1OSREP1、MYB1AT等; 多个糖信号响应元件, 即MYBGAHV、SREATMSD、SURE1STPAT21、WBOXHVISO1; 且有ARF、Dof、WRKY、MYB、MYC、RAV1转录因子结合位点, 即ARFAT、DOFCOREZM、ELRECOREPCRP1、MYB1AT、MYCCONSENSUSAT、RAV1AAT等。此外, 还具有调控叶肉、种子、花、根系、腋芽、保卫细胞组织基因表达的元件, 即CACTFTPPCA1、CANBNNAPA、CARGATCON SENSUS、RHERPATEXPA7、SREATMSD、TAAAGSTKST1等。说明茶树基因启动子具备多种调控作用元件, 可能通过参与糖代谢和转导糖信号而调控茶树的生长发育以及逆境胁迫应答。

图1 茶树CsHXK2基因启动子扩增及序列
A:启动子PCR扩增产物电泳图; B:启动子序列。
A: electrophoresis of PCR products ofpromoter; B: sequence ofpromoter
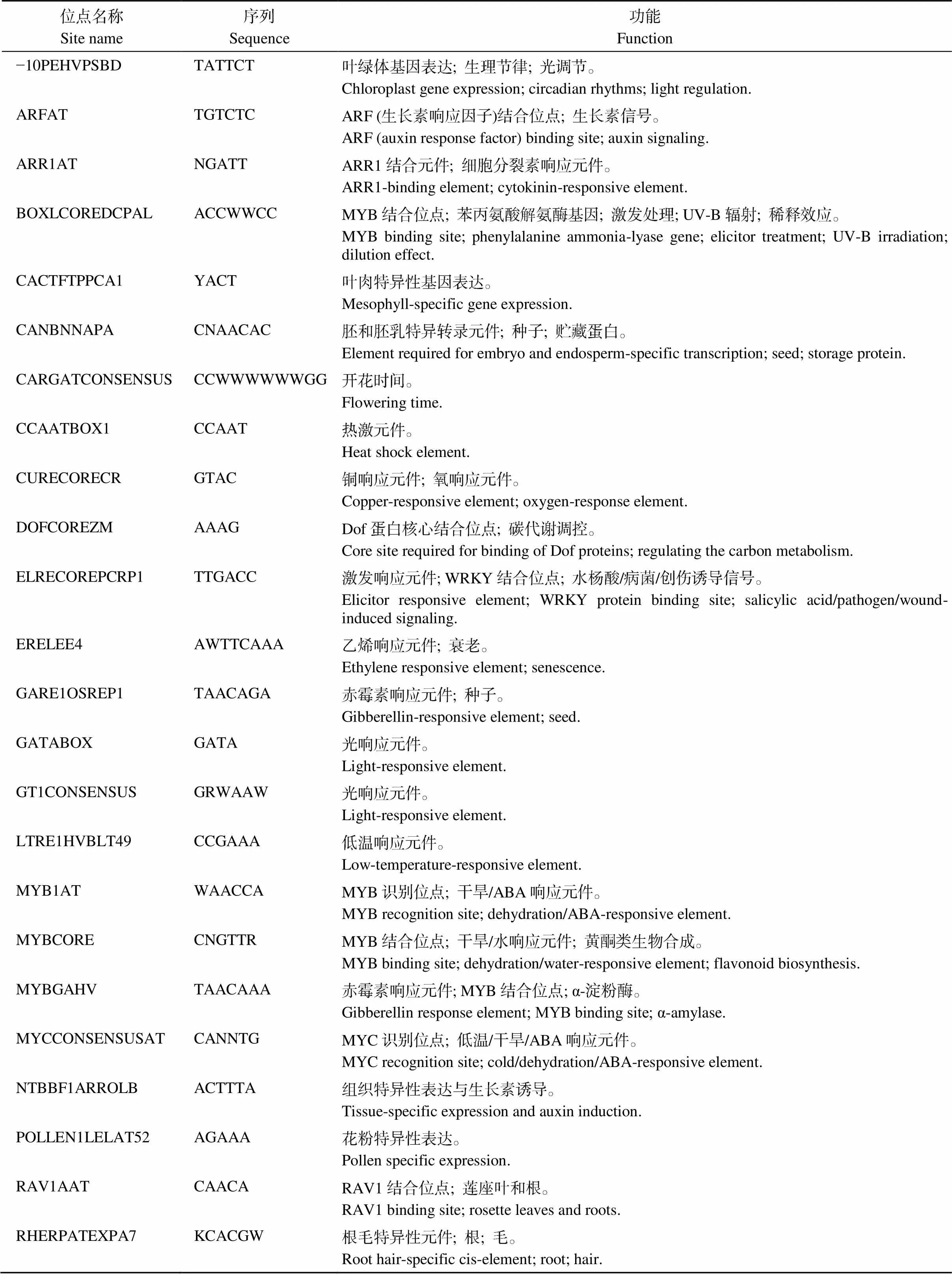
表2 茶树CsHXK2基因启动子的主要顺式作用元件
2.2 CsHXK2蛋白亚细胞定位
将携带::和::::载体的农杆菌注射至烟叶片内。经显微镜观察发现, 注射空载体的叶片在细胞质、细胞膜、细胞核内均具有GFP绿色荧光信号(图2-A, C); 含有CsHXK2融合GFP蛋白的叶片, 细胞内的绿色荧光(图2-D)可以与叶绿素自发红色荧光(图2-E)相互重叠, 呈现出黄色荧光信号(图2-G)。随后, 我们将去除N末端叶绿体转运肽的CsHXK2蛋白融合GFP表达载体(即::::)注射至含有RFP核定位marker的烟草叶片内发现, 含有CsHXK2-cTP融合GFP蛋白的叶片与含有空载体的叶片所发射的绿色荧光信号具有相同的来源(图2-L, O, H, K), 即来源于细胞质、细胞膜、细胞核。表明CsHXK2蛋白定位于叶绿体, 且其蛋白质序列上存在的N末端叶绿体转运信号肽对其定位起到了决定性的作用。
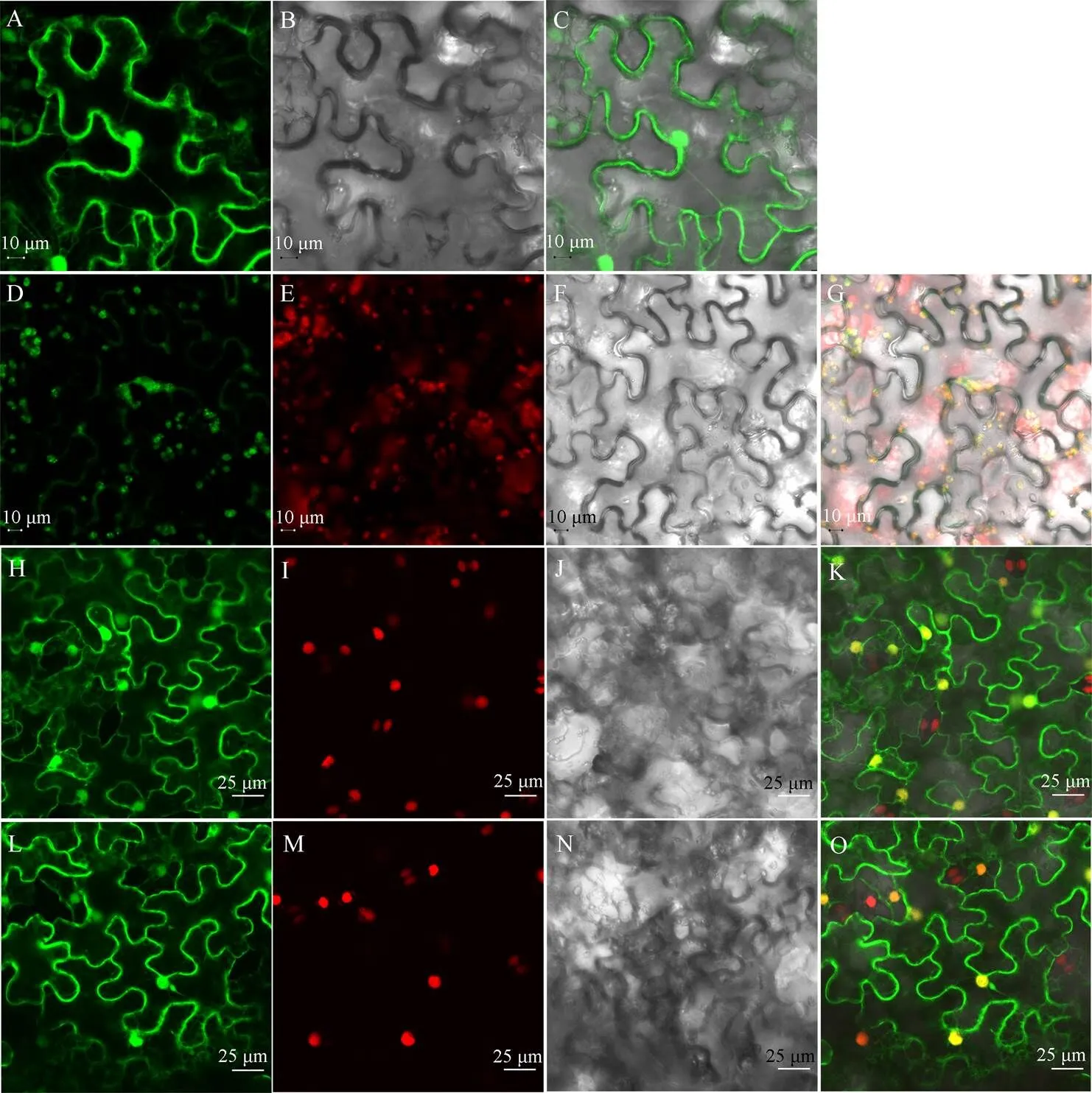
图2 茶树CsHXK2蛋白亚细胞定位
A~C和H~K:::; D~G:::::; L~O:::::。A, D, H, L: GFP绿色荧光信号; E: 叶绿素自发荧光; I, M: 细胞核RFP红色荧光信号; B, F, J, N: 明场; C, G, K, O: 信号融合。
A–C and H–K:::; D–G:::::; L–O:::::. A, D, H, L: GFP green fluorescent signal; E: chlorophyll autofluorescence; I, M: RFP red fluorescent signal of nucleus; B, F, J, N: bright field; C, G, K, O: merged signal.
2.3 CsHXK2蛋白酵母功能互补验证
本研究将::、::酵母表达载体以及空载体pDR196分别转化至缺乏己糖激酶()活性的酵母三重突变体YSH7.4-3C, 转化片段经酵母菌液PCR和电泳跑胶验证正确(图3-E)。点板试验结果显示, 转化空载体、CsHXK2和CsHXK2-cTP的酵母均可在无碳源而仅有yeast nitrogen base、–Ura DO Supplement、琼脂成分的培养基上进行缓慢生长(图3-A), 而在含半乳糖为碳源的培养基上迅速生长(图3-B); 在含葡萄糖为碳源的培养基上, 转化CsHXK2-cTP的酵母长势显著优于转化CsHXK2的酵母, 且二者长势明显优于转化空载体pDR196的酵母(图3-C); 在含果糖为碳源的培养基上, 转化CsHXK2的酵母与转化空载体pDR196的酵母生长势相似, 而转化CsHXK2-cTP的酵母长势显著性优于二者(图3-D)。说明CsHXK2蛋白具有的叶绿体转运肽能显著影响其磷酸化催化活性; CsHXK2成熟蛋白可以磷酸化葡萄糖和果糖。
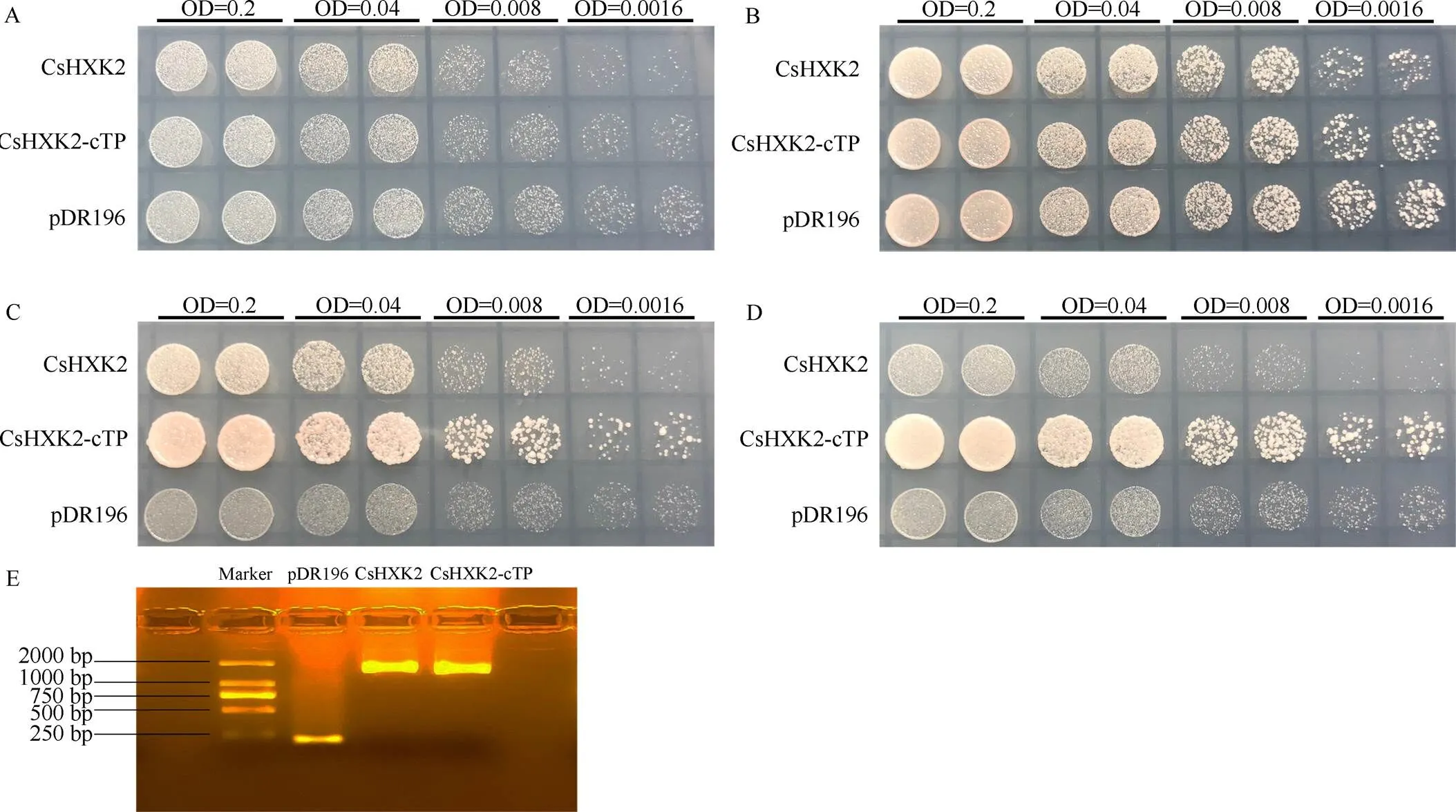
图3 CsHXK2蛋白酵母功能互补验证
A: ddH2O; B: 2%半乳糖; C: 2%葡萄糖; D: 2%果糖; E: 酵母转化片段电泳检测。
A: ddH2O; B: 2% galactose; C: 2% glucose; D: 2% fructose; E: electrophoretic detection of the transformed fragments in yeast.
2.4 CsHXK2基因组织表达特异性
本研究利用qRT-PCR检测了茶树品种‘龙井43’春季和秋季不同组织中基因的表达情况, 并用TPIA数据库[25]获取了基因在茶树品种‘舒茶早’不同组织器官内的表达水平(图4)。‘龙井43’春季组织中,基因表达量在根系中最高, 其次在茎中; 此外, 其表达量随着顶芽生长发育至第三叶而显著性上升; 但在老叶中呈现出最低表达量(图4-A)。‘龙井43’秋季组织中,基因同样在根系内表达量最高, 其次在茎和未绽放的花蕾中, 3个组织内的表达量无显著性差异;基因在腋芽内的表达量显著性高于顶芽, 而在老叶和盛开的花中表达量最低(图4-B)。基因在‘舒茶早’各组织器官内的表达水平呈现出与‘龙井43’组织内相似的表达特异性, 即表达量在根系中最高, 其次在茎中, 而在老叶中最低(图4-C)。表明基因在茶树源库组织内均具有一定的作用, 尤其在库组织根和茎的生长发育和物质代谢中起到重要的作用。
2.5 CsHXK2基因不同处理下的表达模式
对茶树品种‘龙井43’、‘大面白’、‘浙农12’和‘浙农113’自然冷驯化(越冬期)和脱驯化过程中的基因表达情况的分析发现,基因在4个不同茶树品种内具有相似的表达模式, 且在‘龙井43’、‘浙农12’和‘浙农113’内的表达随着环境气温的降低(2017.12.18, 2018.01.12)[26]而显著下调, 并随着气温的升高(2018-03-27)而显著上调(图5-A)。室内4℃低温处理能显著降低茶树叶片内基因的表达量, 且随着处理时间的延长而逐渐降低; 而基因的表达水平随着处理温度恢复至25℃而快速上升至处理前表达量(图5-B)。表明基因的表达受到低温的抑制。
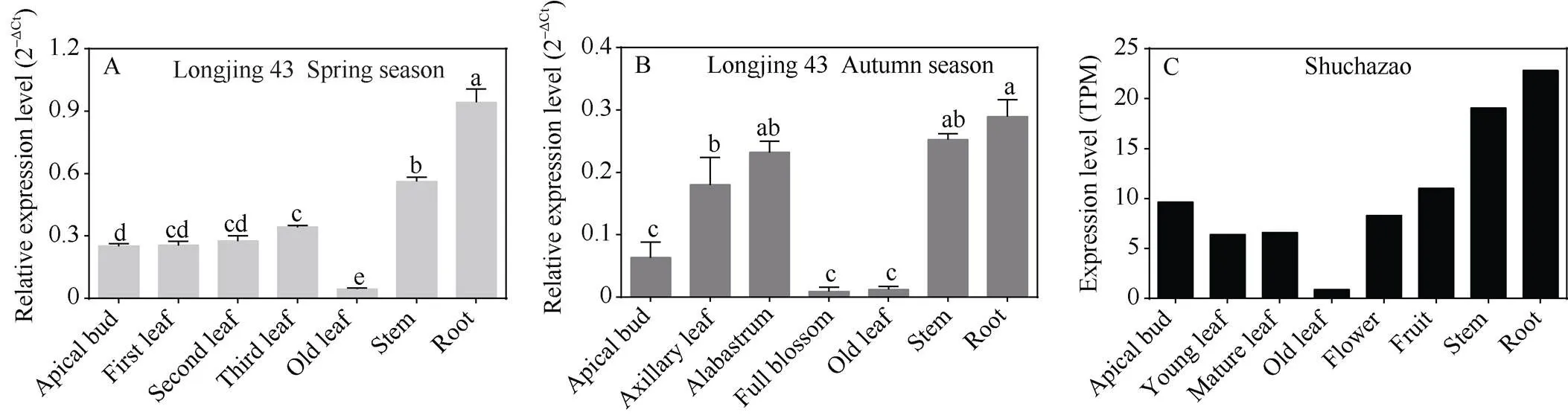
图4 茶树CsHXK2基因的组织特异性表达模式
A: 春季‘龙井43’不同组织; B: 秋季‘龙井43’不同组织; C: ‘舒茶早’不同组织。柱上标以不同字母表示数据间的显著性差异(< 0.05)。
A: different tissues of ‘Longjing 43’ in spring; B: different tissues of ‘Longjing 43’ in autumn; C: different tissues of ‘Shuchazao’. Different letters on the column indicate significant difference between the data (< 0.05).
采用有伤接种的方式, 对‘龙井43’叶片进行针头刺伤后分别喷施ddH2O和炭疽菌孢子悬浮液, 取样后检测基因的表达变化。由图5-C可知, 在刺伤喷洒ddH2O和炭疽菌的叶片中,基因的表达均随着处理时间延长至24 h而显著下调; 在24 h时间点, 炭疽菌处理叶片内的基因表达量显著低于对照。表明基因响应炭疽菌生物胁迫侵染而抑制表达。
对盆栽‘龙井43’叶片分别喷洒ddH2O和50 μmol L-1GA3, 处理后取样并进行基因表达分析。喷洒ddH2O叶片内的基因表达无显著性变化; 而50 μmol L-1GA3处理的叶片内,基因表达量在第3天和第5天显著上升, 且显著高于同一时间点的对照(图5-D)。说明基因参与响应赤霉素信号转导途径。
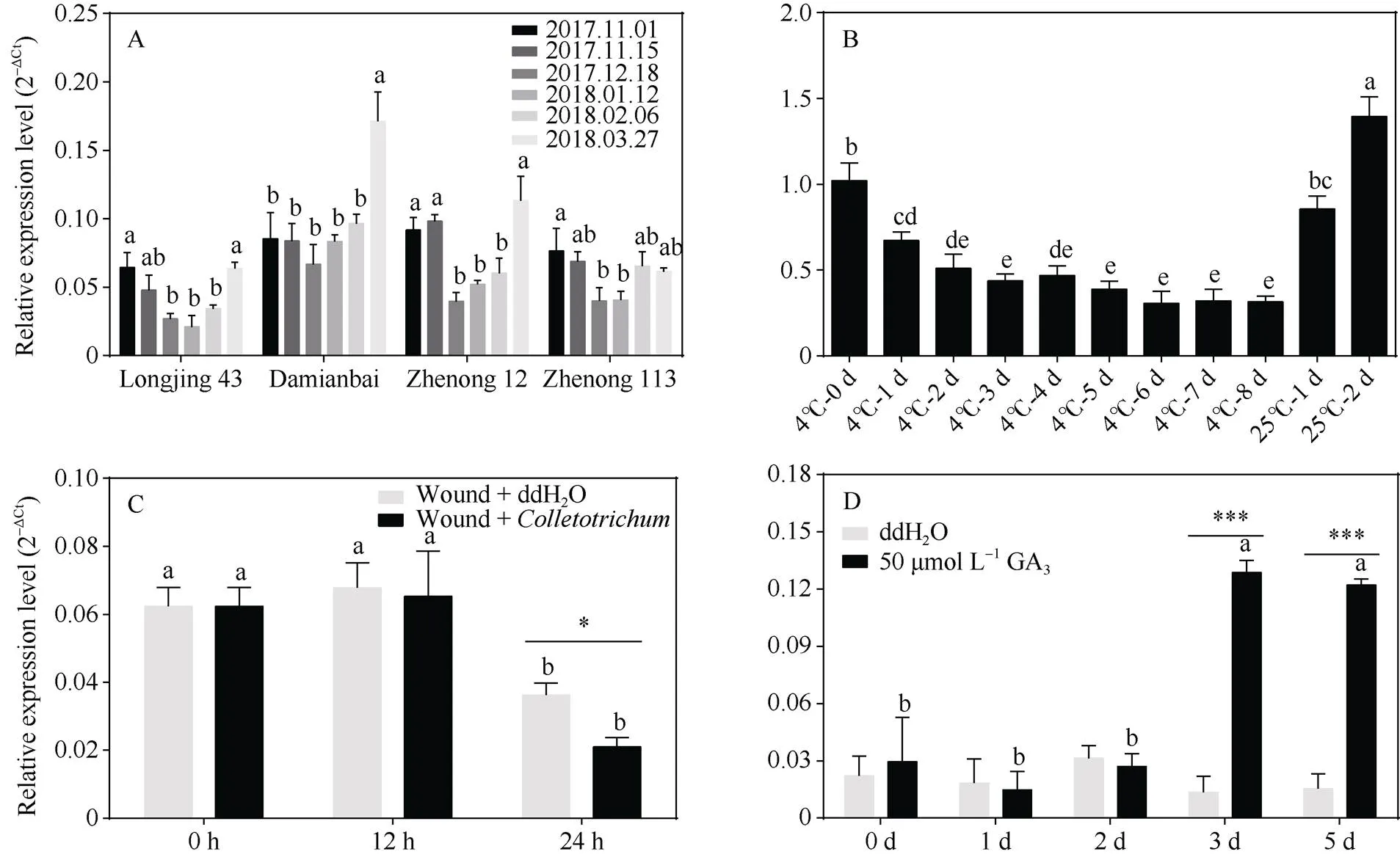
图5 茶树CsHXK2基因在不同处理下的表达分析
A: 自然冷驯化; B: 4℃低温及25℃恢复; C: 炭疽菌接种; D: 50 μmol L–1外源GA3处理。柱上标以不同字母表示数据间的显著性差异(< 0.05)。*表示0.05水平显著; ***表示0.001水平显著。
A: natural cold acclimation; B: 4℃ cold and 25℃ recovery; C: inoculation with; D: 50 μmol L–1exogenous GA3. Different letters on the column indicate significant difference between the data (< 0.05). * indicates significant at the 0.05 probability level; *** indicates significant at the 0.001 probability level.
3 讨论
六碳糖己糖(Hexose), 如葡萄糖和果糖, 是植物中大部分代谢途径和有机物质的最初底物。己糖在参与呼吸作用、合成代谢等过程之前必须被磷酸化[27]。己糖激酶HXKs可以ATP依赖性地磷酸化一系列己糖(通常为葡萄糖和果糖)转换成己糖-6-磷酸; 此外, 许多HXKs如拟南芥AtHXK1, 具有感知糖浓度水平, 进而调控光合系统基因表达、细胞增殖、根和花序生长、叶片扩展和衰老[16-17]。因此, HXKs是参与碳水化合物代谢和糖信号转导的双功能酶, 在植物代谢以及生长发育中起着不可或缺的作用。
与茶树CsHXK2关系密切的亲缘蛋白有拟南芥AtHXK3、水稻OsHXK4、烟草NtHXK2及番茄LeHXK4, 均属于具有叶绿体转运肽的type A类HXKs[19], 且均作用于叶绿体基质[10,12,28-29]。基于酵母己糖激酶功能缺失互补试验发现, LeHXK4全长蛋白不能磷酸化葡萄糖和果糖, 但其去除叶绿体转运肽的成熟蛋白能磷酸化葡萄糖和果糖; 而利用酶活动力学试验发现, LeHXK4具有葡萄糖和果糖磷酸化活性[29]。因此, 转化LeHXK4的酵母突变体不能利用己糖为碳源, 主要是由于叶绿体转运肽所引起的蛋白细胞内定位而造成, 转运肽本身并没有改变酶的催化活性。本研究中, CsHXK2蛋白定位于叶绿体(图2-D和G)内, 具有叶绿体转运肽的CsHXK2蛋白仅能以磷酸化葡萄糖为碳源, 而去除转运肽的CsHXK2成熟蛋白则能催化葡萄糖和果糖为碳源(图3-C和D)。说明CsHXK2成熟蛋白具备己糖磷酸化活性, 而完整CsHXK2蛋白的催化能力仍有待用酶活试验进行进一步的探究。
拟南芥基因在根和种子(长角果)中具有相对丰富的表达量[10,14]; 水稻基因在根、花、幼嫩种子内的表达量明显高于叶片, 且在胚乳内的表达显著高于种皮[12]; 烟草pNtHXK2::GUS活性可在淀粉鞘、木质部薄壁组织、保卫细胞和根尖组织中被检测到, 而在成熟花药内无活性[28]; 质体定位的番茄LeHXK4编码基因可在非光合作用库组织内表达, 包括根、茎、花、绿果、粉果、红果[29]。与同为type A类的、、、基因组织表达特异性相似,基因在茶树的根、茎、嫩叶(芽)、花、腋芽内具有较高的表达量(图4)。这可能归因于基因启动子上具有的根(RAV1AAT和RHERPATEXPA7)、花(CARGATCONSENSUS和POLLEN1LELAT52)、叶肉(CACTFTPPCA1)以及腋芽(SREATMSD)特异性表达元件(表2)。说明基因主要在茶树根、茎等库组织的生长发育中发挥作用, 可能通过磷酸化质体内的葡萄糖和果糖而促进糖代谢, 进而为组织生长发育提供能量和中间代谢物。
茶树原产于热带及亚热带地区, 性喜温暖, 冬季低温和春季倒春寒是威胁茶叶生产的主要气候因素。处于温暖湿润的茶树叶片极易感染由炭疽菌而引发的茶炭疽病, 造成茶叶品质及产量降低。自然冷驯化低温条件下, 茶树叶片内可溶性总糖、蔗糖、葡萄糖及果糖含量显著上升[30-31]。同样, 经炭疽菌侵染的植物叶片内总可溶性碳水化合物、蔗糖、己糖含量明显积累[32-33]。增加的可溶性糖, 包括葡萄糖和果糖, 既能参与细胞内碳和能量代谢, 又能作为信号分子而参与调控植物胁迫响应和生长发育[34]。本研究中基因在低温及炭疽菌处理后叶片内的表达情况表明, 该基因响应低温及炭疽菌胁迫而表达显著下调(图5-A~C)。拟南芥基因响应低温、渗透和盐胁迫而在根系或嫩梢组织内表达降低[14]; 同样为type A类的麻风树基因, 在低温处理24 h的叶片内表达上调, 而在根系内表达下调[9]。因此, 感应低温和炭疽菌而表达抑制的基因是如何参与调节茶树适应外在刺激, 仍有待深入研究。
赤霉素(GA3)作为一种植物激素, 参与调控多种生长发育过程。赤霉素信号途径与糖信号之间存在着紧密关联,其中HXKs是激素与糖联系的一个关键元件。离体矮牵牛花冠内, GA3对赤霉素诱导基因(gibberellin-induced gene)和查尔酮合成酶基因(chalcone synthase gene)表达的诱导受到葡萄糖的促进, 但这种葡萄糖引起的促进效果可以被HXK竞争性抑制剂甘露庚酮糖所完全摧毁, 表明HXKs参与的糖磷酸化相关信号转导与赤霉素信号相互作用, 进而诱导矮牵牛花冠发育过程中的基因表达和花青素积累[35]。阿洛糖作为葡萄糖的差向异构体, 能强烈抑制水稻赤霉素依赖性反应, 如第二叶鞘的伸长以及无胚半稻种子α-淀粉酶的诱导, 也能抑制具有赤霉素组成型响应表型的水稻突变体的生长, 而这些抑制能被HXK抑制剂甘露庚酮糖所阻止, 表明阿洛糖通过HXK依赖途径抑制赤霉素信号传导[36]。本研究检测GA3处理的茶树叶片内基因的表达发现, 该基因转录本在处理样品中有显著的诱导富集(图5-D)。表明茶树赤霉素信号途径和基因表达关系密切, 可能与HXK介导的糖信号途径共同调控茶树的生长发育与逆境胁迫响应有关。
[1] Xiao W Y, Sheen J, Jang J C. The role of hexokinase in plant sugar signal transduction and growth and development.,2000, 44: 451–461.
[2] Rolland F, Sheen J. Sugar sensing and signalling networks in plants.,2005, 33: 269–271.
[3] Baena-González E, Sheen J. Convergent energy and stress signaling.,2008, 13: 474–482.
[4] Dai N, Schaffer A A, Petreikov M, Granot D.hexokinase cDNA isolated by complementation of yeast cells.,1995, 108: 879–880.
[5] Aguilera-Alvarado G P, Sánchez-Nieto S. Plant hexokinases are multifaceted proteins.,2017, 58: 1151–1160.
[6] Geng M T, Yao Y, Wang Y L, Wu X H, Sun C, Li R M, Fu S P, Duan R J, Liu J, Hu X W, Guo J C. Structure, expression, and functional analysis of the hexokinase gene family in Cassava.,2017, 18: 1041.
[7] Wang J X, Wang X M, Geng S Y, Singh S K, Wang Y H, Pattanaik S, Yuan L. Genome-wide identification of hexokinase gene family in: structure, phylogenetic analysis, expression, and functional characterization.,2018, 248: 171–182.
[8] Zhao B Y, Qi K J, Yi X R, Chen G D, Liu X, Qi X X, Zhang S L. Identification of hexokinase family members in pear (×) and functional exploration ofin modulating sugar content and plant growth.,2019, 711: 143932.
[9] Wang H B, Xin H, Guo J Y, Gao Y, Liu C, Dai D Q, Tang L Z. Genome-wide screening of hexokinase gene family and functional elucidation ofresponse to cold stress in.,2019, 46: 1649–1660.
[10] Karve A, Rauh B L, Xia X X, Kandasamy M, Meagher R B, Sheen J, Moore B D. Expression and evolutionary features of the hexokinase gene family in., 2008, 228: 411–425.
[11] Kim Y M, Heinzel N, Giese J O, Koeber J, Melzer M, Rutten T, Von Wirén N, Sonnewald U, Hajirezaei M R. A dual role of tobacco hexokinase 1 in primary metabolism and sugar sensing.,2013, 36: 1311–1327.
[12] Cho J I, Ryoo N, Ko S, Lee S K, Lee J, Jung K H, Lee Y H, Bhoo S H, Winderickx J, An G, Hahn T R, Jeon J S. Structure, expression, and functional analysis of the hexokinase gene family in rice (L.)., 2006, 224: 598–611.
[13] Olsson T, Thelander M, Ronne H. A novel type of chloroplast stromal hexokinase is the major glucose-phosphorylating enzyme in the moss.,2003, 278: 44439–44447.
[14] Claeyssen É, Rivoal J. Isozymes of plant hexokinase: occurrence, properties and functions.,2007, 68: 709–731.
[15] Jang J C, León P, Zhou L, Sheen J. Hexokinase as a sugar sensor in higher plants.,1997, 9: 5–19.
[16] Dai N, Schaffer A, Petreikov M, Shahak Y, Giller Y, Ratner K, Levine A, Granot D. Overexpression ofhexokinase in tomato plants inhibits growth, reduces photosynthesis, and induces rapid senescence., 1999, 11: 1253–1266.
[17] Moore B, Zhou L, Rolland F, Hall Q, Cheng W H, Liu Y X, Hwang I, Jones T, Sheen J. Role of theglucose sensor HXK1 in nutrient, light, and hormonal signaling.,2003, 300: 332–336.
[18] Sarowar S, Lee J Y, Ahn E R, Pai H S. A role of hexokinases in plant resistance to oxidative stress and pathogen infection.,2008, 51: 341–346.
[19] Li N N, Qian W J, Wang L, Cao H L, Hao X Y, Yang Y J, Wang X C. Isolation and expression features of hexose kinase genes under various abiotic stresses in the tea plant ().,2017, 209: 95–104.
[20] Xia E H, Zhang H B, Sheng J, Li K, Zhang Q J, Kim C, Zhang Y, Liu Y, Zhu T, Li W, Huang H, Tong Y, Nan H, Shi C, Shi C, Jiang J J, Mao S Y, Jiao J Y, Zhang D, Zhao Y, Zhao Y J, Zhang L P, Liu Y L, Liu B Y, Yu Y, Shao S F, Ni D J, Eichler E E, Gao L Z. The tea tree genome provides insights into tea flavor and independent evolution of caffeine biosynthesis.,2017, 10: 866–877.
[21] Higo K, Ugawa Y, Iwamoto M, Korenaga T. Plant cis-acting regulatory DNA elements (PLACE) database: 1999.,1999, 27: 297–300.
[22] De Winde J H, Crauwels M, Hohmann S, Thevelein J M, Winderickx J. Differential requirement of the yeast sugar kinases for sugar sensing in establishing the catabolite-repressed state.,1996, 241: 633–643.
[23] Hao X Y, Horvath D P, Chao W S, Yang Y J, Wang X C, Xiao B. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant ((L.) O. Kuntze).,2014, 15: 22155–22172.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–DDCTmethod.,2001, 25: 402–408.
[25] Xia E H, Li F D, Tong W, Li P H, Wu Q, Zhao H J, Ge R H, Li R P, Li Y Y, Zhang Z Z, Wei C L, Wan X C. Tea Plant Information Archive: a comprehensive genomics and bioinformatics platform for tea plant., 2019, 17: 1938–1953.
[26] Wang L, Yao L N, Hao X Y, Li N N, Wang Y C, Ding C Q, Lei L, Qian W J, Zeng J M, Yang Y J, Wang X C. Transcriptional and physiological analyses reveal the association of ROS metabolism with cold tolerance in tea plant.,2019, 160: 45–58.
[27] Granot D, David-Schwartz R, Kelly G. Hexose kinases and their role in sugar-sensing and plant development.,2013, 4: 1–17.
[28] Giese J O, Herbers K, Hoffmann M, Klösgen R B, Sonnewald U. Isolation and functional characterization of a novel plastidic hexokinase from.,2005, 579: 827–831.
[29] Kandel-Kfir M, Damari-Weissler H, German M A, Gidoni D, Mett A, Belausov E, Petreikov M, Adir N, Granot D. Two newly identified membrane-associated and plastidic tomato HXKs: characteristics, predicted structure and intracellular localization.,2006, 224: 1341–1352.
[30] Yue C, Cao H L, Wang L, Zhou Y H, Huang Y T, Hao X Y, Wang Y C, Wang B, Yang Y J, Wang X C. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season.,2015, 88: 591–608.
[31] 田野, 王梦馨, 王金和, 韩宝瑜. 茶鲜叶可溶性糖和氨基酸含量与低温的相关性. 茶叶科学, 2015, 35: 567–573. Tian Y, Wang M X, Wang J H, Han B Y. Correlation of low temperature with soluble sugar and amino acid content in fresh tea leaves., 2015, 35: 567–573 (in Chinese with English abstract).
[32] Lobato A K S, Gonçalves-Vidigal M C, Vidigal P S, Costa R C L, Cruz F J R, Santos D G C, Silva C R, Silva L I, Sousa L L. Changes in photosynthetic pigment and carbohydrate content in common bean cultivars infected by.,2009, 55: 58–61.
[33] Engelsdorf T, Horst R J, Pröls R, Pröschel M, Dietz F, Hückelhoven R, Voll L M. Reduced carbohydrate availability enhances the susceptibility oftoward.,2013, 162: 225–238.
[34] Ma Y Y, Zhang Y L, Lu J, Shao H B. Roles of plant soluble sugars and their responses to plant cold stress.,2009, 8: 2004–2010.
[35] Neta-Sharir I, Shoseyov O, Weiss D. Sugars enhance the expression of gibberellin-induced genes in developing petunia flowers.,2000, 109: 196–202.
[36] Fukumoto T, Kano A, Ohtani K, Yamasaki-Kokudo Y, Kim B G, Hosotani K, Saito M, Shirakawa C, Tajima S, Izumori K, Ohara T, Shigematsu Y, Tanaka K, Ishida Y, Nishizawa Y, Tada Y, Ichimura K, Gomi K, Akimitsu K. Rare sugar D-allose suppresses gibberellin signaling through hexokinase-dependent pathway inL.,2011, 234: 1083–1095.
Promoter cloning and expression analysis of the hexokinase genein tea plant ()
LI Na-Na1, LIU Ying1,2, ZHANG Hao-Jie1, WANG Lu1, HAO Xin-Yuan1, ZHANG Wei-Fu1, WANGYu-Chun1, XIONG Fei1,3, YANG Ya-Jun1,*, and WANG Xin-Chao1,*
1Tea Research Institute, Chinese Academy of Agricultural Sciences / National Center for Tea Improvement / Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, Zhejiang, China;2College of Horticulture, Northwest A&F University, Yangling 712100, Shaanxi, China;3College of Horticulture, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
Hexokinase is a kind of dual-function protein playing a crucial role in hexose phosphorylation and sugar signaling transduction in plants. In our previous study, four hexokinase genes from tea plant were cloned, andgene encoded 492 amino acid residues was classified as Type A HXKs together with AtHXK3 fromand LeHXK4 from tomato. 2029 bp promoter ofgene was obtained by RT-PCR. Further sequence analysis showed thatgene may be regulated by light, low temperature, pathogen, sugars and phytohormones, and specificallyexpressed in leaves, flowers, seeds, roots, axillary buds. CsHXK2 protein was localized in the chloroplast. Functional complementation of the hexokinase-deficient yeast mutant showed that the CsHXK2 mature protein removal of chloroplast transit peptide, had phosphorylation activity of glucose and fructose. Tissue-specific expression analysis found thathad the highest transcriptional levels in roots and stems, whereas the lowest in old leaves. The expression level ofgene was significantly down-regulated in both cold stress treatment and leaves infected treatment by. However, the expression level ofwas significantly stimulated after exogenous GA3treatment in tea leaves. In conclusion, the results suggested thatplayed an important role in the regulation of both development and stress responses in tea plant.
tea plant; hexokinase; promoter; subcellular localization; expression regulation
10.3724/SP.J.1006.2020.94166
本研究由国家自然科学基金项目(31700615), 中国博士后科学基金项目(2017T100119, 2016M600150)和现代农业(茶叶)产业技术体系(CARS-19)资助。
This study was supported by the National Natural Science Foundation of China (31700615), the China Postdoctoral Science Foundation (2017T100119, 2016M600150), and the Earmarked Fund for China Agriculture Research System (Tea) (CARS-19).
杨亚军, E-mail: yjyang@tricaas.com; 王新超, E-mail: xcw75@tricaas.com
E-mail: nanali@tricaas.com
2019-11-06;
2020-06-02;
2020-07-03.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200703.1710.004.html

