阿帕替尼联合多西他赛治疗晚期非小细胞肺癌疗效及安全性的meta分析
余觅 董奇 何杰 孙建
成都医学院第一附属医院呼吸内科610500
肺癌是一个世界性问题,是癌症死亡的主要原因之一[1]。肺癌主要包括非小细胞肺癌 (nonsmall cell lung cancer,NSCLC)和小细胞肺癌,而前者占肺癌总数约80%~85%,主要分为鳞癌、腺癌、腺鳞癌、大细胞癌等[2]。NSCLC 患者早期症状不明显,多数诊断时为晚期,已失去外科手术治疗的机会。目前临床上对于无法进行手术治疗的晚期NSCLC 患者可选择放疗、化疗以及靶向治疗,临床最常用的一线标准治疗方案为以铂类为基础的双药化疗[3]。在一线治疗过程中由于患者出现耐药等情况,从而导致最终治疗效果欠佳甚至治疗失败[4],开发新的靶向药物以及靶向治疗已成为当今研究的热点。
阿帕替尼是我国研发的一种新型分子靶向药物,主要抑制肿瘤血管生成。血管生成是肿瘤增长、发展和转移的重要环节。血管内皮生长因子受体 (vascular endothelial growth factor receptor,VEGFR)通过被血管内皮生长因子 (vascular endothelial growth factor,VEGF)信号通路激活从而促进血管生成;阿帕替尼抑制肿瘤血管生成的机制主要是通过选择性竞争细胞内VEGFR-2 的ATP结合位点,从而阻断下游信号转导[5]。多西他赛又称多烯紫杉醇,是临床经典的紫杉类抗肿瘤药物之一,属抗微管聚集药,多适用于非鳞NSCLC患者,通过干扰细胞分裂周期,从而促进及诱导肿瘤凋亡。有研究显示在多西他赛抗肿瘤治疗基础上结合抑制肿瘤血管生成药物,可达到抑制肿瘤细胞的增殖及凋亡的目的[2]。阿帕替尼现已广泛应用于肝癌、胃癌等消化道恶性肿瘤中,但目前关于阿帕替尼联合多西他赛应用于肺恶性肿瘤的相关研究结果不一致。本研究采用meta分析方法评价阿帕替尼联合多西他赛治疗晚期NSCLC 的疗效及安全性,从而为临床应用提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 纳入随机对照研究,文献语种为中、英文,无论是否采用盲法。
1.1.2 研究对象 (1)通过病理学或细胞学诊断确诊为NSCLC,经病理分期为晚期;(2)无化疗禁忌证; (3)生命体征平稳; (4)年龄、性别不限。
1.1.3 干预措施 对照组接受单用多西他赛化疗,试验组接受阿帕替尼联合多西他赛化疗。
1.1.4 结局指标 疗效指标包括无进展生存期、客观缓解率以及疾病控制率 (disease control rate,DCR)。客观缓解率= (完全缓解例数+部分缓解例数)/总例数×100%。DCR= (部分缓解例数+完全缓解例数+疾病稳定例数)/总例数×100%。安全性指标包括骨髓抑制反应、高血压、腹泻、恶心呕吐、手足综合征等不良反应发生概率。
1.1.5 排除标准 (1)重复发表的研究;(2)会议记录、综述; (3)不能获得完整内容或数据;(4)无对照试验; (5)患者存在严重心脑血管疾病;(6)刚结束化疗或在化疗周期中;(7)患者存在化疗禁忌证。
1.2 检索方法 以 “阿帕替尼”“非小细胞肺癌”“多西他赛”为检索词,计算机检索中国期刊全文数据库、维普科技期刊、万方医学网;以“Apatinib”“Docetaxel” “non-small cell lung cancer” “NSCLC”为 检 索 词,检 索 Pub Med、Cochrane library、EMbase所有关于阿帕替尼联合多西他赛治疗晚期NSCLC的研究,并进行荟萃分析,同时查找相关文献的参考文献以降低漏检率(以上所有数据库检索时间均为建库至2019年9月)。
1.3 文献筛选及资料提取 由两位研究人员严格根据纳入标准以及排除标准,独立筛选文献后进行交叉核对,并提取数据以及评价质量后,采用Revman5.2软件进行meta分析;若筛选过程中出现分歧经讨论后仍无法统一意见,则询问第三位研究人员协助解决。提取内容:(1)基本信息。第一作者,发表年限,文章题目;(2)基线特征。纳入文献的样本、研究对象的年龄、人种、合并症;(3)干预措施。药物的种类、剂量、周期;(4)与本文研究相关的结局指标。
1.4 文献质量评价 根据 “Cochrane系统评价手册5.1.0”[6]对纳入的14篇研究质量进行评价。评价内容包括随机方法、隐藏分配、盲法、结局数完整性、选择性报道及其他可能偏倚。
1.5 统计学分析 采用Rev Man 5.2软件进行meta分析。纳入的研究采用I2检验进行异质性检验,若P<0.1且I2>50%,则采用随机效用模型,并分析其异质性来源;若I2<50%,采用固定效用模型。计数资料的效应指标采用相对危险度(relative risk,RR)、比值比 (odds ratio,OR),计量资料的效应指标采用风险比 (hazard ratio,HR),各效应量均以95%CI表示。
2 结果
2.1 文献检索流程及结果 初检出相关文献207篇,经过简略阅读剔除重复文献58篇,筛选文献阅读文题以及阅读摘要后,余17篇文献;进一步阅读全文后,最终纳入12篇文献[7-18],包括试验组348例,对照组351例。文献筛选流程及结果见图1。
2.2 纳入研究基本情况以及方法学质量评价表 12篇随机对照试验共纳入699 例确诊为晚期NSCLC患者,均为中国人种[7-18]。纳入研究基本情况见表1。纳入的12篇文献中有9篇文献描述了采用随机方法[7-10,12-13,16-18];有4项研究采用了盲法[7-8,12,15];5 项研究描述了分配隐藏方法[8-9,14-15,18],所有文献均未发现选择性报道研究结果,且无其他偏倚存在(表2)。
2.3 meta分析结果
2.3.1 客观缓解率 共纳入12个研究[7-18],各研究间无明显异质性(P>0.1,I2<50%),故采用固定效应模型进行合并分析。分析结果显示:试验组患者的客观缓解率显著优于对照组,差异有统计学意义(RR=1.99,95%CI:1.50~2.64,P<0.01)。见图2。
2.3.2 疾病控制率 共纳入12个研究[7-18],各研究间无异质性(P<0.1,I2<50%),故采用固定效应模型进行合并分析。分析结果显示:试验组患者的DCR 显著优于对照组,差异有统计学意义(RR=1.57,95%CI:1.36~1.83,P<0.01)。见图3。
2.3.3 无进展生存期 共纳入8个研究[7-10,15-18],各研究间无异质性(P>0.1,I2<50%),采用固定效应模型进行合并分析。分析结果显示:试验组患者的无进展生存期优于对照组,差异有统计学意义 (HR=0.28,95%CI:0.25~0.32,P<0.01)。见图4。
2.3.4 不良反应
2.3.4.1 骨髓抑制反应 共纳入11 个研究[7-10,12-18],各研究间无明显异质性(P>0.1,I2<50%),采用固定效应模型进行合并分析。分析结果显示:试验组患者发生骨髓抑制反应的概率与对照组相似,差异无统计学意义 (OR=1.21,95%CI:0.86~1.69,P=0.27)。见图5。
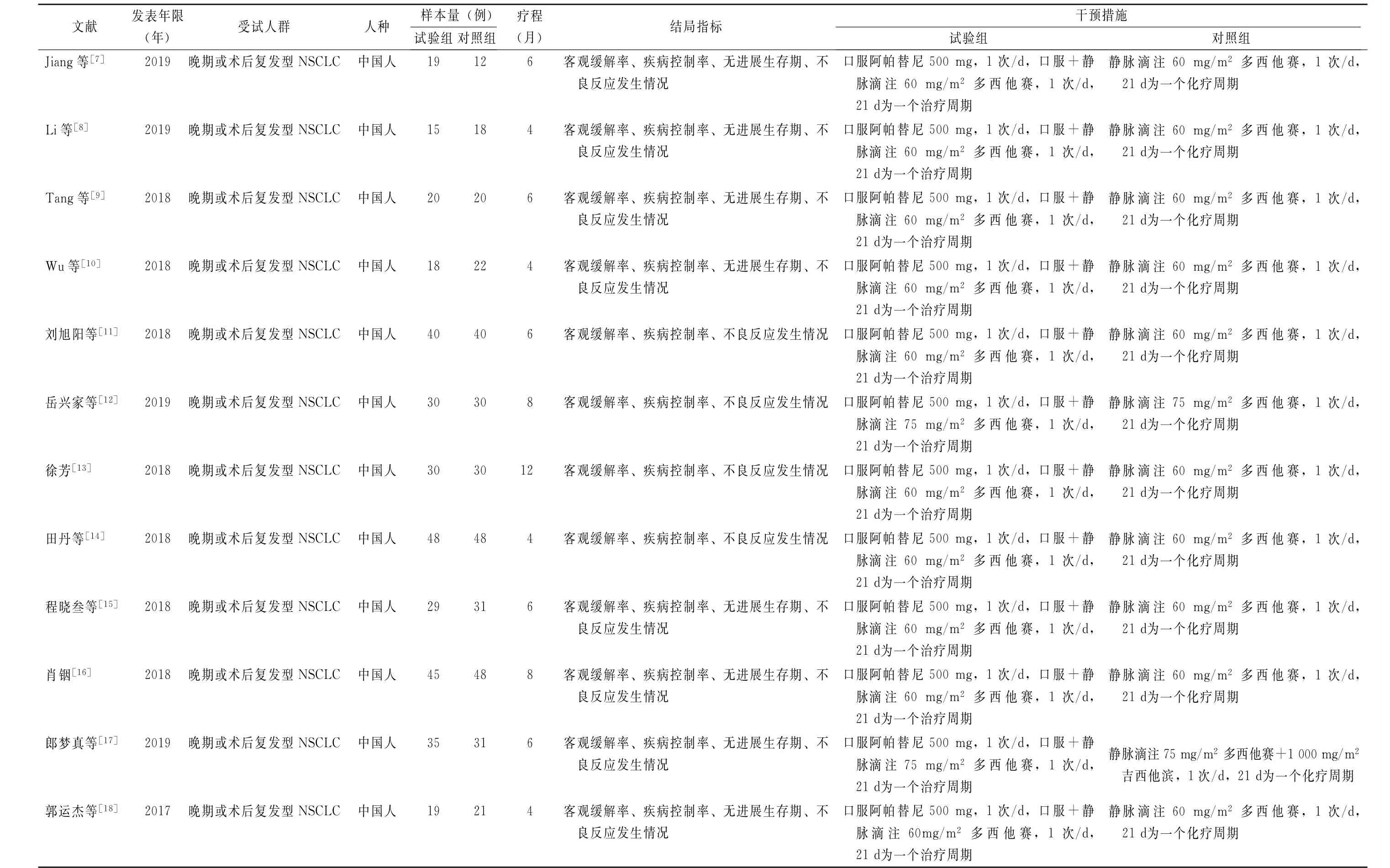
表1 纳入研究基本信息
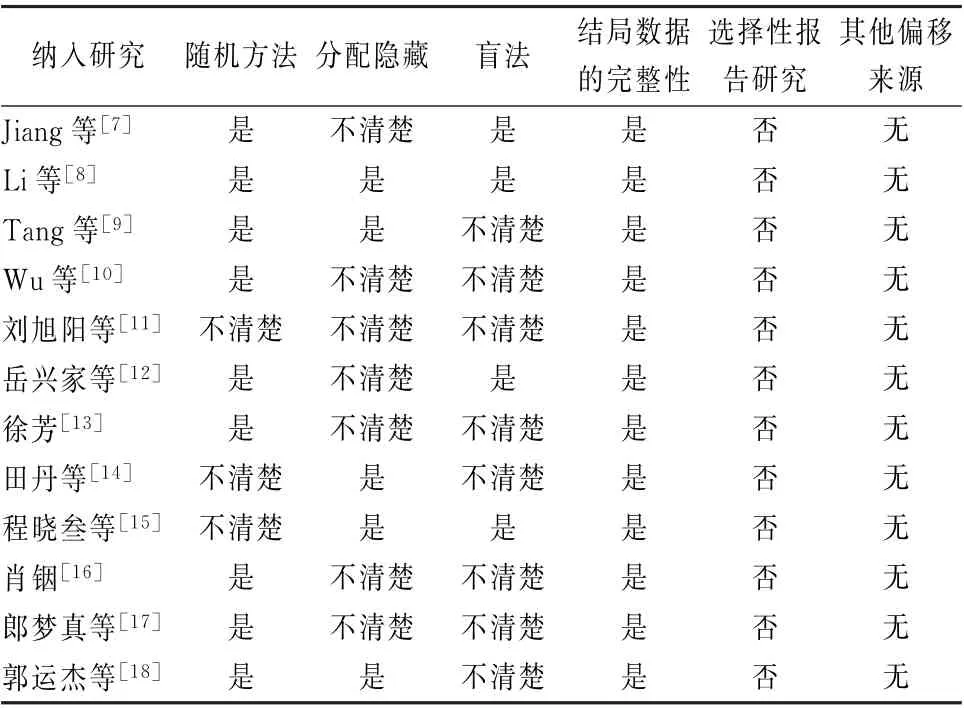
表2 纳入研究质量评价表
2.3.4.2 腹泻 共纳入9个研究[8,10,12-18],各研究间存在一定的统计学异质性 (P<0.1,I2>50%),故采用随机效应模型进行合并分析。分析结果显示:试验组患者发生腹泻的概率与对照组相似 (OR=1.14,95%CI:0.53~2.45,P=0.73)。见图6。
2.3.4.3 恶心呕吐 共纳入8个研究[8,10,12-17],各研究间具有一定的统计学异质性(P<0.1,I2>50%),采用随机效应模型进行合并分析。分析结果显示:试验组发生恶心呕吐的概率与对照组相似(OR=0.92,95%CI:0.47~1.82,P=0.81)。见图7。
2.3.4.4 高血压 共纳入8 个研究[8,12-18],各研究间具有同质性 (P>0.1,I2=0%),采用固定效应模型进行合并分析。分析结果显示:试验组发生高血压的概率与对照组相似,差异无统计学意义 (OR=0.92,95%CI:0.47~1.62,P=0.15)。见图8。
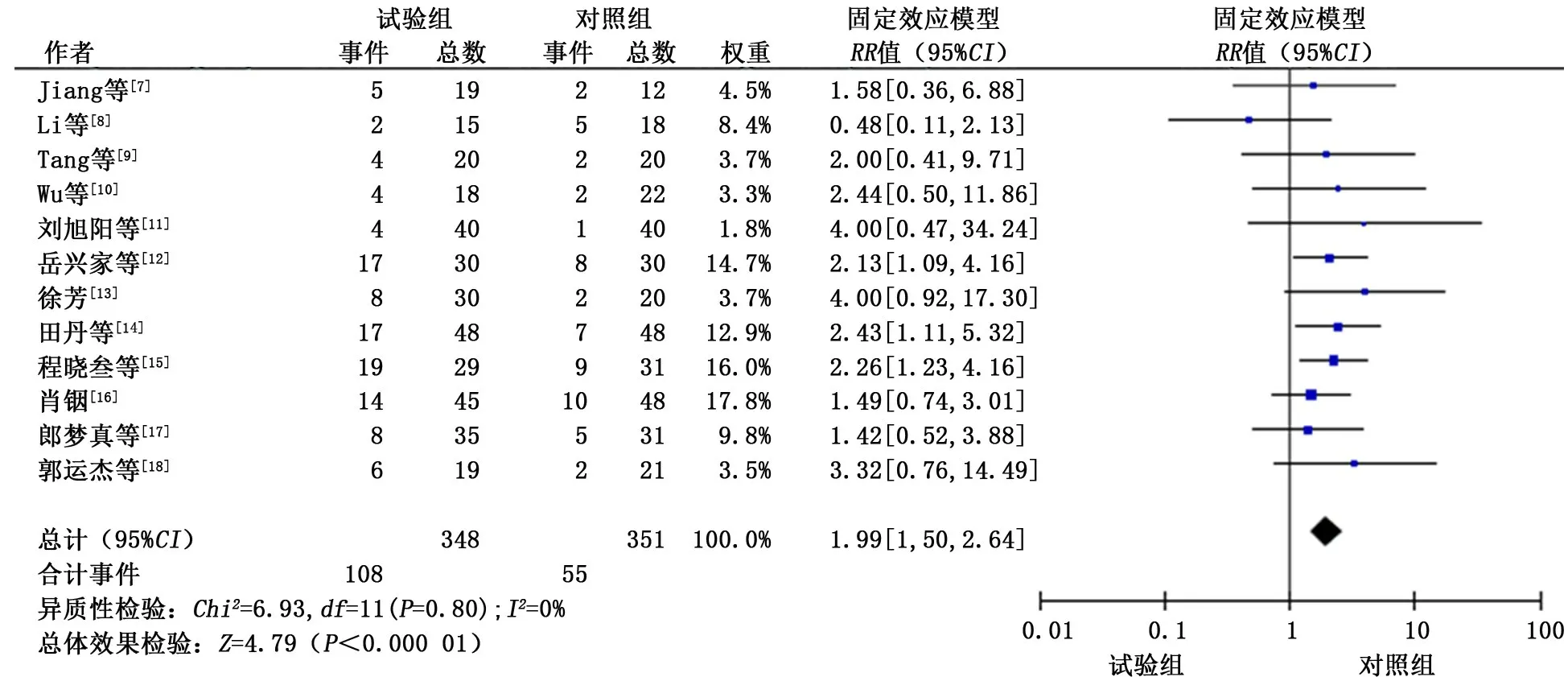
图2 试验组和对照组客观缓解率的meta分析
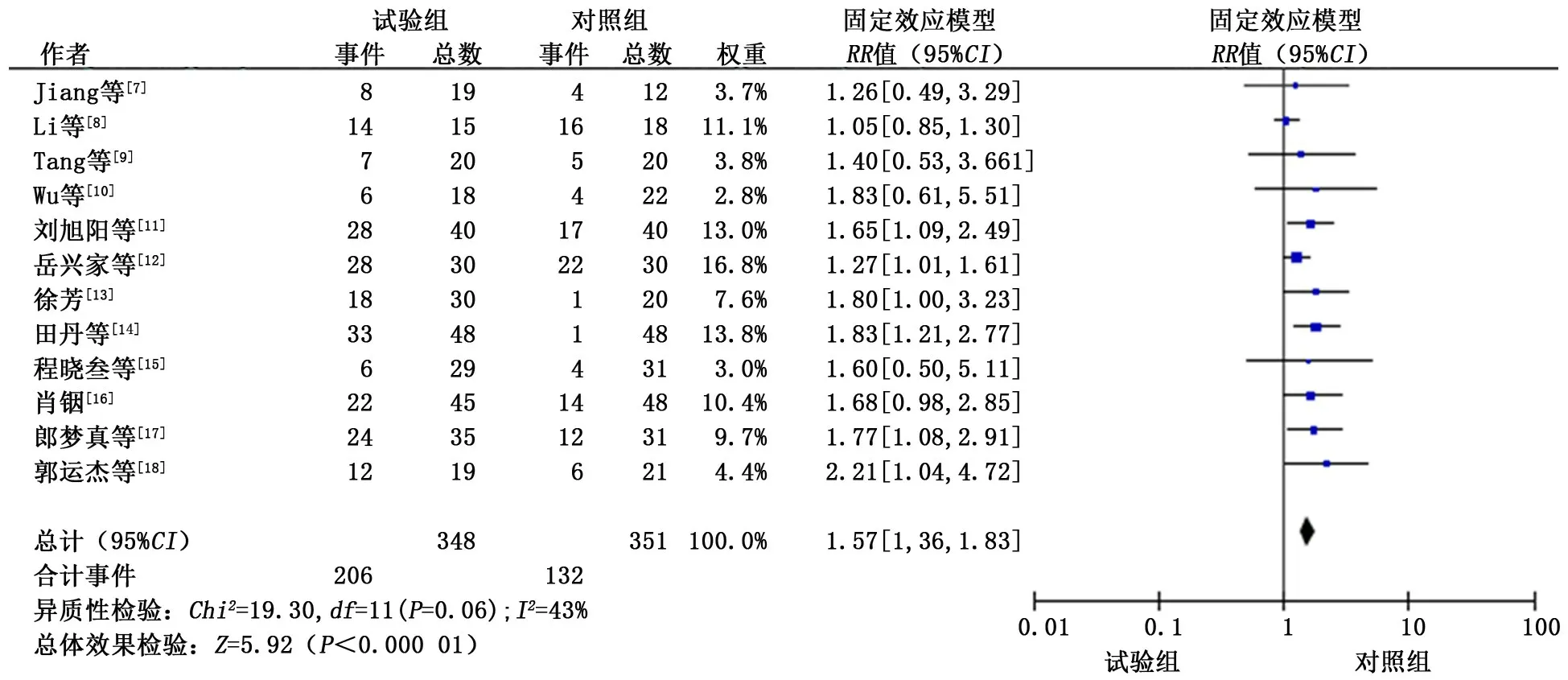
图3 试验组和对照组疾病控制率的meta分析
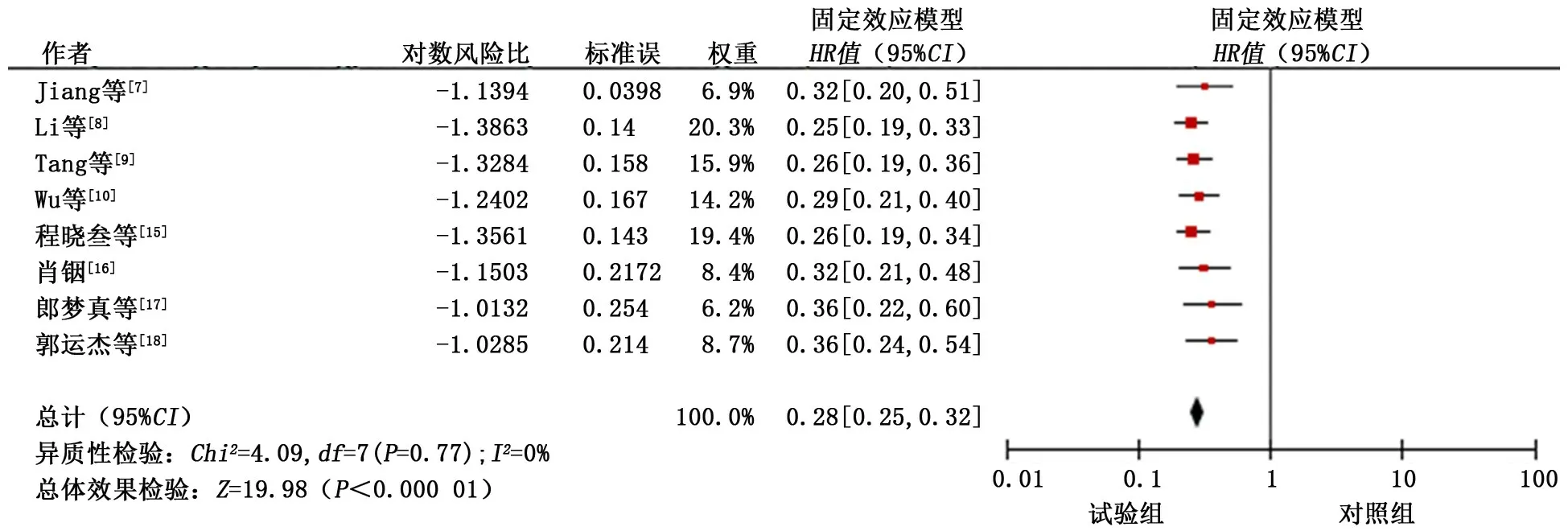
图4 试验组和对照组无进展生存期的meta分析
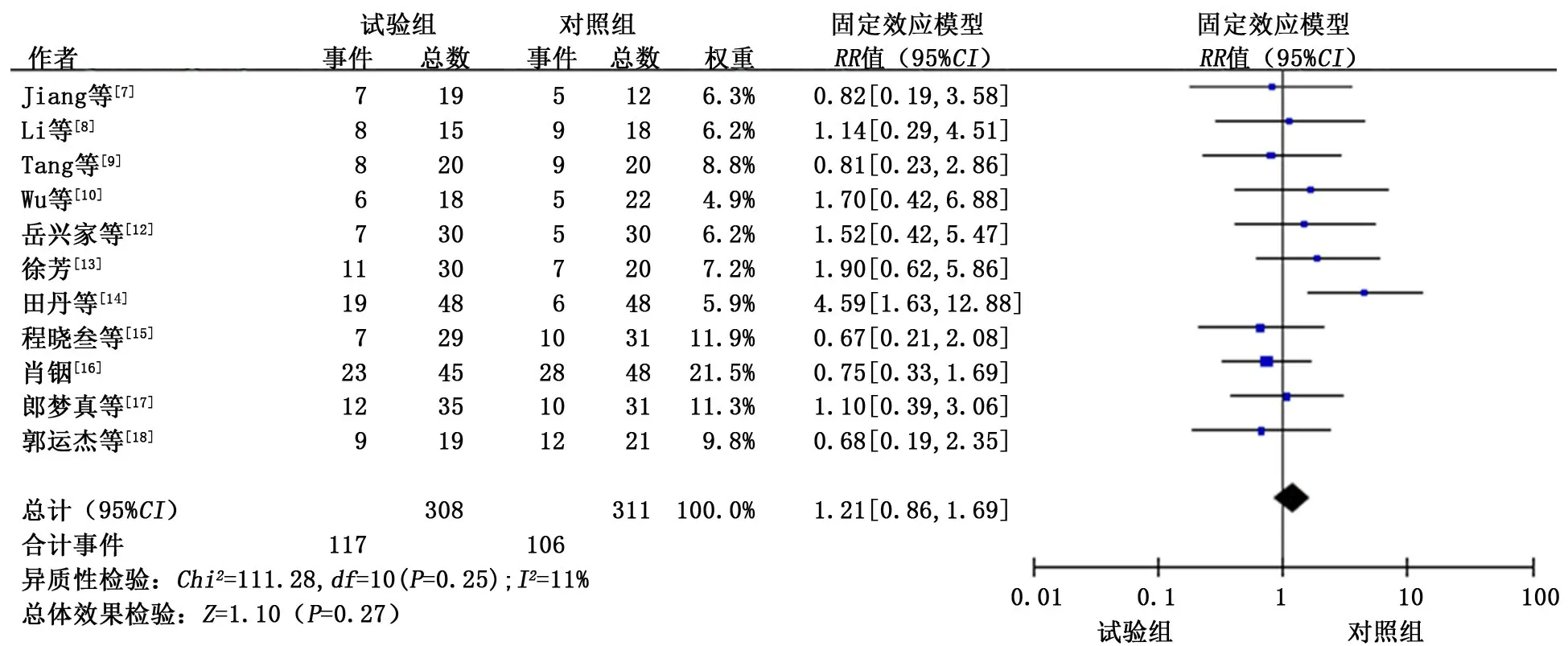
图5 试验组和对照组骨髓抑制发生情况的meta分析
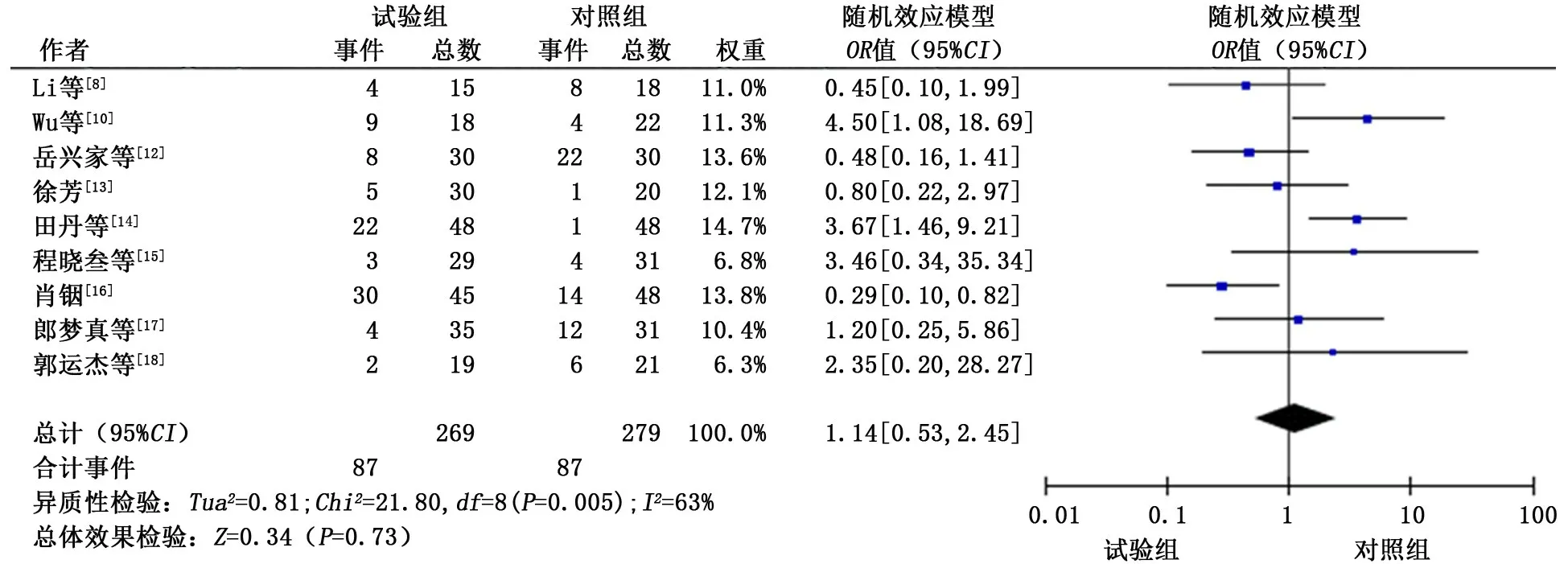
图6 试验组和对照组腹泻发生情况的meta分析
2.3.4.5 手足综合征 共纳入7 个研究[8,12-14,16-18],各研究间无明显异质性 (P>0.1,I2<50%),采用固定效应模型进行合并分析。分析结果显示:试验组患者发生手足综合征的概率与对 照 组 相 似 (OR=1.55,95%CI:0.89 ~2.72,P=0.12)。见图9。
3 讨论
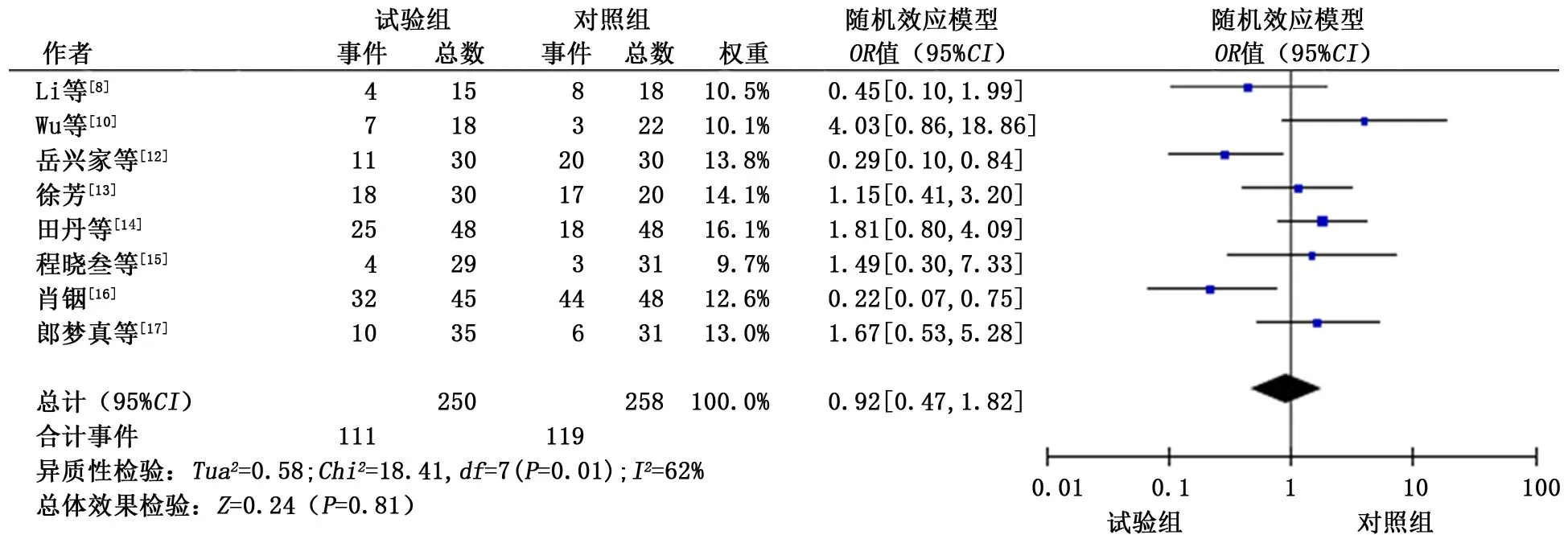
图7 试验组和对照组恶心呕吐发生情况的meta分析
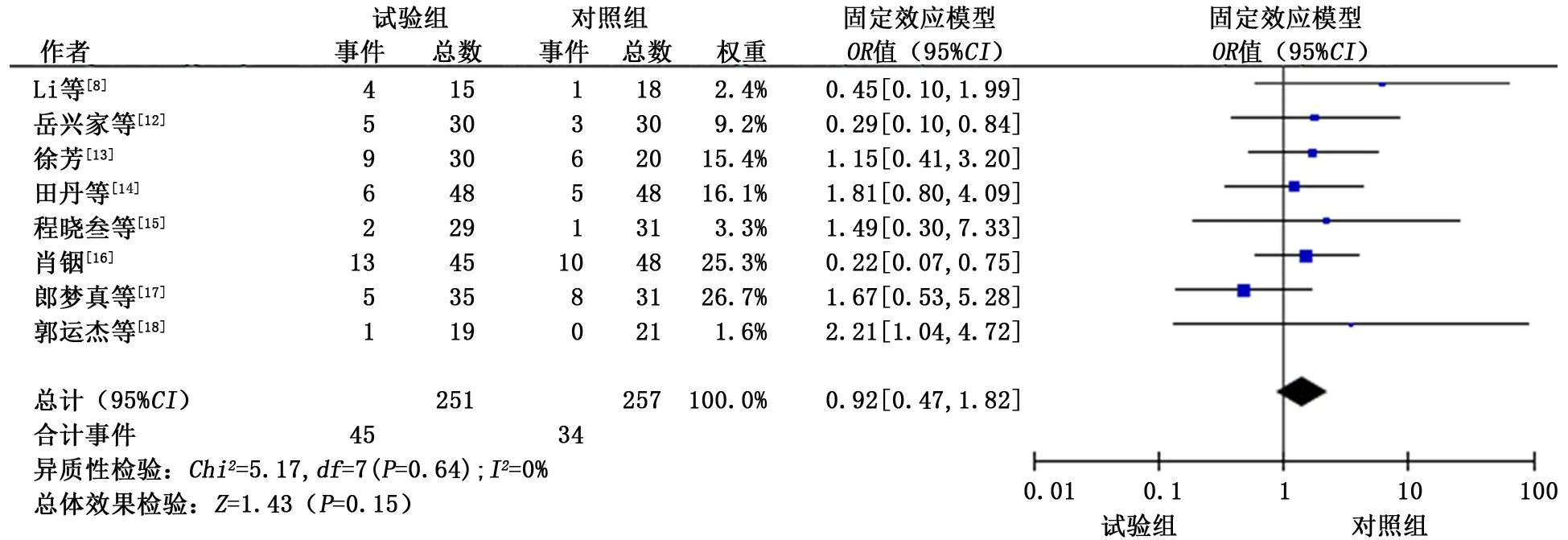
图8 试验组和对照组高血压发生情况的meta分析
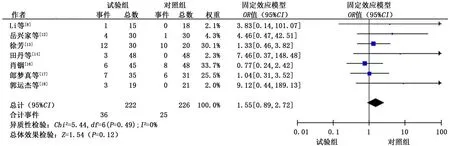
图9 试验组和对照组手足综合征发生情况的meta分析
由于肺癌患者早期无显著特异性症状,导致误诊率以及漏诊率相对较高,确诊时多为晚期[19]。目前对于无手术指征、有远处转移患者选择以铂类、紫衫类为主的联合化疗为主要治疗手段[20]。化疗治疗是晚期肺癌患者临床常用的治疗方法,也是有效的方法[21]。由于确诊晚期肺癌的患者多为老年患者,部分合并多种疾病,病情相对复杂,联合使用不良反应小的药物可加强临床治疗效果。阿帕替尼作为抗血管生成药物,其主要构成为活性蛋白,可降低由于化疗而残留在患者体内的不良反应,从而提高患者的生存质量[22]。因此,抗血管生成药物联合化疗成为晚期肺癌治疗的热点[2,18]。
有研究显示VEGF 的表达与肿瘤的复发和转移关系密切,大部分肿瘤中VEGF 处于高表达状态。由于肿瘤的生长需要血管提供营养物质、氧气以及生长因子,VEGF 尤其是VEGF-1、VEGF-2以及VEGFR 介导的信号传导通路与肿瘤血管生成密切相关。其中VFGFR-2是血管形成和通透性增强的主要介质,主要表达于内皮细胞,在细胞有丝分裂、DNA 合成等多个环节对肿瘤血管生成产生影响[18,23-24]。阿帕替尼属于血管内皮生长因子受体抑制剂,是一种新型的口服小分子抗血管生成药物,它与VEGFR-2有高度亲和性,通过竞争性抑制VEGF与VEGFR-2结合,阿帕替尼与VEGFR-2结合可抑制内皮细胞迁移和增殖,进一步降低肿瘤微血管密度,发挥抗肿瘤血管生成作用,促进细胞凋亡[25-27]。阿帕替尼目前已广泛应用于消化道恶性肿瘤中,但目前关于阿帕替尼联合多西他赛应用于肺恶性肿瘤的相关研究结果不一致。本研究采用meta分析方法评价阿帕替尼联合多西他赛治疗晚期NSCLC的临床应用价值。
通过全面且严格的文献筛选,本研究共纳入12篇研究,分析结果显示阿帕替尼联合多西他赛治疗晚期NSCLC 的客观缓解率、DCR 以及无进展生存期均优于对照组,说明阿帕替尼联合治疗晚期NSCLC组相比对照组具有更好的临床疗效。一方面由于多西他赛主要通过干扰细胞的分裂周期发挥作用,当联合发挥抗肿瘤血管生成作用的阿帕替尼,可共同促进及诱导肿瘤细胞的凋亡,使抗肿瘤作用扩大化。另一方面,由于肿瘤细胞对化疗药物的耐药情况导致抗肿瘤疗效欠佳,有研究显示阿帕替尼具有逆转耐药基因等作用,有助于降低肿瘤细胞对化疗药物的耐药程度,从而提高化疗成功率[5]。在不良反应方面,对于阿帕替尼而言,高血压反应最常见,可能由于抗血管生成药物可导致微血管网稀疏,从而促进了血管收缩物质分泌的增加,同时诱导内皮细胞释放一氧化氮减少等相关因素会导致血压升高;而对于骨髓抑制反应,包括血小板减少、白细胞降低等也是阿帕替尼的常见不良反应。若出现骨髓抑制不良反应时,可通过使用升白细胞药物进行缓解[2,14]。但是对于高血压、骨髓抑制反应、腹泻、恶心呕吐、手足综合征等不良反应,试验组与对照组发生概率相似,差异无统计学意义,说明患者总体耐受较好。此研究结果显示多西他赛联合阿帕替尼治疗与单一使用多西他赛治疗相比,具有更加显著的临床效果,且阿帕替尼联合多西他赛并没有明显增加不良反应概率。
此次研究也存在一些局限性,有以下几个方面:(1)纳入研究数量较少,仅12篇,且限定为中文及英文,存在发表偏倚可能;(2)由于纳入研究样本数量较少,纳入研究对象均为中国人,导致结果存在一定的不稳定性;(3)部分纳入研究质量较低,12项研究中仅5项研究实施了分配隐藏,4项研究采取了盲法,这些均可导致研究的选择性偏倚风险增加;(4)由于纳入研究的局限性,未能对患者工作性质、性别、吸烟及药物剂量等因素进行亚组分析。总之,研究间存在不可避免的偏倚,建议进行更大样本的临床研究以获得更为严谨、有说服力的数据。
综上所述,在治疗晚期NSCLC 效果上,阿帕替尼联合多西他赛疗效优于单一使用多西他赛,不良反应少,患者总体耐受较好。由于目前对于阿帕替尼联合多西他赛应用于晚期NSCLC 治疗研究样本量尚少,仍需设计严谨的大样本、多中心的研究加以验证。
利益冲突所有作者均声明不存在利益冲突

