ACE2通过调节A549细胞中VEGF的表达抑制肺腺癌微血管形成
张文英 季爽 李永怀 费广鹤
安徽医科大学第一附属医院呼吸与危重症医学科,合肥230022通信作者:费广鹤,guanghefei@126.com
肺癌是世界上癌症的主要死亡原因之一[1-2],其发病率和病死率居恶性肿瘤之首,而肺癌患者的死亡主要是由于癌症的转移。因此,寻找新方法抑制肺癌的转移是临床亟待解决的难题。血管形成是新生血管从现有血管“出芽”的过程,癌细胞通过肿瘤相关血管进入血液循环造成癌细胞播散。肿瘤相关血管在肺癌发生和转移中都起着重要的作用[3-4],阻断肺癌血管形成可能是肺癌治疗的有效策略。
血管紧张素转换酶2 (angiotensin-converting enzyme 2,ACE2)是肾素血管紧张素系统的新成员,为血管紧张素转换酶 (angiotensin-converting enzyme,ACE)的同系化合物。ACE 是肾素血管紧张素系统的关键酶,能将无活性的血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)转换为有活性的血管紧张素Ⅱ (angiotensinⅡ,AngⅡ),产生收缩血管作用,而ACE2的作用与ACE 相反,有舒张血管作用。既往多项研究表明ACE2 在高血压、心力衰竭、冠状动脉粥样硬化性心脏病等心血管疾病中扮演重要角色[5-7],除此之外,近年来有研究表明ACE2与恶性肿瘤的发生、发展也密切相关[8-9]。研究表明,ACE2在肺腺癌中低表达,其表达缺失可能与肺腺癌的发生、发展有关[10-11],但其相关机制尚不明确。肿瘤血管形成是一个复杂而协调的过程,依赖于细胞与细胞之间及细胞与基质之间的相互作用,并受多种血管生成促进因子和抑制因子调节。血管内皮生长因子 (vascular endothelial growth factor,VEGF)是最重要的肿瘤促血管生长因子[12-13],能作用于血管内皮细胞,促进其增殖、迁移、侵袭及管腔形成,在肿瘤血管生成过程中发挥关键作用。本文旨在探讨ACE2 如何通过VEGF调节肺腺癌体外微血管生成,为ACE2今后可能在肺腺癌的治疗中的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肺腺癌A549细胞、人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自上海复旦大学细胞库。
1.1.2 试剂 DMEM 培养基、胎牛血清购自美国Gibco公司:脂质体转染试剂Lipofectamine 3000购自美国Invitrogen 公司;过表达对照质粒(pcDNA3.1)、ACE2 过 表 达 质 粒 (pc DNAACE2)、干扰对照质粒 (sh RNA-NC)及ACE2干扰质粒 (sh RNA-ACE2)购自南京巴傲得生物科技有限公司;MTT、胰酶消化液、细胞裂解液购自上海碧云天生物技术有限公司;Transwell小室、Matrigel胶购自美国BD 公司;ACE2兔多克隆抗体购自英国的Abcam 公司;VEGF 兔多克隆抗体购自英国的Abcam 公司;β-actin兔单克隆抗体购自美国的CST 公司;HRP标记二抗购自美国Santa Cruz 公司;酶联免疫吸附测定 (enzyme linked immunosorbent assay,ELISA)试剂盒购自上海江莱生物科技有限公司。
1.1.3 仪器 超净工作台 (苏州金燕净化设备有限公司);细胞培养箱、酶标仪 (美国Thermo公司);低速离心机(德国Eppendorf公司);倒置显微镜与照像系统(德国Carl Zeiss公司);电泳仪、转膜仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养 将A549细胞或HUVECs接种于含10%胎牛血清的DMEM 培养基,37 ℃,5%CO2细胞培养箱中培养,待贴壁细胞生长至培养皿的80%~90%时,胰酶消化,DMEM 培养液重悬,按1∶3比例传代,然后取处于对数生长期的细胞进行试验。
1.2.2 细胞转染 将适量A549细胞接种于6孔板中培养,次日待细胞贴壁并生长至30%~50%时进行转染。A549细胞分4组,分别转入过表达对照质粒 (pcDNA3.1组)、ACE2 过表达质粒(pc DNA-ACE2组)、干扰对照质粒 (sh RNA-NC组)、ACE2 干 扰 质 粒 (sh RNA-ACE2 组),按Lipofectamine 3000试剂说明书进行转染操作,转染48 h后进行蛋白质印迹法验证,转染效率大于70%的细胞用于后续实验。
1.2.3 蛋白质印迹法 细胞转染48 h后,用细胞裂解液提取A549 细胞蛋白,进行SDS-PAGE 电泳,然后将蛋白从凝胶转移到PVDF膜上,用5%的脱脂牛奶室温封闭2 h,TBST 洗膜,分别加ACE2、VEGF和β-actin的一抗 (1∶1 000稀释),4 ℃孵育过夜,TBST 洗膜,添加相应二抗后,室温孵育2 h,TBST 洗膜,ECL 显影,曝光拍照,Image J软件分析蛋白条带灰度值。实验重复3次。
1.2.4 ELISA 严格按ELISA 试剂盒说明书进行操作,使用酶标仪在450 nm 测定吸光度,计算出上清液中VEGF的浓度。实验重复3次。
1.2.5 条件培养基制备 A549 细胞用pc DNAACE2或sh RNA-ACE2成功转染后,收集细胞上清液,1 611×g离心5min,取细胞上清作为条件培养基,用上述条件培养基来处理HUVECs,分为pc DNA3.1组、pcDNA-ACE2 组、sh RNA-NC组、sh RNA-ACE2 组 及sh RNA-ACE2+VEGF antibody组 (向sh RNA-ACE2组条件培养基加入0.5 mg/L的VEGF中和抗体)。
1.2.6 MTT 将HUVECs以3×103个/孔的密度接种到96孔板中,饥饿培养24 h后,换为条件培养基,分别培养24、48、72 h,然后向每孔中加入20μl无菌过滤的MTT 溶液 (5 g/L),37 ℃下孵育4 h,弃去孔中的MTT 溶液,然后每孔加入100μl二甲基亚砜,置摇床上低速摇晃10 min,使结晶充分溶解,在酶标仪490 nm 处读取吸光度值。实验重复3次。
1.2.7 细胞划痕实验 将适量HUVECs接种于6孔板中培养,待细胞长至90%密度时,使用20μl枪头在单层细胞表面划痕,PBS漂洗3次,换为条件培养基,继续培养24 h,分别在划痕后0、24 h拍照观察细胞的相对迁移距离。使用Image J软件测量细胞迁移距离,以迁移率作为统计学比较标准,迁移率= (迁移前两侧细胞距离-迁移后两侧细胞距离)/迁移前两侧细胞层距离。实验重复3次。
1.2.8 细胞侵袭实验 采用无血清DMEM 培养基悬浮HUVECs,然后以5×104个/孔的密度接种于Matrigel包被的Transwell小室上室,在小室下室加入600μl条件培养基,共培养24 h后,取出小室,用棉签小心擦去上室的细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,PBS洗涤3次,每孔随机选取5个视野观察侵袭细胞数,并拍照统计。实验重复3次。
1.2.9 小管形成实验 在96 孔板的板孔上加入50μl预冷Matrigel胶,37 ℃包被30 min,待Matrigel胶凝固后,用条件培养基悬浮HUVECs,以5×104个/孔的密度接种于相应孔中,37 ℃孵育4 h[14],对管状培养物拍照。使用Image J软件测量小管形成长度,以小管形成总长度作为统计学比较标准。实验重复3次。
1.2.10 统计学分析 采用SPSS 19.0软件进行分析,数据以x-±s表示,两组间比较使用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染后A549细胞中VEGF 表达水平 蛋白质印迹法检测结果显示,pcDNA3.1组、pc DNAACE2 组、sh RNA-NC 组 和sh RNA-ACE2 组A549细胞中ACE2 的相对表达量分别为0.36±0.03、1.53±0.03、0.35±0.03和0.22±0.04,VEGF的相对表达量分别为0.80±0.03、0.43±0.04、0.81±0.05和1.67±0.04。与pcDNA3.1组相比,pcDNA-ACE2 组A549 细 胞 中ACE2 明 显升高(t=51.20,P<0.05),VEGF 表达水平明显降低(t=13.70,P<0.5);与sh RNA-NC 组相比,shRNA-ACE2 组A549 细 胞 中ACE2 明 显降低(t=4.97,P<0.05),VEGF 表达水平明显升高(t=25.70,P<0.05)。见图1。
2.2 转染后A549 细胞上清液中VEGF 表达水平 ELISA 检 测 结 果 显 示,pcDNA3.1 组、pc DNA-ACE2组、sh RNA-NC 组和sh RNA-ACE2组A549细胞转染24 h后上清液中VEGF 表达水平分别为 (20.12±2.25)mg/L、 (14.49±0.14)mg/L、 (18.79±0.98)mg/L 和 (29.04±4.29)mg/L,转染48 h 后上清液中VEGF 表达水平分别为 (30.55±2.75)mg/L、 (14.20±2.47)mg/L、 (33.18±3.07)mg/L 和 (44.48±1.77)mg/L,转染72 h后上清液中VEGF表达水平分别为(26.54±1.64)mg/L、(16.88±0.31)mg/L、 (27.67±1.85)mg/L 和 (50.75±8.24)mg/L。转染48 h 后,A549 细胞上清液中VEGF 表达水平达峰值。与pcDNA3.1组相比,24、48、72 h pcDNA-ACE2 组A549 细胞上清液中VEGF 表达水平明显降低 (t=4.32、7.66、10.01,P值均<0.05);与sh RNA-NC 组相比,24、48、72 h shRNA-ACE2 组A549 细胞上清液中VEGF 表达水平明显升高 (t=4.04、5.52、4.73,P值均<0.05)。见图2。
2.3 转染后A549细胞上清液对HUVECs增殖能力的影响 MTT 实验结果显示,pcDNA3.1组、pc DNA-ACE2 组、sh RNA-NC 组、sh RNA-ACE2组和shRNA-ACE2+VEGF antibody组HUVECs培养24 h后吸光度值分别为0.17±0.01、0.10±0.01、0.18±0.01、0.34±0.02和0.25±0.01,培养48 h 后吸光度值分别为0.27±0.03、0.18±0.01、0.25±0.01、0.50±0.02和0.28±0.03,培养72 h后的吸光度值分别为0.28±0.03、0.20±0.03、0.31±0.02、0.47±0.02和0.29±0.02。各组HUVECs增殖能力均随时间增加而增加。与pcDNA3.1组相比,24、48、72 h pcDNA-ACE2组HUVECs增殖能力明显降低(t=8.64、6.15、3.51,P值均<0.05);与sh RNA-NC 组相比,24、48、72 h sh RNA-ACE2 组HUVECs增殖能力明显升高 (t=10.02、15.71、11.96,P值均<0.05);而24、48、72 h sh RNA-ACE2+VEGF antibody组HUVECs增殖能力较sh RNAACE2组明显降低 (t=6.00、10.65、11.82,P值均<0.05)。见图3。
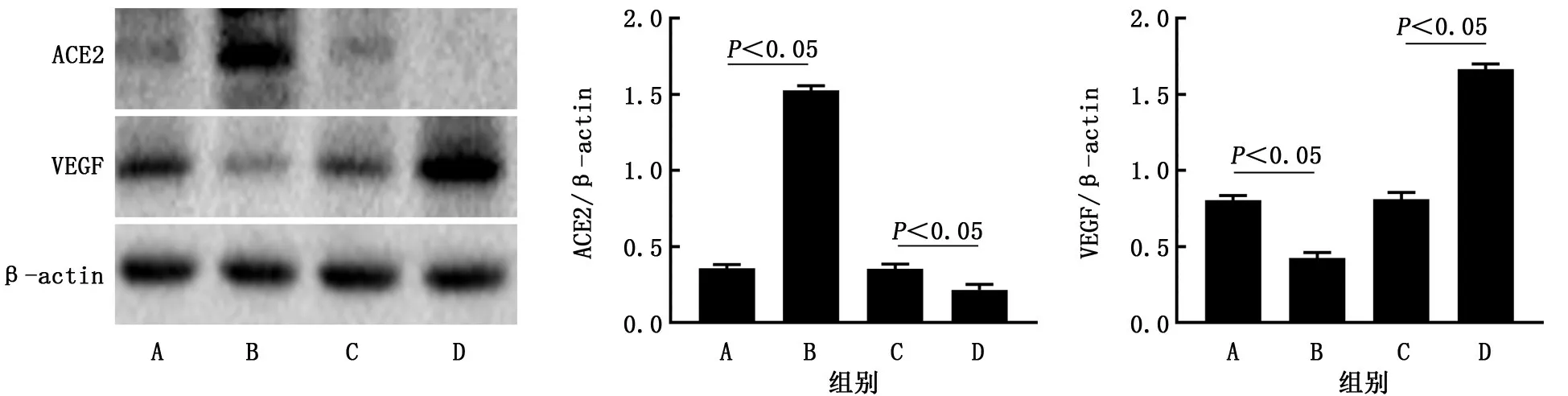
图1 蛋白质印迹法检测各组A549细胞中ACE2及VEGF相对表达量
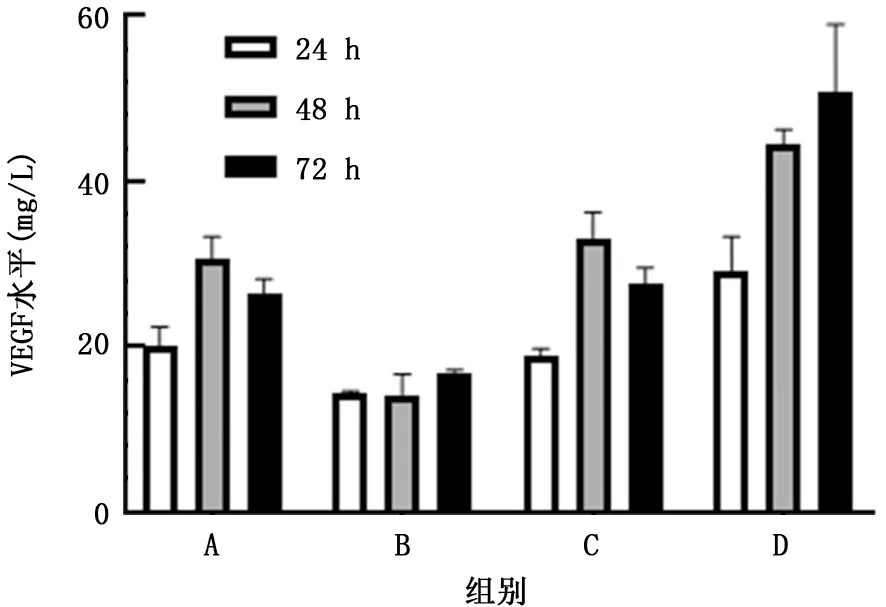
图2 酶联免疫吸附测定检测各组A549细胞上清中VEGF水平
2.4 转染后A549细胞上清液对HUVECs迁移能力的影响 细胞迁移实验结果显示,pcDNA3.1组、pc DNA-ACE2 组、sh RNA-NC 组、sh RNAACE2 组 和shRNA-ACE2+VEGF antibody 组HUVECs的细胞迁移率分别为53.21%±2.94%、31.93%±2.22%、52.50%±5.88%、82.68%±1.92%和54.76%±1.72%。与pcDNA3.1组相比,pcDNA-ACE2组HUVECs迁移率明显降低 (t=10.01,P<0.5); 与 sh RNA-NC 组 相 比,sh RNA-ACE2组HUVECs迁移率明显升高 (t=8.45,P<0.05);而sh RNA-ACE2+ VEGF antibody组HUVECs迁移率较sh RNA-ACE2 组明显降低(t=18.79,P<0.05)。见图4、5。
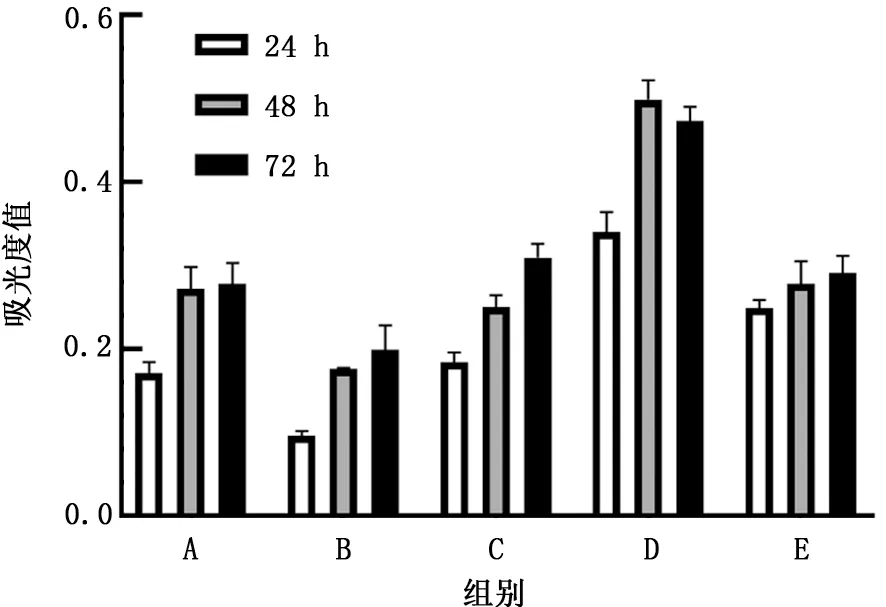
图3 MTT 检测各组人脐静脉内皮细胞增殖能力
2.5 转染后A549细胞上清液对HUVECs侵袭能力的影响 细胞侵袭实验结果显示,pcDNA3.1组、pcDNA-ACE2 组、sh RNA-NC 组、sh RNAACE2 组 和shRNA-ACE2+VEGF antibody 组HUVECs的侵袭细胞数分别为(77.13±9.00)个、(43.33±1.22)个、(78.27±8.50)个、(121.10±2.50)个和 (77.87±8.90)个。与pcDNA3.1组相比,pc DNA-ACE2组HUVECs侵袭细胞数明显降低(t=6.45,P<0.05);与sh RNA-NC 组相比,shRNA-ACE2组HUVECs侵袭细胞数明显升高(t=8.37,P<0.05);而sh RNA-ACE2+VEGF antibody 组 HUVECs 侵 袭 细 胞 数 较sh RNA-ACE2组明显降低(t=8.09,P<0.05)。见图6、7。

图4 细胞划痕实验检测各组人脐静脉内皮细胞迁移能力
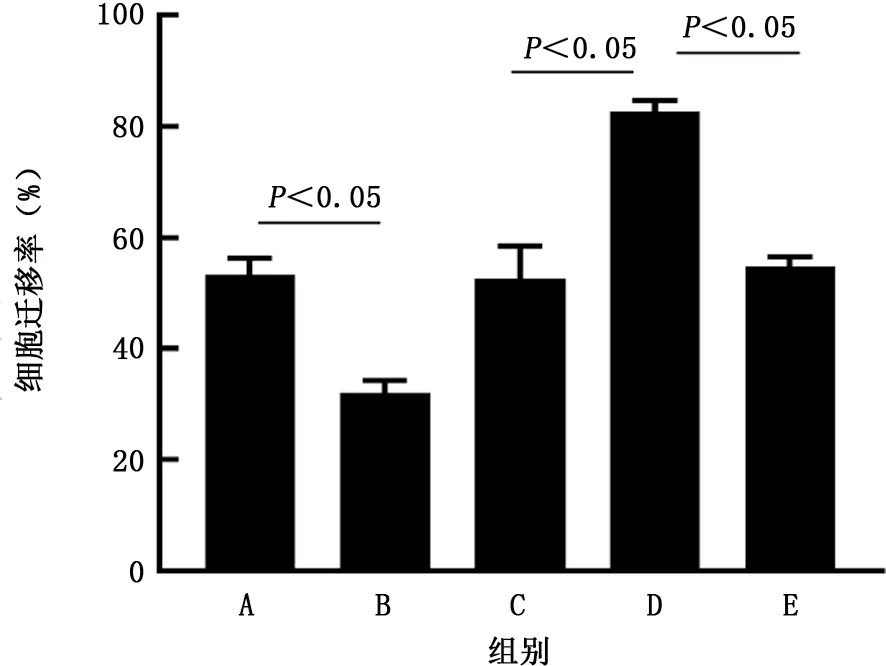
图5 各组人脐静脉内皮细胞的细胞迁移率
2.6 转染后A549细胞上清液HUVECs小管形成能力的影响 小管形成实验结果显示,pcDNA3.1组、pcDNA-ACE2 组、sh RNA-NC 组、sh RNAACE2 组 和sh RNA-ACE2+VEGF antibody 组HUVECs的小管总长度分别为(6.36±0.26)mm、(3.81±0.14)mm、(6.36±0.32)mm、(12.50±0.55)mm 和(6.35±0.39)mm。与pcDNA3.1组相比,pc DNA-ACE2组HUVECs小管形成总长度明显降低(t=14.86,P<0.05);与sh RNA-NC组相比,sh RNA-ACE2组HUVECs小管形成总长度明显升高 (t=16.78,P<0.05);而sh RNAACE2+VEGF antibody 组HUVECs 小管形成总长度较sh RNA-ACE2组明显降低(t=15.82,P<0.05)。见图8、9。

图6 细胞侵袭实验检测各组人脐静脉内皮细胞侵袭能力 A:pcDNA3.1组;B:pcDNA-ACE2组;C:shRNA-NC组;D:shRNAACE2组;E:shRNA-ACE2+VEGF antibody组
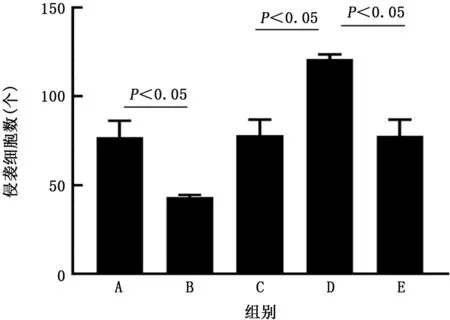
图7 各组人脐静脉内皮细胞的侵袭细胞数
3 讨论
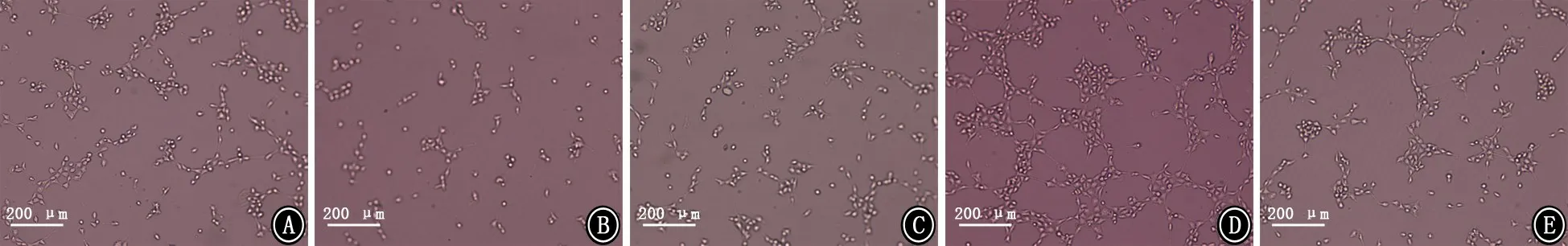
图8 小管形成实验检测人脐静脉内皮细胞小管形成能力 A:pcDNA3.1组;B:pcDNA-ACE2组;C:shRNA-NC组;D:shRNAACE2组;E:shRNA-ACE2+VEGF antibody组
ACE2是一种膜联羧肽酶,是ACE 同工酶,但生物学作用却与ACE 相反[5-7]。ACE 的主要生理作用是将AngⅠ转换为AngⅡ,产生收缩血管作用;ACE2 的主要生理作用是水解AngⅠ、AngⅡ,产生舒血管作用的Ang (1-7)、Ang(1-9),起到降血压,保护心血管的作用。随着血管紧张素转化酶抑制剂以及血管紧张素受体拮抗剂在心血管疾病方面的应用,肾素血管紧张素系统与肿瘤的关系日益被人们所关注。近年来许多研究表明,ACE2在多种恶性肿瘤如乳腺癌、胆囊癌、肺癌中异常表达,ACE2的表达缺失可能与肿瘤的发生、发展有关,ACE2 可能是一种潜在的抑癌因子。Zhang 等[8]研 究 表 明,ACE2 通 过 抑 制VEGFa/VEGFR2/ERK 信号通路抑制乳腺癌血管形成。Zong等[9]研究表明,ACE2通过抑制ERK蛋白磷酸化抑制胆囊癌的生长。Feng等[10]还发现ACE2的表达水平与非小细胞肺癌的TNM 分期有关,低表达ACE2 的患者临床分期晚,预后差。目前仍需进一步实验来验证ACE2在肺腺癌发生、发展中的作用。
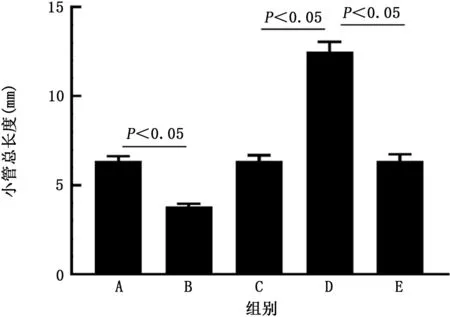
图9 各组人脐静脉内皮细胞的小管总长度
恶性肿瘤的生长依赖于血管生成,VEGF是最重要的促血管生长因子,为探究中ACE2 对肺腺癌A549细胞VEGF 表达水平的影响,本实验用ACE2 过表达及干扰质粒转染A549 细胞后,对A549细胞中VEGF表达水平进行检测。研究结果显示,过表达或干扰A549细胞中ACE2表达后,VEGF的表达随之降低或升高,这表明ACE2 抑制A549细胞中VEGF表达,提示ACE2可能是肺腺癌血管形成的负性调控因子。
肺癌是最常见的恶性肿瘤之一,其发病率和病死率在恶性肿瘤中均居世界首位。肺癌的增殖、浸润、转移都需要新生血管的支持,抗血管生成治疗已成为一种肺癌重要治疗手段。血管生成指源于已存在的毛细血管和毛细血管后微静脉的新的毛细血管性血管的生长。肿瘤血管生成是一个动态复杂的生物学过程,由肿瘤细胞分泌测促血管生成因子作用于血管内皮细胞,激活静息状态的内皮细胞,降解基底膜和细胞外基质,使内皮细胞增殖,迁移至肿瘤附近,最终形成毛细血管网包绕或侵入肿瘤[15]。为研究ACE2在肺腺癌体外微血管形成中的作用,笔者用转染后A549细胞的条件上清液来培养HUVECs,然后分别检测HUVECs的增殖、迁移、侵袭和小管形成能力。实验结果表明,ACE2过表达的A549 细胞条件上清液能抑制HUVECs的增殖、迁移、侵袭和小管形成能力;ACE2 敲低的A549 细胞条件上清液能促进HUVECs的增殖、迁移、侵袭和小管形成能力,而这种促进作用能被VEGF 中和抗体所抵消。由此推断,ACE2 能够通过下调VEGF 的表达抑制HUVECs的增殖、迁移、侵袭和小管形成能力,抑制肺腺癌体外微血管形成,ACE2可能是潜在的肺腺癌抑制因子。
迄今为止,ACE2激动剂已经在许多临床疾病中应用,但其中肺腺癌中的作用尚不明确。本实验结果表明,ACE2 可以通过下调A549 细胞中VEGF表达,抑制HUVECs的增殖、迁移、侵袭和小管形成能力,从而抑制肺腺癌体外微血管形成,为ACE2在肺腺癌治疗中的应用提供了理论依据。
利益冲突所有作者均声明不存在利益冲突

