miRNA-21对肺癌细胞增殖和侵袭能力的影响及作用机制的研究
李海泉 赵杰 贾晓民 张衍民 杜永亮 黄建安
1徐州医科大学第二附属医院呼吸与危重症医学科221006;2苏州大学第一附属医院呼吸与危重症医学科215005
微小RNA (micro RNA,miRNA)是近几年来分子生物学和肿瘤学领域的研究热点。miRNA是一类新发现的长度为18~24个核昔酸的内源性非编码单链小分子RNA[1],在转录后水平调节基因表达具有高度的物种保守性[2]。迄今为止已发现了数百种miRNA,广泛存在于各种生物体中,参与细胞的增值、凋亡、分化、代谢炎症以及个体发育和病毒感染等过程[3-4]。
虽然miR-21在肿瘤中具有广谱性,但是越来越多的文献表明其更与肺部肿瘤有着明显的相关性,和肺癌细胞的凋亡、转移和侵袭有着很重要的联系[5]。所以本研究将进一步揭示调控miR-21表达对肺癌细胞A549生长、转移和凋亡的影响,初步探讨其肿瘤抑制作用的机制。前期研究表明大多数肺癌患者中的miR-21相对正常组织偏高,说明miR-21在肺癌中高表达。本实验研究miR-21对人肺癌细胞株的增殖、侵袭、转移能力是否有影响,并对相应的机制进行探究。
1 材料与方法
1.1 材料与试剂 RPMI 1640培养液、H-DMEM培养基购于美国GIBCO 公司、胎牛血清购于美国Hyclone公司。A549人肺癌细胞株购于武汉博士德生物科技有限公司,逆转录试剂盒购于日本Ta KaRa公司,动物总RNA 快速提取试剂盒购于上海Generay 公司,Micro RNA hsa-miR-21-5p mimic 由上海吉玛公司设计合成。Annexin VFITC/PI细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品,Transwell小室购于美国Corning公司。PCR 仪为德国Eppendorf公司产品,流式细胞仪为美国Becton Dickinson 公司产品。
1.2 方法
1.2.1 细胞培养 A549人肺癌细胞株由武汉博士德生物科技有限公司提供。细胞复苏后,用含10%FBS 与双抗 (100 U/ml青霉素、100 ng/L链霉素)的DMEM 培养基培养,每隔24 h 更换1次溶液。细胞密度在90%以上时,胰蛋白酶消化进行细胞传代。
1.2.2 细胞转染 取对数生长期的细胞,接种于24孔板中,每孔的细胞量为5.0×105个并培养24 h,显微镜下观察细胞达约70%~90%,将miRNA 用灭菌无核酶水稀释至相应浓度,并分装好,于-80℃保存。按每孔250μl(5μl lipo 2000+245μl Opti-MEM 低血清培养基)稀释转染试剂lipo2000,室温孵育5 min;按照每孔250μl(5μl miRNA+245μl Opti-MEM 低血清培养基)稀释miRNA,将稀释后的lipo2000 与miRNA 混匀,室温孵育20 min,形成miRNA-lipo2000混合物。转染之前,弃旧培养基,以4 ℃预冷的PBS 洗3遍,按每孔1.5 ml加入Opti-MEM 低血清培养基,使得miRNA-lipo2000混合物和Opti-MEM 低血清培养基总体积为2 ml。按分组 (空白组、miR-21高表达质粒空载对照组、miR-21 高表达组、miR-21敲减质粒空载对照组、miR-21敲减组)将miRNA-lipo2000混合液加入到相应孔内,转染完成后将细胞放置于37 ℃的CO2培养箱培养。
1.2.3 荧光定量qRT-PCR 检测 离心收集细胞(离心半径3 cm,1 000 r/min离心8 min),按照Trizol试剂盒说明书提取细胞的总RNA。将提取的总RNA 按照逆转录试剂盒说明书将m RNA 逆转录成cDNA,按照qPCR 试剂产品说明书进行定量PCR。反应体系20μl:2×qPCR Master Mix 10μl,正反向引物(10μmol/L)各0.2μl,ROXI染 料0.4 μl,RT 反 应 液 (cDNA)2 μl,补 充dd H2O 至20 μl。反 应 条 件:扩 增 程 序:95 ℃5 min 1个循环;95 ℃5 s,60 ℃31 s 40个循环。熔解程序:95 ℃15 s,60℃30 s,95℃15 s。之后采用Rotor-Gene Real-Time Analysis Software 6.1分析软件及ΔΔCT 法定量分析扩增曲线及溶解曲线。按上述方法分别检测miR-21 转染效率及PTEN、RECK、Caspase3 m RNA 水平。
1.2.4 CCK-8法检测细胞增殖能力 收集细胞,调节细胞密度至5 000个/100μl。分别取3块96孔板,加入细胞悬液,每孔100μl。放入细胞培养箱,37℃,5%CO2培养过夜。第3、4、5天分别取出96孔板,弃上清,每孔加入100μl含0.5%FBS的新鲜培养基,再每孔加入10 μl CCK8,37 ℃孵育4 h。将96孔板放入酶标仪,540 nm 进行读数。
1.2.5 蛋白质印迹法 (Western blot) 将细胞加入裂解液含1μmol/L 的PMSF)重悬细胞后,4 ℃裂解30 min,取上清BCA 法测定测定蛋白浓度。SDS-PAGE电泳后蛋白转至PVDF 膜。浸入含5%脱脂奶粉室温封闭2 h,在4 ℃下加入一抗过夜,并用二抗在37 ℃下孵育1 h。用TBST 洗膜3次,化学光敏模式曝光显影。用Image J软件对目的条带的灰度值进行半定量分析。
1.2.6 细胞侵袭与迁移 用50 mg/L Matrigel 1∶4稀释液,取50μl包被Transwell小室底部膜的上室面,37 ℃放置4 h,使Matrigel聚合成凝胶。取细胞悬液200 μl (5×105/ml)加入Transwell小室,下室加入600μl含10% FBS 培养基培养48 h。取出Transwell小室,PBS清洗,甲醇固定,0.1%结晶紫染色20 min,用棉签擦除上层细胞。400倍显微镜下随机选择5个视野,观察细胞,计数。评估细胞侵袭能力。取细胞悬液200μl(5×105/ml)加入Transwell小室,下室加入600μl含10% FBS培养基,培养箱培养48 h。对小室下室侧细胞进行固定染色。400倍显微镜下随机5个视野观察细胞,计数。评估细胞迁移能力。
1.2.7 流式细胞仪检测细胞凋亡及细胞周期 收集细胞,取105个重悬的细胞离心 (离心半径3 cm,1 000 r/min 离心8 min)后,加入100μl反应液(FITC 10μl、碘化丙啶5μl、1×Binding Buffer 85μl)重悬置室温避光孵育15 min。加入400μl Binding Buffer结合液轻轻混匀。最后进行流式细胞仪检测,用Cell Quest等软件进行分析凋亡情况。同样方法收集细胞,加入1 ml冰浴预冷70%乙醇中,置4 ℃过夜。离心(离心半径3 cm,1 000 r/min离心8 min),弃上清,PBS洗涤。加入500μl PI染色工作液,重悬置于37℃避光水浴。用流式细胞仪检测,软件分析细胞周期相关数据。
1.3 统计学分析 采用SPSS 17.0统计学软件分析数据。通过两独立样本t检验进行样本的两两比较,并通过单因素方差分析进行多组样本比较。P<0.05为差异有统计学意义。
2 结果
2.1 荧光定量qRT-PCR 验证miR-21转染A549人肺癌细胞 miR-21高表达组miR-21的含量显著高于空白组和miR-21高表达质粒空载对照组(t=48.56、45.25,P值均<0.01),而miR-21敲减组miR-21的含量较空白组和miR-21敲减质粒空载对照组表现出较低的趋势 (t=24.09、24.92,P值均<0.01),见图1。
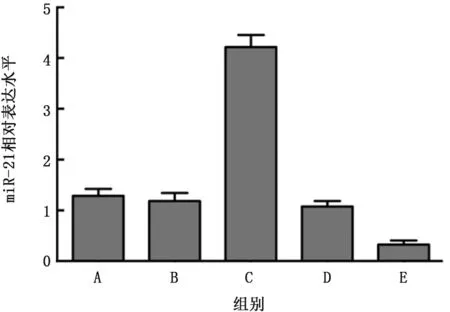
图1 荧光定量qRT-PCR 验证miR-21转染A549人肺癌细胞
2.2 miR-21高表达促进A549细胞增殖 miR-21转染48 h及72 h,miR-21高表达组吸光度值均高于其他组,差异均有统计学意义 (F=43.061、74.862,P值均<0.01),见图2。
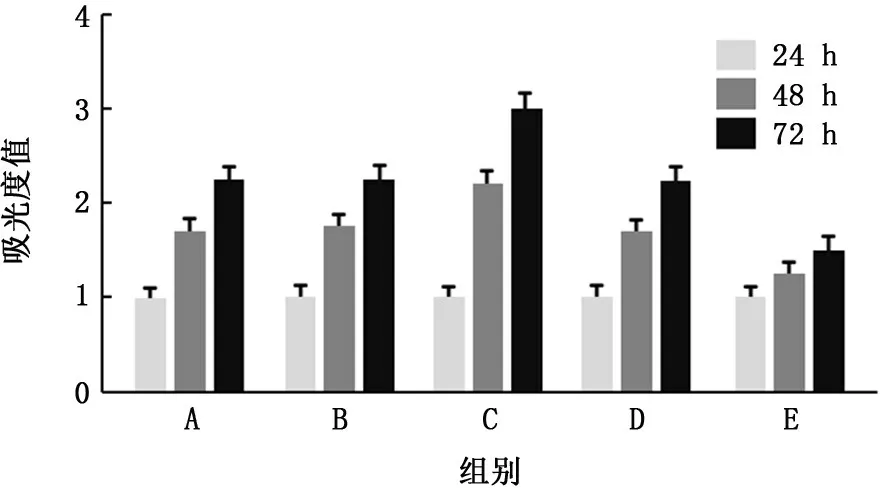
图2 miR-21促进A549细胞增殖
2.3 Western blot检测A549 细胞中蛋白表达水平 miR-21 高表达组磷酸化AKT、Caspase 3、MMP-9和MMP-2蛋白水平较空白组及miR-21高表达质粒空载对照组均明显上升 (P值均<0.05),3 组AKT 蛋白水平未见明显变化。miR-21 高 表 达 组 PTEN、Cleaved-Caspase 3、RECK 蛋白水平较空白组及miR-21高表达质粒空载对照组均明显下降 (P值均<0.05)。反之,miR-21敲减组磷酸化AKT、Caspase 3、MMP-9和MMP-2蛋白水平较空白组及miR-21敲减质粒空载对照组均明显下降 (P值均<0.05),3 组AKT 蛋白水平未见明显变化。miR-21 敲减组PTEN、Cleaved-Caspase 3、RECK 蛋白水平较空白组及miR-21敲减质粒空载对照组均明显上升(P值均<0.05)。见图3。
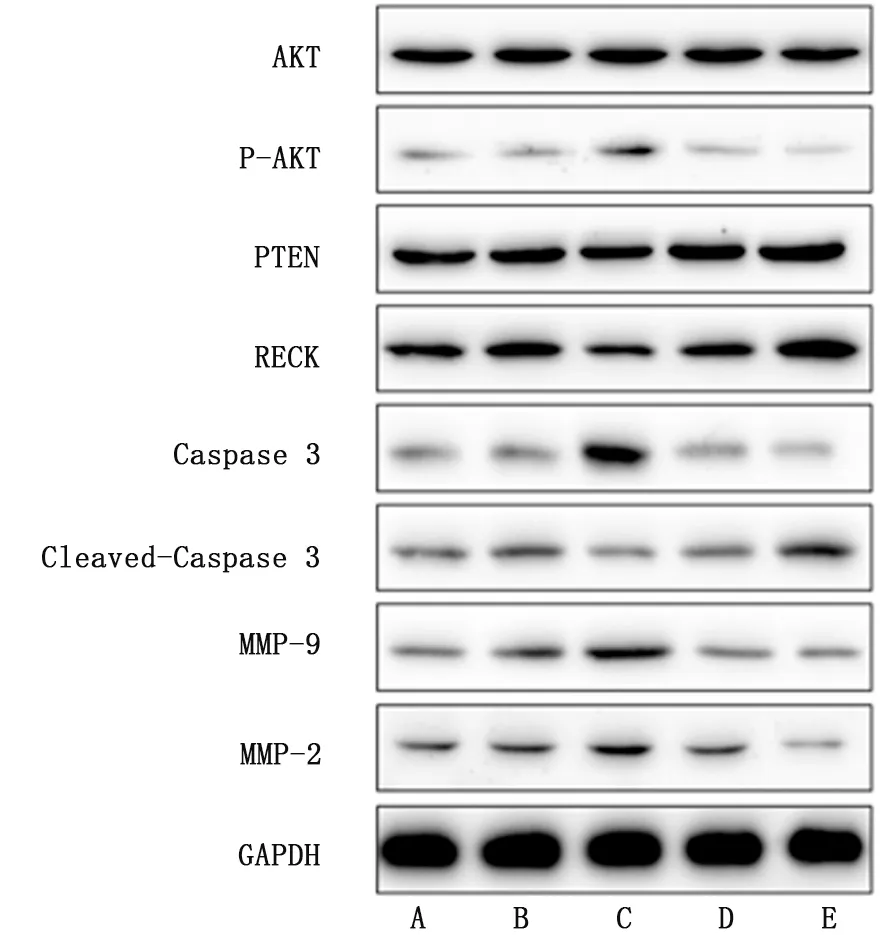
图3 蛋白质印迹法检测经miR-21转染后A549细胞中蛋白表达水平
2.4 荧光定量qRT-PCR 检测miR-21 肺癌细胞m RNA 水平 miR-21高表达组PTEN、RECK 的m RNA 水平均较空白组及miR-21高表达质粒空载对照组低 (t=15.53、14.82,P值均<0.01),而miR-21高表达组Caspase 3的mRNA 水平较空白组及miR-21 高表达质粒空载对照组高 (t=35.36,P<0.01)。miR-21敲减组PTEN、RECK的m RNA 水平均较空白组及miR-21 敲减质粒空载对照组高 (t=43.52、42.45,P值均<0.01),而miR-21敲减组Caspase 3的m RNA 水平较空白组及miR-21 高表达质粒空载对照组低 (t=24.37,P<0.01)。
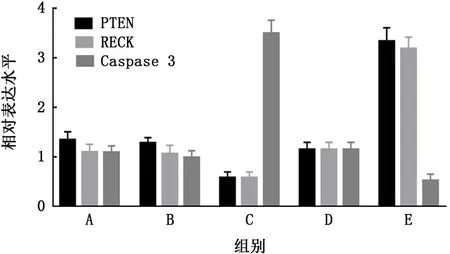
图4 荧光定量qRT-PCR 检测miR-21转染A549人肺癌细胞后的mRNA 水平
2.5 miR-21对癌细胞的侵袭及迁移能力的影响 miR-21高表达组侵袭及迁移能力均较空白组及miR-21高表达质粒空载对照组强;反之,miR-21敲减组侵袭及迁移能力较空白组及miR-21敲减质粒空载对照组弱(P值均<0.05,图5、6)。
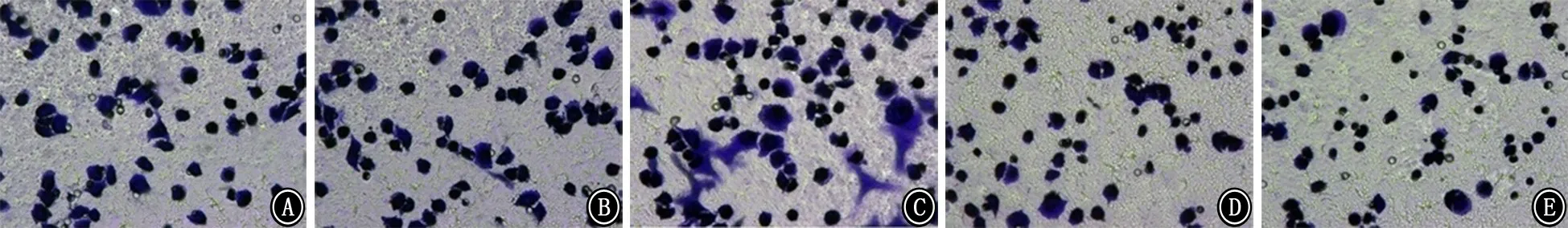
图5 miR-21高表达增加A549人肺癌细胞的侵袭能力 结晶紫染色 ×400 A:空白组;B:miR-21高表达质粒空载对照组;C:miR-21高表达组;D:miR-21敲减质粒空载对照组;E:miR-21敲减组

图6 miR-21高表达增加A549人肺癌细胞的迁移能力 结晶紫染色 ×400 A:空白组;B:miR-21高表达质粒空载对照组;C:miR-21高表达组;D:miR-21敲减质粒空载对照组;E:miR-21敲减组
2.6 miR-21转染后的A549细胞凋亡及细胞周期检测 空白组、miR-21 高表达质粒空载对照组、miR-21高表达组、miR-21 敲减质粒空载对照组、miR-21 敲减组的细胞凋亡比例分别为2.706%、3.133%、1.257%、2.929%、7.267%。经由细胞阻滞实验,以上各组的G1 期百分比分别为48.06%、47.50%、47.41%、55.47%、68.37%,G2 期百分比分别为5.54%、6.03%、2.74%、9.31%、8.77%,S 期百分比分别为46.40%、46.47%、49.86%、35.22%、22.86%。见图7。
3 讨论
随着人们对miRNAs研究的不断深入,近年来有大量的实验研究数据表明miRNA 与人类多种肿瘤的发生、发展存在着密切相关性,miRNA 异常表达在多种肿瘤的发生、发展中发挥了重要作用,其中一些miRNA 可能成为肿瘤治疗的新靶点和预后的标志物,它们通过抑制靶基因m RNA 翻译或诱导靶mRNA 降解在转录后水平调控基因表达,具有癌基因或抑癌基因的功能,参与肿瘤的发生、发展、耐药及侵袭转移。
目前人们在对肿瘤的研究过程中发现,miR-21在多种肿瘤细胞的表达出现显著异常,参与调控多种抑癌基因的表达。人们在应用荧光定量qRT-PCR 和基因芯片等多种技术发现,miR-21在多种肿瘤中,如白血病、神经胶质瘤、前列腺癌、膀肤癌、胰腺癌、胃癌、结肠癌及甲状腺癌等组织和细胞中发现miR-21均有上调表达,并且临床资料显示miR-21的高表达与临床预后不良有关[6-10]。
为了探究miR-21在肺癌中的生物学作用,本研究构建了空白组、miR-21高表达质粒空载对照组、miR-21高表达组、miR-21敲减质粒空载对照组、miR-21敲减组,随后采用荧光定量q RT-PCR和Western blot检测细胞内m RNA 和蛋白含量;通过CCK-8法、Transwell实验、流式细胞仪检测对不同细胞体外生长增殖能力、侵袭迁移能力、细胞周期及凋亡等进行研究。结果显示:miR-21高表达组的A549人肺癌细胞增殖能力更强,miR-21敲减组吸光度值在各组中最低,推测miR-21敲减抑制A549人肺癌细胞增殖。
miR-21高表达组与miR-21高表达质粒空载对照组比较,其m RNA 和蛋白表达含量显著增加,细胞增殖、迁移和侵袭能力明显增强,细胞中AKT 蛋白水平未见明显变化,而磷酸化AKT 水平明显上升,PTEN 蛋白水平出现下降趋势,Caspase 3 蛋白水平显著上升,与之对应的Cleaved-Caspase 3 蛋白水平明显下降;RECK 蛋白水平显著下降,MMP-9和MMP-2 蛋白水平均呈现显著上升的趋势。这提示miR-21高表达促进A549 细 胞 增 殖 (miR-21 敲 减 抑 制A549 细 胞 增殖)可能由AKT/P-AKT/PTEN/Caspase3/Cleaved-Caspase通路及RECK/MMP-2、MMP-9通路参与的。这与本研究中Western blot检测的结果基本一致,也辅证miR-21 高表达促进A549 细胞增殖(miR-21敲减抑制A549 细胞增殖)可能确实与PTEN/Caspase 3通路及RECK 通路有关。
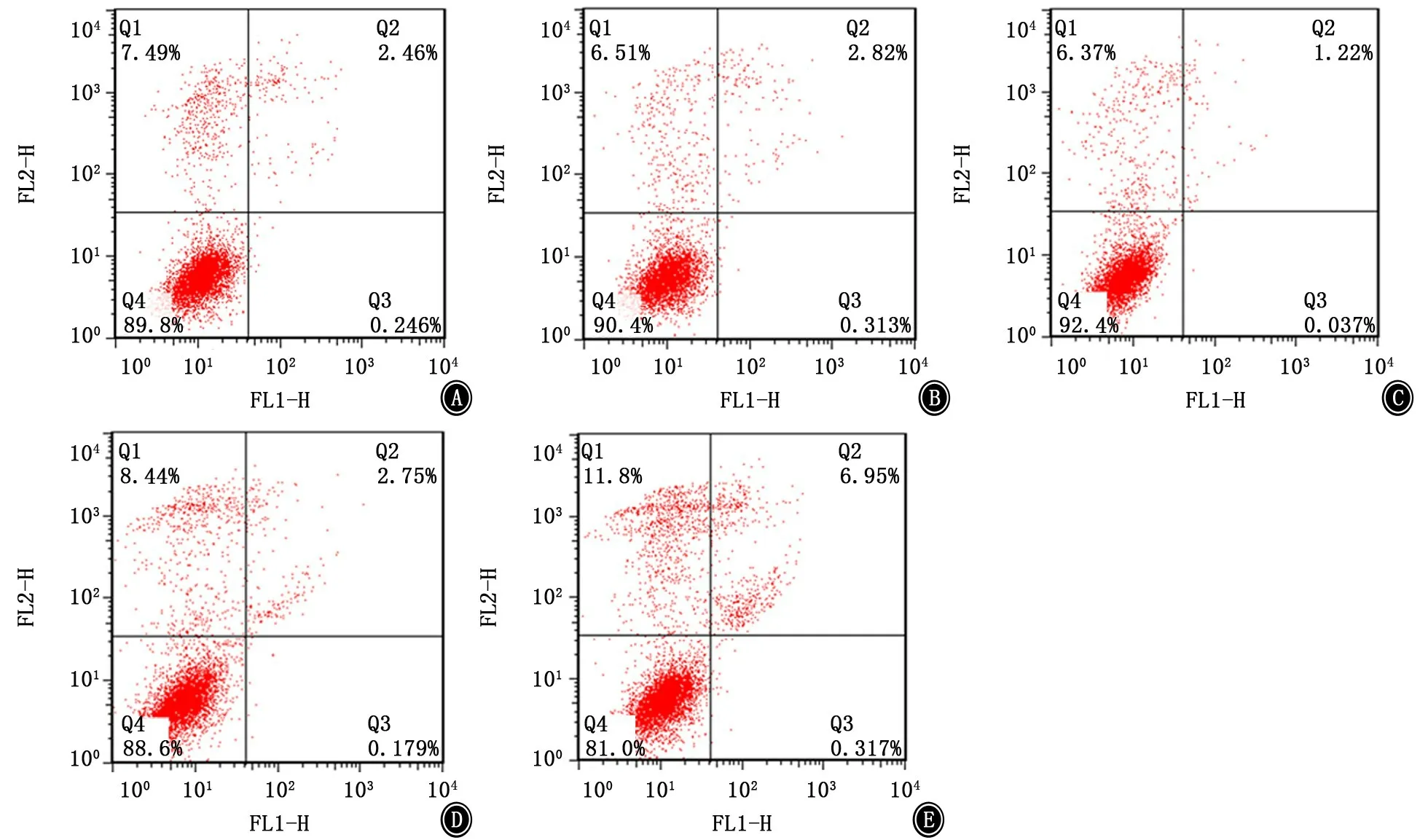
图7 miR-21转染后的A549细胞凋亡检测 A:空白组;B:miR-21高表达质粒空载对照组;C:miR-21高表达组;D:miR-21敲减质粒空载对照组;E:miR-21敲减组
miR-21高表达组中G2细胞减少,S期细胞增多,能够促进人肺癌细胞周期进行,利于增殖,而且抑制细胞凋亡的作用;而miR-21敲减能够增加G1、G2期细胞,减少S 期细胞,使细胞阻滞在G1期,抑制细胞增殖。本研究证实miR-21 在肺癌的发生、发展、侵袭和转移中起到原癌基因的作用,促进肺癌细胞增殖并抑制肺癌细胞凋亡,并且miRNA-21对人肺癌细胞株的增殖、侵袭、转移能力的影响是由AKT/P-AKT/Cleaved-Caspsae3/MMP-2/MMP-9细胞信号通路引起的,为肺癌诊治及判断预后提供了一定的实验基础。
利益冲突所有作者均声明不存在利益冲突

