银杏内酯对急性肾损伤大鼠的保护作用及机制研究
尤旭 朱小芳 胡运鹏 龚杨 赵磊
434000 荆州,湖北省荆州市中心医院院前急救科
急性肾损伤(acute kidney injury,AKI)可由不同病因及病理机制引起,以肾功能迅速下降、肾衰竭为主要临床特征,可导致多脏器、多系统受累而危及生命[1-2]。然而,目前对于AKI的治疗仍缺乏特异性药物[1]。银杏内酯是从银杏叶中分离提取的萜内脂类化合物,为银杏叶提取物的主要活性物质[3]。近年来,大量研究证明银杏叶提取物对糖尿病肾病、肾小管上皮细胞凋亡、肾急性缺血再灌注损伤等有保护作用[4-5],但银杏内酯对AKI是否有保护作用未见报道。研究发现腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)广泛表达于肾脏细胞中,可增强沉默信息调节因子1(silent information regulator 1,SIRT1)去乙酰化活性,抑制炎症相关基因的表达,减轻组织炎症损伤[6-8],而SIRT1在肾小管上皮细胞中高度表达,对不同机制诱导的AKI有保护作用[9-10]。本研究通过经皮下注射庆大霉素建立AKI大鼠模型,探究银杏内酯对AKI大鼠的保护作用及对AMPK/SIRT1通路的影响,以期为临床合理用药提供参考。
材料和方法
一、实验材料
1.动物 清洁级同遗传背景SD大鼠50只,体重200~220 g,由广东省医学实验动物中心提供,生产许可证号为SCXK(粤)2018-0002,动物质量合格证号为省科委2000A027。所有大鼠于本院动物房中饲养,饲养条件:自然光照,自由饮食、饮水,温度25 ℃,相对湿度50%,噪音低于80分贝,保持动物房环境及鼠笼清洁、透气。
2.主要试剂及仪器 银杏内酯注射液(成都百裕制药,批号:2019090601);庆大霉素注射液(广州阿达拉生物科技有限公司,批号:2017090601);HE染色试剂盒(上海生物公司,货号E677218-0200);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)试剂盒(北京索莱宝生物有限公司,批号:20190301,2019050603)、IL-6和TNF-α、Scr和BUN、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤因子1(KIM-1)等ELISA试剂盒(北京索莱宝生物有限公司,批号:2018122201、2019082303、2019092503、2019063003、2019052503、2019022303);凝胶电泳迁移率转变分析(electrophoretic mobility shift assay,EMSA)试剂盒(美国pierce公司,货号:AP2032);抗体pAMPK、AMPK、SIRT1(美国Perkin Elmer公司,货号:AP3013、AP2055、AP4016);核因子κB(nuclear factor-κB,NF-κB)结合位点的寡核苷酸(DNA序列:3′-TCAACTCCCCTGAAAGGGTCGG-5′,5′-AGT TGAGGGGACTTTCCCAGGC-3′)购自上海生工生物技术有限公司(货号:2018032402);蛋白提取试剂盒、BCA试剂盒(上海碧云天公司,货号P0027)等。手动轮转式切片机(德国Leica公司,型号RM2125RTS);光学显微镜(日本尼康公司,型号SMZ745);酶标仪(美国Perkin Elmer公司,型号XElx800);蛋白电泳仪、半干转膜仪(美国Bio-Rad公司,型号1659001、Trans-Blot SD);凝胶成像仪(Miulab公司,型号:GIS-500)等。
二、方法
1.大鼠AKI模型建立及分组给药 参照文献[11]构建AKI模型,具体操作方法为:经皮下注射庆大霉素,80 mg/kg,每天一次,连续6 d即可造模成功。将造模成功的40只大鼠分为AKI组和银杏内酯低(2.5 mg/kg)、中(5.0 mg/kg)、高(7.5 mg/kg)剂量组,每组10只,另取10只大鼠,皮下注射等剂量生理盐水6 d作为正常对照组(Control组)。造模结束后2 h开始给药,银杏内酯以生理盐水配置为0.25 mg/mL、0.50 mg/mL、0.75 mg/mL混悬液,药物处理组大鼠均以10 mL/kg的剂量经腹腔注射给药,Control组与AKI组经腹腔注射等剂量生理盐水,各组连续给药14 d,1次/d。
2.肾功能检测及标本采集 末次给药1 h后,收集各组大鼠尿液,并将大鼠用3%戊巴比妥钠麻醉后处死,经腹主动脉取血5 mL,将尿液和血液分别在3 000 r/min,离心半径10 cm条件下离心10 min后,取上清液,一部分上清液按ELISA试剂盒检测方法,分别检测肾功能指标Scr、BUN及尿中NGAL、KIM-1含量,具体操作按说明书进行;另一部分上清液于-20 ℃冰箱保存备用。分别摘取大鼠左右两肾,经磷酸缓冲盐冲洗后,迅速置于-80 ℃冰箱中保存备用。
3.肾组织HE染色病理学检测 取-80 ℃保存的左肾,于4 ℃冰箱中解冻后,进行常规透明、浸蜡、包埋后、切成厚度为5 μm的切片。将切片进行二甲苯脱蜡,梯度酒精水化后,用苏木精-伊红染色5 min,1%盐酸酒精分化10 s,蒸馏水漂洗2 min,梯度酒精脱水2 min,二甲苯透明处理,中性光学树脂封片后,置于显微镜下观察肾组织形态变化。
4.检测大鼠肾脏组织SOD、MDA含量 取-80 ℃保存的右肾组织,于4 ℃冰箱中解冻后,剪碎,制备组织匀浆液,按试剂方法检测肾脏组织SOD、MDA含量,具体操作按说明书进行。
5.检测大鼠肾脏组织IL-6、TNF-α含量 取-80 ℃保存的右肾组织,于4 ℃冰箱中解冻后,剪碎,制备组织匀浆液,以ELISA试剂盒检测IL-6、TNF-α含量,具体操作按说明书进行。
6.EMSA检测大鼠肾脏组织NF-κB活性 取-80 ℃保存的右肾组织,于4 ℃冰箱中解冻后,严格按核蛋白抽提试剂盒说明书方法提取肾组织核蛋白;制备生物素标记探针,用5′端生物素标记带有NF-κB结合位点的寡核苷酸并将其作为探针,将核蛋白与探针在室温下孵育20 min,然后以6.5%聚丙烯酰胺凝胶进行电泳。用凝胶图像分析系统分析其吸光度值。
7.Western blot法检测肾组织AMPK/pAMPK、SIRT1蛋白的表达 取-80 ℃保存的右肾组织,于4 ℃冰箱中解冻后,用蛋白裂解液裂解离心后提取蛋白,用BCA试剂盒检测蛋白总浓度,取50 μg蛋白上样,进行电泳和转膜反应,TBST溶液清洗后,加入5%脱脂牛奶室温下封闭1 h,TBST溶液清洗3次后,加入一抗AMPK、pAMPK、SIRT1、β-actin(内参)抗体,稀释倍数分别为1∶1 000,1∶2 000,1∶1 000,1∶2 000,4 ℃摇床室温孵育过夜,TBST振洗后加入HRP羊抗兔二抗(稀释倍数1∶2 000),37 ℃摇床室温孵育1 h,TBST清洗3次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。
三、统计学分析

结 果
一、各组大鼠肾组织病理损伤程度观察
Control组大鼠肾组织结构未见明显损伤。与Control组比较,AKI组大鼠可见肾小管上皮细胞脱落,空泡样变性,肾小管管腔扩张等病理损伤。与AKI组大鼠比较,银杏内酯低、中、高剂量组大鼠肾小管上皮细胞脱落现象、变性及增生等病理损伤程度明显减轻。与银杏内酯低剂量组比较,银杏内酯中、高剂量组肾小管上皮细胞脱落及变性等病理损伤进一步减轻。(图1)
二、各组大鼠肾功能指标比较
与Control组相比,AKI组大鼠Scr和BUN、尿液中NGAL和KIM-1含量明显升高(P<0.05);与AKI组相比,银杏内酯低、中、高剂量组Scr和BUN、尿液中NGAL和KIM-1含量明显降低(P<0.05);与银杏内酯低剂量组相比,银杏内酯中、高剂量组Scr和BUN、尿液中NGAL和KIM-1含量明显降低(P<0.05)。(表1)
三、各组大鼠肾组织炎性因子IL-6、TNF-α含量比较
与Control组相比,AKI组大鼠肾组织IL-6、TNF-α含量明显升高(P<0.05);与AKI组相比,银杏内酯低、中、高剂量组大鼠IL-6、TNF-α含量明显降低(P<0.05);与银杏内酯低剂量组相比,银杏内酯中、高剂量组IL-6、TNF-α含量明显降低(P<0.05)。(表2)
四、各组大鼠肾组织MDA、SOD含量比较
与Control组相比,AKI组大鼠肾组织MDA含量明显升高(P<0.05),SOD活性明显降低(P<0.05);与AKI组相比,银杏内酯低、中、高剂量组大鼠肾组织MDA含量明显降低(P<0.05),SOD活性明显升高(P<0.05);与银杏内酯低剂量组相比,银杏内酯中、高剂量组肾组织MDA含量明显降低(P<0.05),SOD活性明显升高(P<0.05)。(表3)

图1 各组大鼠肾组织病理损伤图(HE染色,400×) A.Control组;B.AKI组;C.银杏内酯低剂量组;D.银杏内酯中剂量组;E.银杏内酯高剂量组
五、各组大鼠肾组织pAMPK/AMPK、SIRT1蛋白表达及NF-κB活性的比较
与Control组相比,AKI组大鼠p-AMPK/AMPK、SIRTl蛋白表达明显降低(P<0.05),NF-κB活性明显升高(P<0.05)。与AKI组相比,银杏内酯低、中、高剂量组大鼠肾组织p-AMPK/AMPK、SIRTl蛋白表达明显升高(P<0.05),NF-κB活性明显降低(P<0.05);与银杏内酯低剂量组相比,银杏内酯中、高剂量组大鼠肾组织p-AMPK/AMPK、SIRTl蛋白表达明显升高(P<0.05),NF-κB活性明显降低(P<0.05)。(图2、图3、图4)

表1 各组大鼠血清Scr和BUN、尿液中NGAL和KIM-1含量比较

表2 各组大鼠肾组织IL-6、TNF-α含量比较(pg/mL)
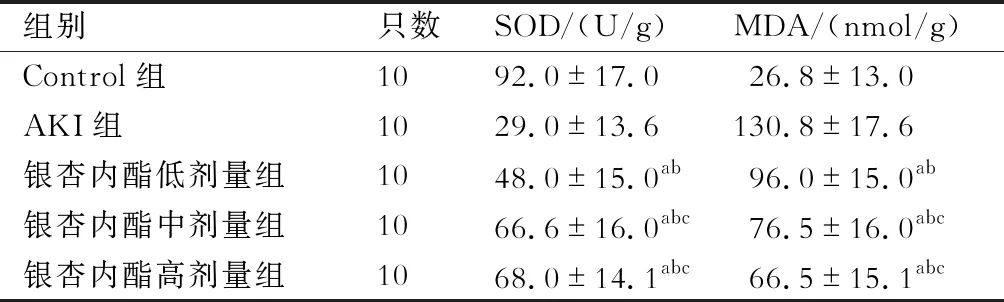
表3 各组大鼠肾组织MDA、SOD含量比较
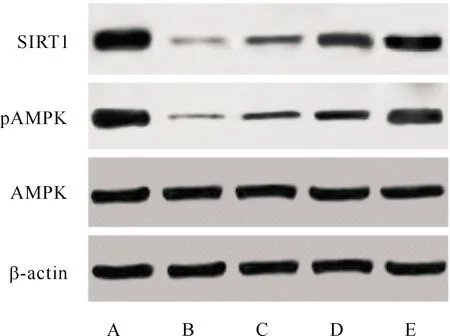
注:A为Control组;B为AKI组;C为银杏内酯低剂量组;D为银杏内酯中剂量组;E为银杏内酯高剂量组。图2 各组大鼠肾组织pAMPK/AMPK、SIRT1蛋白免疫印迹图

图3 EMSA法检测各组大鼠肾组织NF-κB活性 A.Control组;B.AKI组;C.银杏内酯低剂量组;D.银杏内酯中剂量组;E.银杏内酯高剂量组

注:与Control组比较,aP<0.05;与AKI组比较,bP<0.05;与银杏内酯低剂量组比较,cP<0.05。图4 各组大鼠肾组织pAMPK/AMPK、SIRT1蛋白表达及NF-κB活性比较
讨 论
AKI病因多样,病死率高,发病机制不明确,是临床常见的严重病症之一[12]。临床上评价AKI常用指标为Scr和BUN,另外尿中NGAL和KIM-1为评价AKI早期指标[13]。给大鼠皮下注射庆大霉素会损害肾脏,是复制AKI损伤模型的一种经典方法[11]。多个研究发现,银杏叶提取物对肾脏具有保护作用,成月英等[4]发现银杏复方汤剂对兔肾缺血灌注再损伤有保护作用;李瑞杰等[5]发现银杏叶提取物对糖尿病肾损伤大鼠有保护作用;冯等[14]发现银杏内酯注射液对出血性脑梗死具有较好的治疗效果,故本研究推测,作为银杏提取物主要成分的银杏内酯对AKI也可能具有一定的保护作用。建立模型进行研究,发现AKI组大鼠Scr、BUN及尿NGAL、KIM-1含量比Control组升高,且HE染色显示AKI组大鼠肾小管上皮细胞崩解脱落、空泡变性等病理损伤,提示AKI造模成功。给予银杏内酯治疗后发现,相比于AKI组,银杏内酯高、中、低剂量组大鼠肾组织病理损伤减轻,Scr、BUN、NGAL、KIM-1含量下降,且银杏内酯中、高剂量组优于低剂量组,表明银杏内酯可缓解肾小管上皮细胞损伤,改善肾功能,对AKI有保护作用。
大量研究表明脂质过氧化和炎性介质释放是庆大霉素引起肾毒性的重要原因[15-17]。谷名晓等[17]发现上调SOD水平,下调MDA水平,可降低氧化应激,缓解庆大霉素所致的AKI。宋小红等[18]发现阿托伐他汀可通过降低氧化应激反应、降低炎症反应标志物IL-6、TNF-α含量等,可改善庆大霉素所致AKI症状。成月英等[4]发现银杏复方汤剂可减轻氧化应激及炎性反应,缓解缺血再灌注导致的肾损伤。本研究发现,与Control组比较,AKI组大鼠肾组织中MDA、IL-6、TNF-α含量增加,SOD活性降低,提示AKI组大鼠肾组织内存在氧化应激和炎性损伤;与AKI组相比,银杏内酯低、中、高剂量组大鼠肾组织中MDA、IL-6、TNF-α含量明显降低,且银杏内酯中、高剂量组优于低剂量组,表明银杏内酯可通过上调AKI模型大鼠肾组织中SOD活性、下调MDA含量降低氧化应激损伤,降低炎性因子释放缓解炎性损伤,从而达到改善庆大霉素所致的AKI。
AMPK可上调SIRT1去乙酰化酶水平,抑制NF-κB核移位活化,影响下游氧化应激及炎症因子表达情况,从而调节肾脏细胞炎性损伤和氧化应激水平,影响肾功能[6-8]。SIRT1被激活后,具有抗氧化、抗炎等作用,对多种原因诱导的AKI有保护作用[10-19]。Zhang等[20]发现,银杏黄酮苷元可通过上调AKI小鼠肾组织中SIRT1表达,抑制NF-κB活性,减少炎症因子释放,从而减轻AKI肾组织中炎症反应。翁思颖等[21]发现益气活血汤可通过上调AMPK/SIRT1通路表达,降低氧化应激反应,缓解高糖所导致肾损伤。Zhao等[22]发现,给予SIRT1激动剂可减轻缺血-再灌注所致AKI大鼠肾组织中炎性因子释放及氧化应激损伤。本研究发现,AKI组大鼠肾组织中p-AMPK/AMPK、SIRTl蛋白表达降低,NF-κB活性增高;给予银杏内酯低、中、高剂量治疗后,与AKI组比较,各药物处理组大鼠肾组织p-AMPK/AMPK、SIRTl蛋白表达升高,NF-κB活性降低,且中、高剂量组p-AMPK/AMPK、SIRTl蛋白表达高于低剂量组,NF-κB活性低于低剂量组,表明银杏内酯可能通过激活AMPK/SIRT1通路,抑制NF-κB活化,降低AKI大鼠肾组织氧化应激和炎性反应。
综上所述,银杏内酯可能通过激活AMPK/SIRT1通路,降低肾组织中氧化应激和炎性反应,改善AKI大鼠病理损伤,可能为临床治疗AKI提供一定参考。但本研究也存在一定不足,并未在研究中设计通路抑制剂进行验证,有待后续深入研究。

