新型三苯胺-卟啉锌复合物与DNA的结合模式及单线态氧能力研究
汪泽江,刘丹,姜军,王凯,
(1.武汉工程大学化工与制药学院,湖北 武汉 430074;2.湖北大学化学化工学院,湖北 武汉 430026)
0 引言
卟啉及其衍生物广泛存在于自然界中,并在生命活动中扮演着重要的角色[1-3].现代研究表明,卟啉在生物医药、材料、催化以及光化领域都有着重要的地位[4].卟啉作为一种重要的光敏剂,是光动力治疗中的重要环节.光动力疗法(photodynamic therapy, PDT)包括3个不可或缺的部分:光敏剂、光、氧气,主要是通过光敏剂吸收能量后的光敏反应产生高毒性的活性氧(reactive oxygen species,ROS),特别是单线态氧(1O2)来破坏肿瘤细胞和诱导癌细胞凋亡[5-7].随着对卟啉作为光敏剂治疗肿瘤的深入研究,卟啉类光敏剂与DNA的相互作用研究也尤为重要[8-9].随着对生命的研究日益加深,科学家们发现,以脱氧核糖核酸为单元组成的DNA是一种长链聚合物[10].它所携带的遗传信息是生命体的重要基石,控制的蛋白质的合成[11].多种疾病与DNA有关,因此研究DNA的结合位点,筛选新型药物放入作用靶点,在基因水平上进行疾病的诊断和治疗,对防病抗病的健康研究十分重要.大部分卟啉化合物能可逆的与DNA结合,并且卟啉的主要是以DNA-卟啉复合物的方式进行的,所以研究卟啉与DNA的相互作用在生物活性研究方面有重大意义[12].目前主要运用光谱学原理研究卟啉化合物与DNA的相互作用模式[13].
卟啉的近红外区吸收较弱,这导致卟啉的光热效应较小及组织穿透深度较低,导致对深部癌细胞的疗效降低[14].共轭体系的增加有助于提升卟啉化合物的红外吸收以及单线态氧的量子产率[15].此外,有机卟啉类化合物存在水溶性差、生物利用度低、肿瘤选择性不高等需要克服的主要障碍.
因此,我们设计并合成了一种新的三苯胺-锌卟啉(ZnTPor),其是将三苯胺共轭修饰到卟啉环上再与低细胞毒性的锌(Zn(II))配位,形成典型的供体-受体-供体(D-A-D)结构.同时为了提高有机物的亲水性,在共轭结构上引入聚乙二醇(PEG)链,具体见Scheme I.以有机小分子聚乙二醇-卟啉(PPor)作为参照,借助于紫外可见吸收光谱、荧光发射光谱,考察ZnTPor与DNA结合模式,同时,以2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)作为标记物,对其单线态氧能力进行了评价.
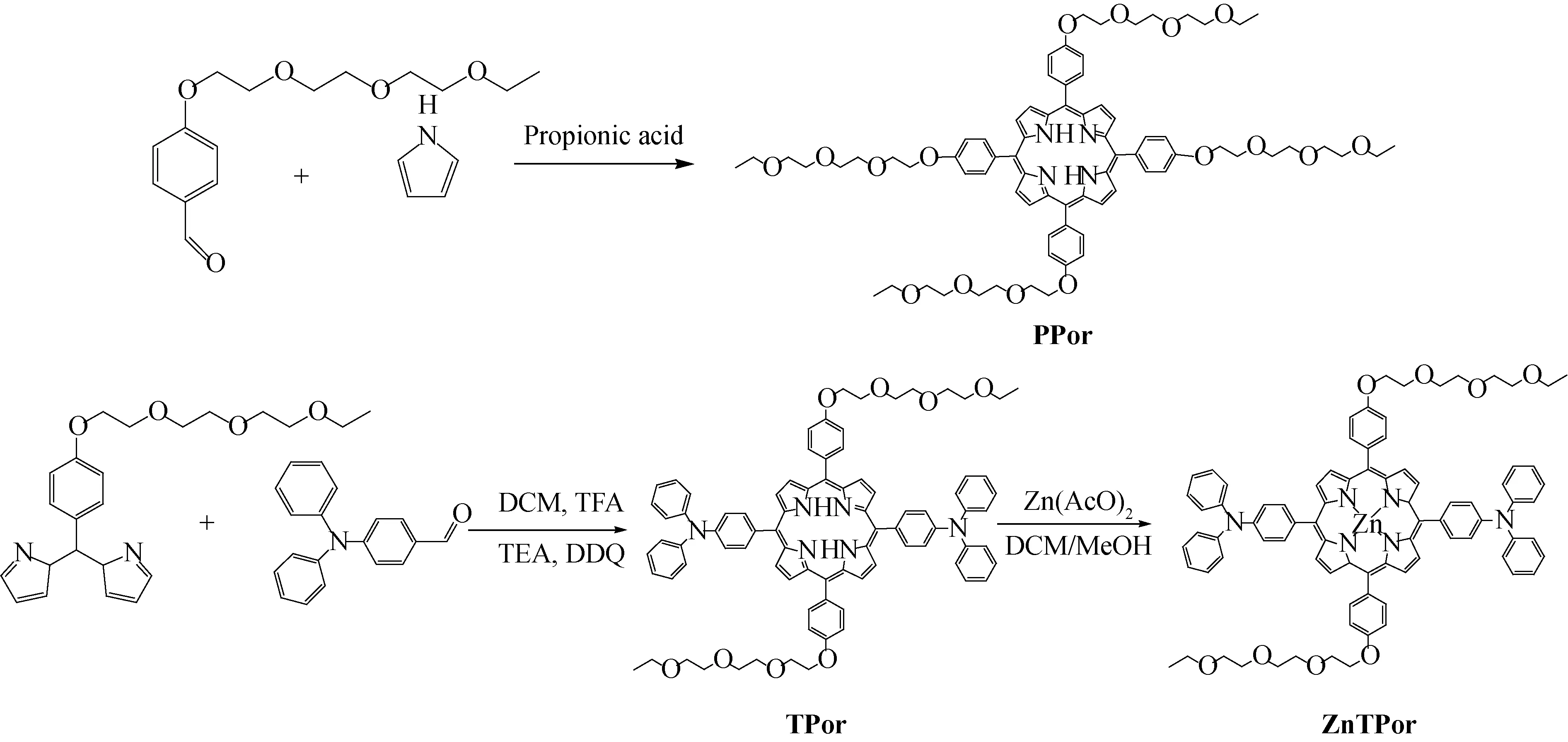
Scheme I PPor 和ZnTPor的合成路线
1 材料和方法
1.1 实验仪器及试剂Cary UV-100紫外-可见光谱仪;Fluoromax-4c-L荧光光谱仪(HoRIBA Scientific);Varian Mercury-VX400(400 MHz) 核磁共振仪;Bruker Auto MALDI-TOF 质谱仪;ct-DNA购于Sigma-Aldrich 公司,其他试剂由国药集团化学试剂有限公司提供,未进一步纯化.水为纯化水.PPor、TPor的制备方法参照文献[16].
1.2 ZnTPor的制备称取50 mg(0.038 5 mmol)TPor溶解在50 mL二氯甲烷中,85 mg(0.46 mmol)乙酸锌溶于5 mL甲醇后加入,室温避光搅拌12 h.减压浓缩除去溶剂后用二氯甲烷萃取,水及饱和食盐水洗涤,无水硫酸钠干燥,旋转蒸发仪除去溶剂后柱层层析分离提纯,洗脱剂为二氯甲烷∶甲醇=100∶1(V/V),得到紫色固体ZnTPor.1H NMR (400 MHz, DMSO)δ为8.91 (d,J=7.0 Hz, 4H), 8.80 (d,J=4.5 Hz, 2H), 8.76 (s, 2H), 8.04 (t,J=8.4 Hz, 8H), 4.32 (s, 4H), 3.88 (s, 4H), 3.67 (d,J=4.7 Hz, 4H), 3.61 (d,J=4.7 Hz, 4H), 3.56 (d,J=4.9 Hz, 4H), 3.50 (d,J=4.6 Hz, 4H), 3.47~3.42 (m, 4H), 1.10 (t,J=7.0 Hz, 6H). MS (Maldi-TOF):m/z=1 364.5 [M+1]+.
1.3 溶液的配置
1.3.1 Tris-HCl缓冲溶液的配制 将0.1 mol/L三羟甲基氨基甲烷(Tris)与0.1 mol/L盐酸溶液混合,配制成pH=7.4的Tris-HCl缓冲溶液,浓度为0.05 mol/L,其中含0.1 mol/L NaCl[17].
1.3.2ct-DNA储备液的配制 根据朗伯-比尔定律即A=εlc,可计算得到DNA浓度.其中A表示吸光度;ε为摩尔吸光系数;l为比色皿厚度;c为吸光物质浓度[18].
称取5 mgct-DNA溶于50 mL Tris-HCl缓冲溶液中,利用紫光-可见光谱仪测得其在260 nm和280 nm处的吸光度值.现已知ct-DNA在260 nm处的摩尔吸光系数为6 600 L· mol-1· cm-1,根据A=εlc计算得到ct-DNA浓度为1.33×10-4mol/L.并且A260 nm∶A280 nm=0.88∶0.486=1.81>1.8,所以该ct-DNA蛋白质的含量满足测试要求.
1.3.3 卟啉储备液的配制 溶解卟啉化合物于DMSO中,配制成浓度为1 mmol/L的溶液备用,再根据测试需要用Tris-HCl缓冲溶液稀释至所需浓度即可.
1.4 DNA相互作用
1.4.1 紫外可见光谱测试 量取10 μL 浓度为1 mmol/L 卟啉储备液于比色皿中,然后加入3 mL Tris-HCl缓冲溶液稀释至3 μmol/L.以不同浓度的ct-DNA溶液滴定,检测其在350~500 nm范围内吸光度的变化.每次加入ct-DNA后充分混合5 min,样品池厚度为1 cm.本次共测试11个ct-DNA浓度,分别为0、0.09、0.13、0.22、0.44、0.66、0.88、1.75、2.61、3.45、4.29 μmol/L.
1.4.2 荧光发射光谱测试 量取10 μL 1 mmol/L 卟啉储备液于比色皿中,然后加入3 mL Tris-HCl缓冲溶液稀释至3 μmol/L.以不同浓度的ct-DNA溶液滴定,检测其在600~750 nm范围内荧光强度的变化.每次加入ct-DNA后充分混合5 min,样品池厚度为1 cm.ZnTPor和PPor的激发波长分别是432和421 nm,激发狭缝2 nm,发射狭缝2 nm,扫描速度240 nm/min.本次共测试6个ct-DNA浓度,分别为0、0.66、0.88、1.75、2.61、3.45 μmol/L.
1.5 单线态氧产生量取1 mmol/L的卟啉储备液300 μL于1.2 mL DMSO,然后加入PBS缓冲溶液定容至10 mL,稀释浓度至30 μmol/L.从中取100 μL置于比色皿,然后加入0.5 μmol/L浓度的DCFH溶液2.9 mL,卟啉浓度变为1 μmol/L.每组用氙灯照射两分钟,共测试8组,激发波长为488 nm,以DCFH的PBS溶液为空白对照,检测500~600 nm范围内荧光强度的变化.
2 结果与讨论
2.1 与DNA结合模式
2.1.1 紫外-可见光谱法 在紫外-可见吸收光谱中,以不同浓度的ct-DNA滴定卟啉化合物,观察卟啉Soret带的吸收变化.如图1所示,随着ct-DNA浓度的增加(0~4.29 μmol/L),卟啉化合物在Soret带的吸光度均有不同程度的减弱并伴随着红移.这是因为卟啉的大环π*共轭体系与DNA碱基对发生π电子堆积,卟啉π*空轨道与碱基对的π电子轨道发生耦合导致能级降低,π→π*跃迁能级减小,从而出现了红移.另一方面,耦合作用使π*轨道部分充满电子,π→π*跃迁几率减小,因此出现减色效应[12,19].由表1和图2-1的减色(Hypochromicity)和红移(Bathochromic shift)数据可以看出,ZnTPor没有出现较大的红移(<5 nm)但出现了较大程度的减色(>50%),初步推断卟啉ZnTPor与DNA的结合模式为嵌插结合模式.PPor出现了一定程度的红移(5 nm)的减色程度很小(<30%),这表明PPor与DNA可能以嵌插或外部键合两种模式结合.
结合常数K可用来表示卟啉化合物与DNA结合能力,表现为插入模式K值在106~107,表现为外部键合模式的K值在105左右[12].其方程可表示为:
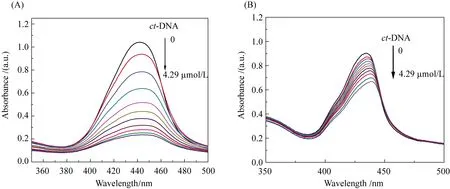
图1 ZnTPor (A)和 PPor (B)的ct-DNA滴定紫外-可见吸收光谱

表1 ct-DNA滴定法测定PPor和ZnTPor的紫外-可见吸收光谱、荧光发射、结合常数
D/Δεap=D/Δε+1/(ΔεK)
(1)
其中D表示DNA的浓度,单位为mol/L;Δεap=|εA-εF|;Δε=|εB-εF|;εA=Aobs/ [Porphyrin];εB和εF分别表示DNA-卟啉复合物的消光系数和未与DNA结合的自由卟啉的消光系数.D/Δεap和D之间具有一定的线性关系可线性拟合得出方程.线性拟合后将斜率1/Δε与截距1/(ΔεK)相除可计算得到K值(如图2),计算结果列于表1中.从表1中数据可以看出,PPor结合常数较小,结合紫外吸收可表明与DNA结合模式为外部键合.ZnTPor结合常数K大于106,与DNA结合能力较强.

图2 ZnTPor(A) 和 (B) PPor 的D/Δεap与D之间的关系
2.1.2 荧光发射光谱法 以不同浓度ct-DNA滴定卟啉,测得荧光发射光谱如图3所示.由表1和图3的数据不难看出,两种卟啉化合物均未出现较大位移(<5 nm),其中ZnTPor随着ct-DNA浓度增加,荧光强度有明显的降低,这是因为卟啉插入到DNA后,与DNA之间发生了能量传递导致荧光强度的降低.PPor的荧光强度减弱程度低,再次验证了ZnTPor的DNA结合能力较强.ZnTPor发生一定程度的蓝移,可能是因为卟啉环中配位了金属锌离子,使得卟啉本身电子云密度降低,也可能与金属锌的轴向配位有关.同时,ZnTPor与DNA相互作用后的红移和增强的荧光表明它可能是插入DNA的J聚集体[18].

图3 ZnTPor (A)和PPor (B)的ct-DNA滴定荧光发射光谱
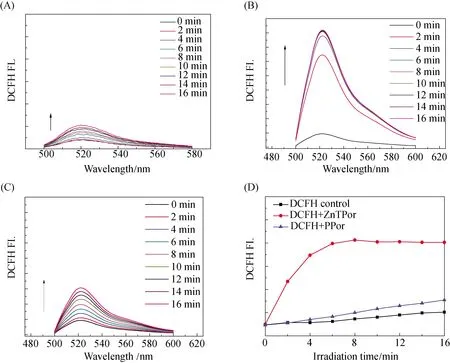
图4 DCFH的PBS缓冲溶液(A)在不同光照时间后的荧光发射光谱、(B) ZnTPor+DCFH和(C) PPor+DCFH的不同光照时间后的荧光发射光谱、(D) ZnTPor+DCFH和PPor+DCFH混合液 分别在523 nm处荧光强度与光照时间之间的变化曲线
2.2 单线态氧产生能力DCFH-DA(2′,7′-二氯荧光黄双乙酸盐)是非标记性的氧化敏感的荧光探针,本身没有荧光,进入细胞后,可以被细胞内的酯酶水解生成DCFH,细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF[20].所以可以根据检测DCF的荧光间接判定细胞内活性氧的水平.因为DCFH-DA易氧化的酚羟基形成乙酸酯后相对于DCFH的抗氧化能力增强.所以根据文献方法对DCFH-DA进行预处理,使其水解成为DCFH后使用.
如图4(A)所示,在DCFH的PBS溶液空白对照组中,光照后荧光强度变化不大,因此空气氧化DCFH产生荧光对实验的影响可忽略不计.图4(B)和(C)中可以观察到ZnTPor和PPor光照时间不同荧光强度的变化.在图4(D)中通过对比可观察到,随着光照时间的延长,在两种卟啉的存在下,DCF的荧光强度不断增强.说明卟啉样品在光照后产生了单线态氧,氧化DCFH使其成为具有绿色荧光的DCF.荧光强度越强,越快趋于饱和,说明单线态氧产生速率越快,即单线态氧产生效率ZnTPor>PPor.
对比两种卟啉化合物的单线态氧产生效率:ZnTPor>PPor,这可能是TPA作为供电子基团增加了卟啉的光敏活性,同时增大了共轭体系使得化合物光敏性增强,再加上卟啉与金属锌配位后,锌卟啉具有的高三重态量子产率[20],使得卟啉化合物自身的光敏性增强,具有更好的单线态氧产生能力.
3 结论
本研究通过紫外可见吸收光谱和荧光发射光谱数据进行线性拟合,计算DNA与卟啉的结合常数K值,研究卟啉化合物与ct-DNA的结合模式,这对生物活性的研究十分重要.发现两种卟啉化合物ZnTPor和PPor均能与DNA有较好结合,PPor为外部结合模式,ZnTPor和为嵌插模式.同时本研究还测试了化合物的单线态氧产生情况,以DCFH为活性氧探针,通过间接法测得单线态氧产生能力:ZnTPor>PPor.再次验证了ZnTPor的优良光学性能,具有D-A-D结构三苯胺卟啉复合物,有利于电子的转移, 增加卟啉的光敏活性,同时三苯胺连在卟啉环上增大了共轭体系使得化合物光敏性增强,与金属锌配位,也可增强卟啉的光敏性,使其具有更好的单线态氧产生能力.

