菠萝蜜低聚肽对γ射线辐照小鼠氧化损伤的保护作用
郝云涛 刘睿 珠娜 刘欣然 胡佳妮 康家伟 毛瑞雪 张亭 李勇
摘 要:目的:探究菠萝蜜低聚肽(JOPs)对γ射线辐照导致小鼠氧化损伤的保护作用。方法:选取96只SPF级雌性BALB/c小鼠,按体重随机分为空白组、模型组、乳清蛋白组(0.40 g/kg·BW)及3个JOPs干预组(0.20、0.40、0.80 g/kg·BW),每组随机分为2个亚组,8只/亚组。行灌胃干预第14 d除空白组外,小鼠接受60Co γ射线全身辐照,剂量3.5 Gy,剂量率1 Gy/min。两亚组分别在辐射后第3 d和第14 d检测小鼠血清和肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)水平。结果:辐照后第3 d及第14 d,相比空白组,模型组血清、肝脏SOD及GSH-Px活性均显著降低,MDA水平均显著增高,JOPs各剂量组小鼠血清及肝脏MDA水平均显著低于模型组与乳清蛋白组;辐照后第3 d,相比模型组,JOPs各剂量组小鼠血清及肝脏SOD、GSH-Px活性均显著增高,且高剂量组小鼠血清SOD活性及血清、肝脏GSH-Px活性与中、高剂量组肝脏SOD活性均显著高于乳清蛋白组;辐照后第14 d,相比模型组,JOPs各剂量组小鼠血清及肝脏SOD、GSH-Px活性均显著增高,且JOPs各剂量组小鼠血清SOD活性与高剂量组肝脏SOD、GSH-Px活性均显著高于乳清蛋白组。结论: JOPs对γ射线辐照所致氧化损伤具有保护作用。
关键词:菠萝蜜低聚肽;γ射线;氧化损伤;超氧化物歧化酶;谷胱甘肽过氧化物酶;丙二醛
自由基学说是电离辐射所致氧化损伤的理论基础,当机体受到射线辐照,机体中的水发生电离分解产生多种自由基,攻击机体细胞组织从而造成损伤[1-3]。然而,目前辐射防护剂多为化学合成物质,临床效果有限且毒副作用大,寻找安全有效、毒副作用小的天然抗辐射剂是亟待解决的问题[4]。据文献报道,人参低聚肽、核桃低聚肽等均可通过增强机体清除自由基能力,降低电离辐射引起的氧化损伤[5-6]。1 000余年前,菠萝蜜被引入我国,现广泛种植于我国南方多省,年产量及总产值可观[7-9]。菠萝蜜是药食两用食物,其保健作用早在《本草纲目》有过记载[10-14]。菠萝蜜果肉及种子中蛋白质含量丰富,远超其他常见水果[15-17]。菠萝蜜低聚肽(JOPs)是利用生物酶解技术从菠萝蜜果肉和种子中制取得到的小分子生物活性肽,主要成分是小分子活性寡肽。目前尚无关于JOPs通过抗氧化功能發挥其辐射防护作用的研究报道,本研究采用γ射线辐照BALB/c小鼠,通过检测辐照后小鼠血清和肝脏SOD活性、GSH-Px活性及MDA水平,探究JOPs对电离辐射所致氧化损伤的保护作用。
1 材料与方法
1.1 样品
JOPs,淡黄色固体粉末,主要成分为分子量<1 000 Da的寡肽,购自海南盛美诺生物技术有限公司。
1.2 主要试剂与仪器
HFY-1A沽源控制台、HFY-601固定式多路X、γ剂量率仪、60Co γ射线辐射源,北京大学化学与分子工程学院;小鼠SOD、GSH-Px和MDA检测试剂盒,北京麦格泰克科技有限公司。
1.3 实验动物
96只健康SPF级BALB/c雌性小鼠,6~8周龄,体重18~22 g,由北京大学医学部实验动物中心提供,许可证号:SYXK(京)2016-0041。分笼饲养,4只/笼,自由饮食、饮水,饲喂SPF级小鼠生长饲料。动物房屏障环境饲养小鼠,温度24~26℃,相对湿度50%~60%,室内照明光暗周期节律12h/12h,照明时间7∶00~19∶00。
1.4 实验方法
1.4.1 实验动物分组与处理 适应1周后,按体重将96只BALB/c小鼠随机分为空白组、模型组、乳清蛋白组(0.40 g/kg·BW)及JOPs低、中、高剂量干预组(0.2、0.4、0.8 g/kg·BW),16只/组,再将每组随机分为2个亚组,8只/亚组。两亚组小鼠均接受3.5Gy辐照剂量,制造辐射损伤动物模型。
1.4.2 血清抗氧化指标检测 灌胃干预第14 d,除空白组外,其他各组小鼠均一次性接受3.5 Gy的60Co γ 射线全身辐照,吸收剂量率为1 Gy/min,辐照后继续灌胃干预,分别在辐射后第3 d和第14 d摘眼球取血,将血液3 000 r/min离心10 min,移取血清并按照试剂盒说明书检测血清SOD、GSH-Px活性和MDA水平。
1.4.3 肝脏抗氧化指标检测 灌胃干预第14 d,除空白组外,其他各组小鼠均一次性接受3.5 Gy的 60Co γ 射线全身辐照,吸收剂量率为1 Gy/min。辐照后继续灌胃干预,分别在辐射后第3 d和第14 d摘眼球取血后,颈椎脱臼法处死小鼠,剥离肝脏,去除表面脂肪组织和胆囊,在相同部位称取适量肝组织,剪碎后加入冷生理盐水,匀浆机制成10%肝组织匀浆,然后3 000r/min,离心10 min,按照试剂盒说明书测定肝组织SOD、GSH-Px活性及MDA水平。
1.5 统计分析
数据以±s表示,用SPSS 20.0软件进行分析。行One-Way ANOVA,方差齐者,组间统计采用LSD法;如方差不齐,组间统计采用Dunnetts T3法。P<0.05表示差异有统计学意义。
2 结果与分析
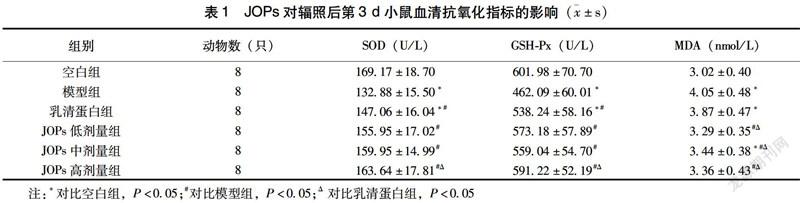
2.1 JOPs对辐照后第3 d小鼠血清抗氧化指标的影响
如表1所示,辐照后第3 d,相比空白组,模型组与乳清蛋白组小鼠血清SOD、GSH-Px活性降低,差异有统计学意义(P<0.05);JOPs各剂量干预组小鼠血清SOD、GSH-Px活性均高于模型组(P<0.05),其中JOPs高剂量组小鼠血清SOD、GSH-Px活性均显著高于乳清蛋白组(P<0.05);模型组、乳清蛋白组及JOPs中剂量组小鼠血清MDA水平明显低于空白组(P<0.05),此外,JOPs各剂量干预组小鼠血清MDA水平均比模型组及乳清蛋白组低(P<0.05)。
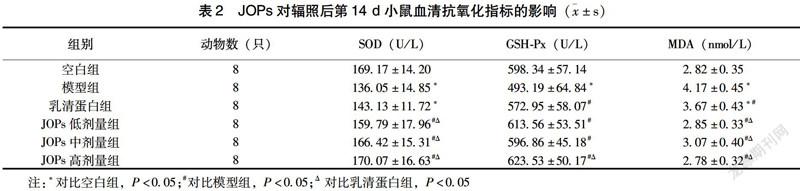
2.2 JOPs对辐照后第14 d小鼠血清抗氧化指标的影响
如表2所示,辐照后第14 d,模型组小鼠血清SOD、GSH-Px活性与乳清蛋白组血清SOD活性明显低于空白组(P<0.05),而血清MDA水平明显高于空白组;JOPs各剂量干预组小鼠血清SOD活性均比模型组及乳清蛋白组高(P<0.05);JOPs各剂量组小鼠血清GSH-Px活性也均明显高于模型组(P<0.05),且JOPs高剂量干预组小鼠血清GSH-Px活性明显高于乳清蛋白组(P<0.05);JOPs各剂量干预组小鼠血清MDA水平均低于模型组及乳清蛋白组,差异有统计学意义(P<0.05)。
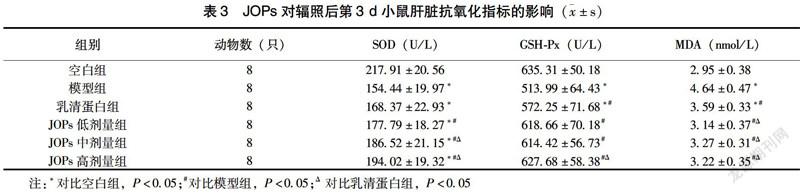
2.3 JOPs对辐照后第3 d 小鼠肝脏抗氧化指标的影响
如表3所示,辐照后第3 d,模型组与乳清蛋白组小鼠肝脏SOD、GSH-Px活性明显低于空白组(P<0.05);相比模型组,JOPs各剂量干预组小鼠肝脏SOD、GSH-Px活性均明显增高(P<0.05),并且JOPs中、高剂量组小鼠肝脏SOD活性及JOPs高剂量组小鼠肝脏GSH-Px活性均较乳清蛋白组显著增高(P<0.05);对比空白组,模型组及乳清蛋白组小鼠肝脏MDA水平明显降低(P<0.05),此外,JOPs各剂量干预组小鼠肝脏MDA水平均低于模型组与乳清蛋白组,差异有统计学意义(P<0.05)。
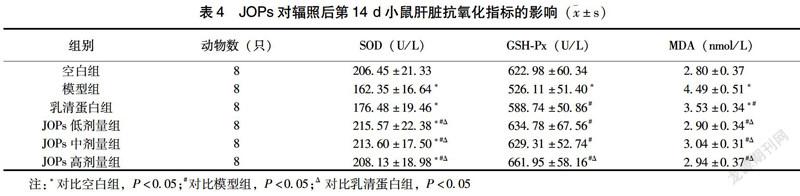
2.4 JOPs對辐照后第14d小鼠肝脏抗氧化指标的影响
如表4所示,辐照后第14 d,相比空白组,模型组小鼠肝脏SOD、GSH-Px活性与乳清蛋白组小鼠肝脏SOD活性明显降低(P<0.05),而模型组与乳清蛋白组肝脏MDA水平明显比空白组高(P<0.05);相比模型组及乳清蛋白组,JOPs各剂量干预组小鼠肝脏SOD活性均明显增高(P<0.05);JOPs各剂量干预组小鼠肝脏GSH-Px活性均明显比模型组高(P<0.05),且JOPs高剂量组小鼠肝脏GSH-Px活性高于乳清蛋白组,差异有统计学意义(P<0.05);相比模型组与乳清蛋白组,JOPs各剂量干预组小鼠肝脏MDA水平均明显降低(P<0.05)。
3 讨论
氧化损伤主要由于机体内外因素导致的活性氧(ROS)水平急剧增加,超出了相应的抗氧化防御体系的能力范围引起[18]。ROS是一类高度活跃的分子,在一定剂量范围内,正常机体代谢不断产生的ROS具有重要生理功能的信号调节作用,但如果机体在各种内外因素诱导下,产生过量的ROS,超出抗氧化体系承受的范围,则会产生氧化损伤,致使各种临床疾病的发生和发展[19-21]。电离辐射是临床检查、肿瘤的放射治疗以及各种介入治疗的重要手段,也是环境中诱导ROS产生,进而引起氧化损伤的多种常见有害理化因素之一[4,22]。研究表明,电离射线与组织相互作用产生的大量ROS对机体生物大分子的损害,是造成机体辐照损伤的主要原因[23]。电离辐射能够通过其高能粒子诱导产生大量ROS,引起多种组织器官氧化损伤,有效防治这种氧化损伤对于防护各种情况的辐射损伤,减轻辐射引起的临床不良反应,维护健康具有重要意义[24-29]。已有研究表明,通过减轻机体氧化应激水平,提高抗氧化能力,可减轻辐射损伤[30-31]。
机体具有应对氧化损伤的抗氧化防御体系,主要由多种抗氧化酶和一些非酶类的抗氧化剂组成,正常生理状态下这些抗氧化剂可协同作用,将ROS水平控制在适宜范围内[32]。SOD是抗氧化系统的第一道防线,在需氧生物中普遍存在[33]。GSH-Px可清除脂质氢过氧化物,并在CAT含量很少或H2O2产量很低的组织中,可代替CAT清除在SOD催化下由O-2·转化生成的H2O[34-35]2。作为膜脂质过氧化的终产物,MDA具有较强的细胞毒性,可造成细胞代谢异常和功能破坏,因此,机体MDA的水平可反映γ射线辐照所致的氧化损伤程度[36]。
本研究结果显示,γ射线辐照可导致模型组小鼠血清及肝脏SOD、GSH-Px活性降低,MDA水平增高,与Dilek Kutanis等[37]的研究一致。辐照后第3 d及第14 d相对于模型组,JOPs各剂量干预组小鼠的SOD、GSH-Px活性及MDA水平均得到明显改善(P<0.05)。辐照后第3 d,JOPs高剂量组小鼠血清SOD活性及血清、肝脏GSH-Px活性与中、高剂量组肝脏SOD活性均显著高于乳清蛋白组(P<0.05);辐照后第14 d,JOPs各剂量组小鼠血清SOD活性与高剂量组肝脏SOD、GSH-Px活性均显著高于乳清蛋白组(P<0.05)。JOPs作用优于乳清蛋白,表明JOPs对辐照所致氧化损伤的保护功效并非单纯由于机体蛋白质摄入量增加所引起。因此可推断,JOPs可通过增强机体血清及肝脏SOD、GSH-Px活性,提高自由基清除速率,从而降低机体脂质氧化水平,减轻细胞膜结构及功能受损,进而减轻机体因γ射线辐照所致的氧化损伤,发挥电离辐射防护功能。但是,JOPs的作用机制仍需进一步的研究。
4 结论
本研究首次证实JOPs对机体γ射线辐照所致氧化损伤具有一定保护作用,为其作为具有辐射防护作用的新型保健食品的开发及应用提供了科学依据。
参考文献
[1]刘琪,李文军,陆丽娜,等.藻蓝蛋白对辐射致小鼠氧化损伤的保护作用 [J].核技术,2018,41(1):31-36.
[2]Toro C G D,Toro P A D,Zieher L M,et al.Sensitivity of cerebellar glutathione system to neonatal ionizing radiation exposure [J].Neurotoxicology,2007,28(3):555-561.
[3]Dinesh T,Sergei C,Billy H,et al.Pyridoxamine protects intestinal epithelium from ionizing radiation-induced apoptosis [J].Free Radical Biology & Medicine,2009,47(6):779-785.
[4]孙兰兰,李恒,唐炜,等.抗辐射损伤药物的研究进展 [J].中南药学,2018,16(1):87-92.
[5]He L X,Wang J B,Sun B,et al.Suppression of TNF-alpha and free radicals reduces systematic inflammatory and metabolic disorders:radioprotective effects of ginseng oligopeptides on intestinal barrier function and antioxidant defense [J].J Nutr Biochem,2017,40:53-61.
[6]珠娜,郝云涛,张亭,等.核桃低聚肽对60Co γ射线照射小鼠氧化损伤保护作用的实验研究[J].中国预防医学杂志,2019(3):212-216.
[7]Xu S Y,Liu J P,Huang X,et al.Ultrasonic-microwave assisted extraction,characterization and biological activity of pectin from jackfruit peel [J].LWT,2018,90:577-582.
[8]王穎倩.菠萝蜜果粉干燥工艺对比试验研究 [D].黑龙江大庆:黑龙江八一农垦大学,2018.
[9]Zhang Y,Zhu K,He S,et al.Characterizations of high purity starches isolated from five different Jackfruit cultivars [J].Food Hydrocolloids,2016,52:785-794.
[10]Swami S B,Thakor N J,Haldankar P M,et al.Jackfruit and its many functional components as related to human health:a review [J].Comprehensive Reviews in Food Science & Food Safety,2012,11(6):565-576.
[11]Jagtap Umesh B,N P S,A B V.Evaluation of antioxidant capacity and phenolcontent in jackfruit (Artocarpus heterophyllus Lam.)[J].Plant Foods Hum Nutr,2010,65(2):99-104.
[12]Zhu K,Zhang Y,Nie S,et al.Physicochemical properties and in vitro antioxidant activities of polysaccharide from Artocarpus heterophyllus Lam pulp [J].Carbohydrate Polymers,2017,155:354-361.
[13]李移,李尚德,陈杰.菠萝蜜微量元素含量的分析 [J].广东微量元素科学,2003,10(1):57-59.
[14]李时珍.本草纲目:下册 [M].北京:人民卫生出版社,1982.
[15]林华娟,秦小明,曹湛惠,等.菠萝蜜果实不同组织中果胶物质的比较 [J].广东农业科学,2007(5):73-74.
[16]Rahman M A,Nnhar N,Mian A J,et al.Variation of carbohydrate composition of two forms of fruit from jack tree (Artocarpus heterophyllus)with maturity and climatic conditions [J].Food Chemistry,1999,65(1):91-97.
[17]房一明,张彦军,谷风林,等.菠萝蜜的营养成分与鉴别比较研究 [J].热带作物学报,2014,35(10):2088-2092.
[18]He L,He t,Farrar S,et al.Antioxidants maintain cellular redox homeostasis by elimination of reactive oxygen species [J].Cellular Physiology & Biochemistry,2017,44(2):532-553.
[19]Angelova P R,Abramov A Y.Role of mitochondrial ROS in the brain:from physiology to neurodegeneration [J].Febs Letters,2018,592(5):692-702.
[20]Bashan N,Kovsan J,Kachko I,et al.Positive and negative regulation of insulin signaling by reactive oxygen and nitrogen species [J].Physiological reviews,2009,89(1):27-71.
[21]Kanaan G N,Harper M E.Cellular redox dysfunction in the development of cardiovascular diseases [J].Biochimica Et Biophysica Acta,2017,1861(11):2822-2829.
[22]Blajszczak C,Bonini M G.Mitochondria targeting by environmental stressors:implications for redox cellular signaling [J].Toxicology,2017,391:84-89.
[23]Desouky O,Nan D,Zhou G.Targeted and non-targeted effects of ionizing radiation [J].Journal of Radiation Research & Applied Sciences,2015,8(2):247-254.
[24]Selzer E.Basic principles of molecular effects of irradiation [J].Wiener Medizinische Wochenschrift,2012,162(3-4):47-54.
[25]Hideyuki T,Seiji K,Naoki M,et al.Involvement of reactive oxygen species (ROS)in the induction of genetic instability by radiation [J].Journal of Radiation Research,2004,45(2):181-188.
[26]Finkel T,Holbrook N J.Oxidants,oxidative stress and the biology of ageing [J].Nature,2000,408(6809):239-247.
[27]Das U,Bisas S,Sengupta A,et al.Ferulic acid (FA)abrogates ionizing radiation-induced oxidative damage in murine spleen [J].International Journal of Radiation Biology,2016,92(12):806-818.
[28]Sener G,Atasoy B M,Ersoy Y,et al.Melatonin protects against ionizing radiation-induced oxidative damage in corpus cavernosum and urinary bladder in rats [J].J Pineal Res,2004,37(4):241-246.
[29]Citrin D E,Mitchell J B.Mechanisms of normal tissue injury from irradiation [J].Seminars in Radiation Oncology,2017,27(4):316-324.
[30]许靖逸,李祥龙,李解,等.雅安藏茶茶褐素对60Coγ辐射损伤的防护作用 [J].核技术,2017,40(4):7-14.
[31]Kim H G,Jang S S,Lee J S,et al.Panax ginseng Meyer prevents radiation-induced liver injury via modulation of oxidative stress and apoptosis [J].Journal of Ginseng Research,2017,41(2):159-168.
[32]Kalyanaraman B.Teaching the basics of redox biology to medical and graduate students:oxidants,antioxidants and disease mechanisms [J].Redox Biology,2013,1(1):244-257.
[33]袁牧,王昌留,王斐,等.超氧化物歧化酶的研究進展 [J].中国组织化学与细胞化学杂志,2016,25(6):550-558.
[34]Yu Y,Wei J.Glutathione peroxidase and its synthesis mechanism [J].Acta Biophysica Sinica,2013,29(10):724-737.
[35]Peng C,Wang X,Chen J,et al.Biology of ageing and role of dietary antioxidants [J].Biomed Research International,2014,2014(6):831-841.
[36]Tsikas D.Assessment of lipid peroxidation by measuring malondialdehyde (MDA)and relatives in biological samples:analytical and biological challenges [J].Analytical Biochemistry,2016(524):13-30.
[37]Kutanis D,Erturk E,Besir A,et al.Dexmedetomidine acts as an oxidative damage prophylactic in rats exposed to ionizing radiation [J].J Clin Anesth,2016(34):577-585.

