山茱萸莫罗苷经Bcl-2/Bax 通路抗H9c2 心肌细胞氧化应激损伤研究
邱清勇,彭 锦,陈 丽,吕 秋,符碧薇
(1. 中国人民解放军联勤保障部队第九二八医院心血管内科,海南 海口 570206; 2. 海南医学院基础医学与生命科学学院,海南 海口 571199)
氧化应激在心力衰竭、心肌缺血-再灌注损伤、心肌病、动脉粥样硬化、房颤等多种心血管疾病的发病机制中起着至关重要的作用[1-2]。氧化应激导致活性氧(ROS)的过量产生,是心血管疾病发生的重要因素[3]。过量的ROS 不仅可导致心肌细胞氧化-抗氧化平衡系统失衡,且会导致细胞凋亡[4-5]。因此,减轻氧化应激和/或直接干预凋亡途径的抑制可为治疗提供潜在的分子靶标[6]。山茱萸是落叶小乔木山茱萸树上的红色果肉,有非特异性免疫增强功能及抗氧化和抗炎作用[7]。山茱萸提取物通过改善氧自由基的清除能力和抑制膜的氧化损伤而对心肌细胞有明显的保护作用[8]。山茱萸莫罗苷是山茱萸提取物的主要成分之一,是一种良好的抗氧化剂[9]。本研究中考察了山茱萸莫罗苷通过调节B细胞淋巴瘤/白血病-2(Bcl-2)/Bcl-2 相关X 蛋白(Bax)信号通路发挥H9c2 心肌细胞氧化应激损伤的防护作用。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:CO2培养箱(美国Thermo Revco 公司);Sunrise 型全自动酶标仪(瑞士Tecan 公司);BD 垂直电泳仪、BD FACSCanto 型流式细胞仪(美国BD 公司)。
试药:山茱萸莫罗苷(上海医科大学天然药物化学教研室,批号为131035,质量分数大于98%);30%H2O2(江苏凯基生物技术股份有限公司,批号为KGF009);改良杜氏伊格尔培养基(DMEM,批号为C11965500BT);胎牛血清(美国Gibco 公司,批号为25200056);四氮唑(MTT,美国Amresco 公司,批号为M8180-1);ANNEXIN V- FITC/PI 凋亡检测试剂盒(北京索莱宝科技有限公司,批号为CA1020);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)和丙二醛(MDA)检测试剂盒,均购自南京建成生物工程研究所(批号分别为A003-1-2,A001-3-2,E004-1-1);2′,7′-二氯荧光黄双乙 酸 盐(DCFH-DA,美 国 Sigma 公 司,批 号 为ml063160);蛋白抽提试剂盒(武汉博士德生物工程有限公司,批号为AR0103);Bcl-2、Bax、细胞色素c(Cyt-c)、半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)和β-actin 抗体,均购自美国Santa Cruz公司(批号分别为SC-5248,SC-393813,SC-5482,SC-6284,SC-7518);辣根过氧化物酶HRP 标记亲和纯化山羊抗小鼠IgG 二抗(武汉艾美捷科技有限公司,批号为C1313)。
细胞:H9c2 大鼠心肌细胞(中国科学院典型培养物保藏委员会细胞库,批号为131035)。
1.2 细胞培养和分组
用含10%胎牛血清的DMEM 培养基在37 ℃及5% CO2条件下培养H9c2 细胞,选择对数生长期细胞进行试验。分为阴性对照组(A 组)、阳性对照组(B 组)、莫罗苷低、中、高剂量组(C1组、C2组、C3组)。A 组加入无血清DMEM 培养基;B 组加入终浓度为200 μmol/L 的H2O2;C1组、C2组、C3组分别加入终质量浓度为25,50,100μg/mL的山茱萸莫罗苷,同时给予终浓度为200 μmol/L 的H2O2,继续培养24 h 后进行相关检测[10-11]。
1.3 检测细胞增殖率
以5×103/孔接种于96 孔板中(每孔200 μL),待细胞融合后,按1.2 项下方法给予受试物干预20 h,继续培养20 h,每孔加入MTT 50 μL,继续培养4 h,轻轻吸取上清液,加入二甲基亚砜(DMSO,每孔200 μL),室温振荡10 min,采用酶标仪于492 nm 波长处测定吸光度(OD 值),计算细胞增殖率[细胞增殖率=(OD实验组-OD空白孔)/(OD阴性对照组- OD空白孔)]。
1.4 检测细胞凋亡情况
以5×104/孔接种于6 孔板内(每孔3 mL),待细胞融合后,按1.2 项下方法给予受试物干预24 h,转移至离心管内离心,用磷酸盐缓冲液洗涤2 次,加入膜联蛋白V-FITC 和PI,并将细胞在室温下避光孵育10 min,用流式细胞仪检测细胞凋亡情况。
1.5 检测SOD,GSHPx,MDA 和ROS 水平
以5×104/孔接种于6 孔板内(每孔3 mL),待细胞融合后,按1.2 项下方法给予受试物干预24 h,收集细胞,3 000 g 离心10 min,弃培养基,加入2 mL 磷酸盐缓冲液,用细胞超声破碎仪处理30 s,12 000 g 离心10 min,收集上清液,按试剂盒说明书检测细胞中SOD,GSHPx,MDA 活性;采用DCFH-DA 探针联合酶标仪法检测细胞内ROS 水平,按1.2 项下方法给予受试物干预24 h,弃培养基,分别加入DCFH-DA(每孔10 μmol/L),在37 ℃下孵育60 min,采用流式细胞仪检测ROS 表达水平。
1.6 检测Bcl-2,Bax,Cyt-c 和Caspase-3 水平
以5×104/孔接种于6 孔板内(每孔3 mL),待细胞融合后,按1.2 项下方法给予受试物干预24 h,收集细胞,3 000 g 离心10 min 弃培养基,根据细胞量加入细胞蛋白抽提液,SDS-PAGE 进行电泳,每孔上样量为20 μg,将印迹转移到聚偏氟乙烯膜上,用5%脱脂牛奶在室温下封膜1 h,将膜与Bcl-2(1 ∶200)、Bax(1 ∶500)、Cyt-c(1 ∶300)、Caspase-3(1 ∶200)和β-actin(1 ∶1 000)抗体进行孵育,4 ℃过夜,将二抗(1 ∶5 000)在室温下孵育30 min。进行显色,采集图像,通过Image LabTM软件(Bio-Rad)获取信号,并估计强度,以β-actin 作为内对照。
1.7 统计学处理
采用SPSS 23.0 统计学软件分析。试验结果采用均数±标准差(± s),用单因素方差分析进行判断,组间两两比较用LSD- t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 对H9c2 细胞增殖和细胞凋亡的影响
与A 组相比,B 组和C1组、C2组、C3组H9c2 细胞增殖率降低,H9c2 细胞凋亡率增加,差异有统计学意义(P<0.05);与B 组相比,C1组、C2组、C3组H9c2 细胞增殖率增加,H9c2 细胞凋亡率降低,且呈剂量依赖性,差异有统计学意义(P<0.05)。详见表1 和图1。
表1 山茱萸莫罗苷对H9c2 细胞增殖和凋亡情况及ROS 水平的影响( ± s,%)

表1 山茱萸莫罗苷对H9c2 细胞增殖和凋亡情况及ROS 水平的影响( ± s,%)
注:与A 组比较,a P <0.05;与B 组比较,b P <0.05;与C1 组比较,c P <0.05;与C2 组比较,d P <0.05。下表同。
组别A 组B 组C1 组C2 组C3 组细胞增殖率100.00 ±6.28 51.07 ±7.12a 64.28 ±13.50ab 76.26 ±6.93abc 84.73 ±11.27abcd细胞凋亡率0.12±0.05 4.59±0.63a 3.52±0.51ab 2.41±0.40abc 1.50±0.37abcd ROS 34.89 ±5.29 79.25 ±10.81a 64.82 ±7.08ab 56.27 ±8.24abc 42.18 ±5.61abcd

图1 山茱萸莫罗苷对H9c2 细胞凋亡的影响
2.2 对ROS 水平的影响
与A 组相比,B 组、C1组、C2组、C3组H9c2 细胞中ROS 水平增加,差异有统计学意义(P<0.05);与B 组相比,C1组、C2组、C3组H9c2 细胞中ROS 水平降低,且呈剂量依赖性,差异有统计学意义(P<0.05)。详见表1和图2。
2.3 对SOD,GSHPx,MDA 水平的影响
与A 组相比,B 组、C1组、C2组、C3组H9c2 细胞中SOD 和GSHPx 水平降低,H9c2 细胞中MDA 水平增加,差异有统计学意义(P<0.05);与B 组相比,C1组、C2组、C3组H9c2 细胞中SOD 和GSHPx 水平增加,H9c2细胞中MDA 水平降低,且呈剂量依赖性,差异有统计学意义(P<0.05)。详见表2。
表2 山茱萸莫罗苷对H9c2 细胞中SOD,GSHPx,MDA 水平的影响( ± s)
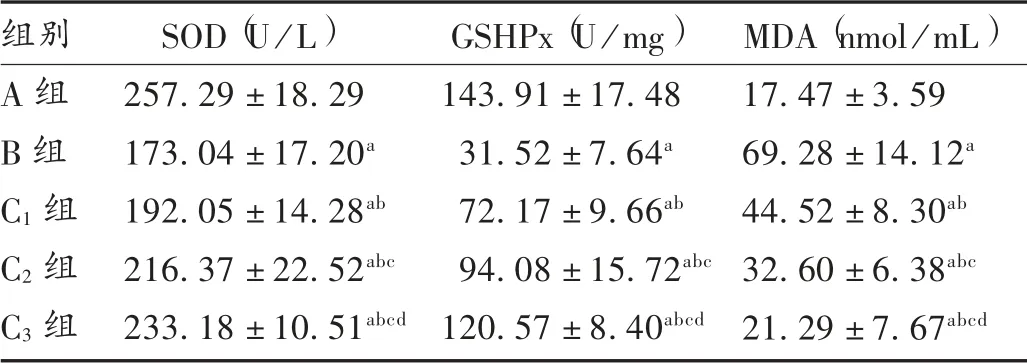
表2 山茱萸莫罗苷对H9c2 细胞中SOD,GSHPx,MDA 水平的影响( ± s)
组别A 组B 组C1 组C2 组C3 组SOD(U/L)257.29 ±18.29 173.04 ±17.20a 192.05 ±14.28ab 216.37 ±22.52abc 233.18 ±10.51abcd GSHPx(U/mg)143.91 ±17.48 31.52 ±7.64a 72.17 ±9.66ab 94.08 ±15.72abc 120.57 ±8.40abcd MDA(nmol/mL)17.47 ±3.59 69.28 ±14.12a 44.52 ±8.30ab 32.60 ±6.38abc 21.29 ±7.67abcd

图2 山茱萸莫罗苷对H9c2 细胞中ROS 水平的影响
2.4 对Bcl-2,Bax,Cyt-c,Caspase-3 水平的影响
与A 组相比,B 组、C1组,C2组,C3组H9c2 细胞中Bcl-2 水平降低,H9c2 细胞中Bax,Cyt-c,Caspase-3水平增加,差异有统计学意义(P<0.05);与B 组相比,C1组、C2组、C3组H9c2 细胞中Bcl-2 水平增加,H9c2 细胞中Bax,Cyt-c,Caspase-3 水平降低,且呈剂量依赖性,差异有统计学意义(P<0.05)。详见表3 和图3。
表3 山茱萸莫罗苷对H9c2 细胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影响( ± s)
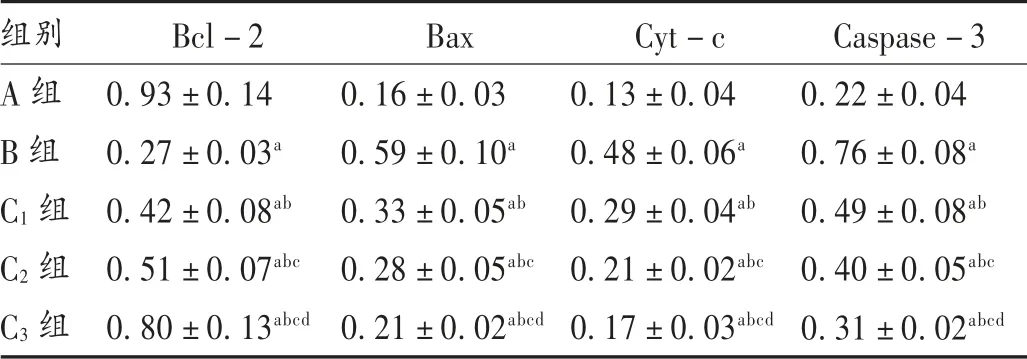
表3 山茱萸莫罗苷对H9c2 细胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影响( ± s)
组别A 组B 组C1 组C2 组C3 组Bcl-2 0.93±0.14 0.27±0.03a 0.42±0.08ab 0.51±0.07abc 0.80±0.13abcd Bax 0.16±0.03 0.59±0.10a 0.33±0.05ab 0.28±0.05abc 0.21±0.02abcd Cyt-c 0.13±0.04 0.48±0.06a 0.29±0.04ab 0.21±0.02abc 0.17±0.03abcd Caspase-3 0.22±0.04 0.76±0.08a 0.49±0.08ab 0.40±0.05abc 0.31±0.02abcd

图3 山茱萸莫罗苷对H9c2 细胞中Bcl-2,Bax,Cyt-c,Caspase-3 水平的影响
3 讨论
山茱萸是山茱萸科植物除去种子的成熟果实,其提取物主要成分包括类黄酮、莫罗苷、三萜、多酚和多糖,具有补血固精、补益肝肾、调气、补虚、明目、强身等功效。药理学研究表明,山茱萸乙醇提取物通过提高清除氧自由基和抑制膜氧化损伤的能力,对心肌细胞有显著保护作用[12]。大量的体内外研究表明,莫罗苷有抗癌、抗氧化剂、抗炎、抗动脉粥样硬化、抗病毒等功效。氧化应激在各种心血管疾病的发病机制中起重要作用[13]。山茱萸莫罗苷对心肌细胞氧化应激损伤的作用尚未阐明。氧化应激损伤过程中,心肌细胞凋亡常与ROS 的过量产生有关,抑制氧化损伤和氧化应激诱导的细胞凋亡是心血管疾病的重要干预策略[14]。本研究中采用H9c2心肌细胞,与H2O2孵育,建立氧化应激损伤模型,研究山茱萸莫罗苷的保护作用及其作用机制。通过MTT 法确定细胞活力。H2O2孵育24 h 后,A 组细胞增殖率降低;经山茱萸莫罗苷预处理后,细胞增殖率明显升高,表明山茱萸莫罗苷可保护心肌细胞免受H2O2诱导损伤。
氧气是心肌细胞的关键必需物质,通常伴随着线粒体呼吸作用产生的潜在危险的ROS。钙离子超载的发生和过量ROS 的产生在氧化应激过程中有相互的因果关系[15]。氧化应激产生的过量ROS 可能会破坏膜结构,增加膜通透性,消耗细胞内三磷酸腺苷(TP),并导致大量Ca2+流入细胞外及细胞内钙超载,进一步加剧ROS 的产生[16]。氧化剂和抗氧化剂间的平衡在维持正常的生物学功能中起着至关重要的作用。外源性刺激会破坏体内的平衡,引起体内ROS 的过度积累,并诱发多种疾病。尽管脂质过氧化产物可间接反映氧化应激条件下ROS 的生成,但细胞抗氧化酶(如SOD,GSH-Px)可降低细胞内ROS 含量[17]。本研究结果显示,山茱萸莫罗苷预处理可减少MDA 和ROS 的产生,并提高SOD 和GSH-Px 的活性。山茱萸莫罗苷的作用可能部分归因于改善了氧化剂和抗氧化剂系统的平衡。
凋亡是细胞死亡途径的程序性和主动模式,在正常的生理或病理环境中受其自身基因调控,H2O2处理的H9c2 细胞可促进细胞凋亡[18]。本研究中,H2O2诱导的细胞凋亡形态发生变化,通过PI 和DAPI 染色观察到细胞萎缩、染色质浓缩和出现凋亡小体。同时,山茱萸莫罗苷可能对H2O2诱导的细胞凋亡有保护作用。
由于其与氧化应激损伤和细胞凋亡的潜在相关性,在氧化应激过程中,多种作用机制可引起心肌损伤。ROS 直接或通过Bcl- 2 / Bax 信号通路引起细胞损伤[19]。Bcl-2/Bax 是线粒体稳态的主要调节因子;其通过稳定细胞膜完整性和抑制线粒体通透性转换孔(MPTP)的开放来阻止Cyt-c 从线粒体释放,从而起到抗凋亡作用,促凋亡分子Bax 通过MPTP 孔的开放来促进Cyt-c 从线粒体释放[20-21]。Cyt-c 可与凋亡蛋白酶活化因子1(Apaf-1)、半胱天冬酶原-9(Procaspase-9)结合形成复杂的凋亡小体,激活Caspase-3 级联反应,诱导细胞凋亡[22]。因此,Bcl-2/Bax 的降低导致线粒体内孔隙的形成,并导致线粒体内的小分子流出,山茱萸莫罗苷预处理可通过降低Bax,Cyt-c,Caspase-3 的表达,增加Bcl-2 的合成来抑制细胞凋亡。
综上所述,山茱萸莫罗苷对H2O2诱导的H9c2 细胞氧化损伤具有一定的保护作用,其作用机制与Bcl-2/Bax 细胞信号通路有关。可能具有预防和治疗H2O2引起的心肌细胞氧化应激损伤的潜力,但尚需大量的研究进行论证。

