抗血小板治疗对脑梗死合并CYP2C19基因变异患者的疗效及出血风险分析
陈雅洁,黄婷婷,李秀云
(皖南医学院第一附属医院 弋矶山医院 神经内科,安徽 芜湖 241001)
氯吡格雷是临床常用抗血小板聚集药物,但通过临床观察发现并不是所有病人都能从氯吡格雷药物治疗中获益,药物使用过程中仍可能出现心脑血管不良事件,即通常所说的“氯吡格雷抵抗”现象。氯吡格雷作为药物前体,其在体外不具有活性,需要在肝脏内经CYP450生物酶作用下转化产生活性代谢产物而发挥作用,CYP2C19是CYP450药物代谢酶系中的关键酶,其有个体差异和种族差异[1-2]。多个试验证实,野生型 CYP2C19*1的突变基因CYP2C19*2或CYP2C19*3与氯吡格雷抵抗现象的出现密切相关[3-6]。本研究中我们以CYP2C19*2和CYP2C19*3作为我们的目的基因,在CYP2C19基因变异的脑梗死患者中,观察不同的抗血小板聚集用药方案的临床疗效及出血风险。
1 资料与方法
1.1 一般资料 入组弋矶山医院神经内科脑梗死患者共353例,均经头颅 CT 或 MRI 证实。排除标准:急慢性血液系统疾病或血小板计数<100×109/L;家族或个人出血史;入选前1周内有外科手术史;消化道溃疡急性期及4周内有出血疾病史;伴有严重的肝、肾功能损害;合并感染、肿瘤或免疫系统疾病;阿司匹林、氯吡格雷或西洛他唑过敏者。
1.2 基因测定 收集患者相关临床资料(性别、年龄、高血压病史、糖尿病病史及烟酒嗜好),并进行CYP2C19基因检测,检测CYP2C19*2(681G>A)、CYP2C19*3 (636G>A) 两个位点。根据测定结果,分为:①快代谢(extensive metaboliser,EM)型,CYP2C19*2及*3位点均为野生型即CYP2C19*1*1;②中间代谢(intermediate metaboliser,IM)型,有一个位点为突变型,另一位点为野生型,即CYP2C19*1*2、CYP2C19*1*3;③慢代谢(poor metaboliser,PM)型:CYP2C19*2及*3位点均为突变型,即CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3。IM和PM型即我们的研究对象CYP2C19基因变异患者。
1.3 分组及随访 将筛选出的CYP2C19基因变异患者(IM型+PM型)随机分为单用阿司匹林组(100 mg/d,商品名拜阿司匹林,德国拜耳医药保健有限公司产品);阿司匹林(100 mg/d)+氯吡格雷[75 mg/d,商品名波立维,赛诺菲(杭州)制药有限公司产品]组;阿司匹林(100 mg/d)+西洛他唑(200 mg/d,分两次口服,商品名培达,浙江大冢制药有限公司产品)组。3组患者均连续治疗及随访12个月,分别比较其他两组与阿司匹林+氯吡格雷组间主要心脑血管不良事件(major cardiovascular and cerebrovascular adverse events,MACCE)发生率及出血事件发生率差异,MACCE发生情况(包括心脑源性死亡、严重心律失常、急性心力衰竭、心肌梗死、再发脑梗死、短暂性脑缺血发作、心绞痛、支架内血栓)、出血情况(包括颅内出血、消化道出血、皮肤瘀点、牙龈出血、血尿、鼻衄)。
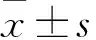
2 结果
2.1 CYP2C19基因变异的发生率 CYP2C19基因变异在脑梗死患者中比较常见,为 53.0%(187例),其中IM型37.8%(133例),PM型15.2%(54例)。
2.2 CYP2C19基因变异患者一般资料比较 3组患者一般资料比较差异均无统计学意义(P>0.05)。见表1。

表1 3组患者一般资料比较
2.3 CYP2C19基因变异患者三种不同治疗方案比较 结果显示,单用阿司匹林组MACCE发生11例(急性心衰1例,心绞痛1例,短暂性脑缺血发作1例,再发脑梗死8例),发生牙龈出血1例;阿司匹林+氯吡格雷组MACCE发生10例(冠脉支架内血栓形成1例,心绞痛2例,心肌梗死1例,再发脑梗死6例),出血事件发生8例(消化道出血1例,血尿1例,皮肤瘀点瘀斑1例,牙龈出血5例);阿司匹林+西洛他唑组MACCE发生2例(短暂性脑缺血发作1例,再发脑梗死1例),出血事件发生7例(皮肤瘀点瘀斑1例,鼻衄1例,牙龈出血5例)。单用阿司匹林组和阿司匹林+氯吡格雷组MACCE发生率均高于阿司匹林+西洛他唑组,差异有统计学意义(P<0.05);而单用阿司匹林组和阿司匹林+氯吡格雷组MACCE发生率差异无统计学意义(P>0.05)。阿司匹林+氯吡格雷组出血事件发生率高于单用阿司匹林组,差异有统计学意义(P<0.05),其他组间出血事件发生率差异无统计学意义(P>0.05)。见表2。
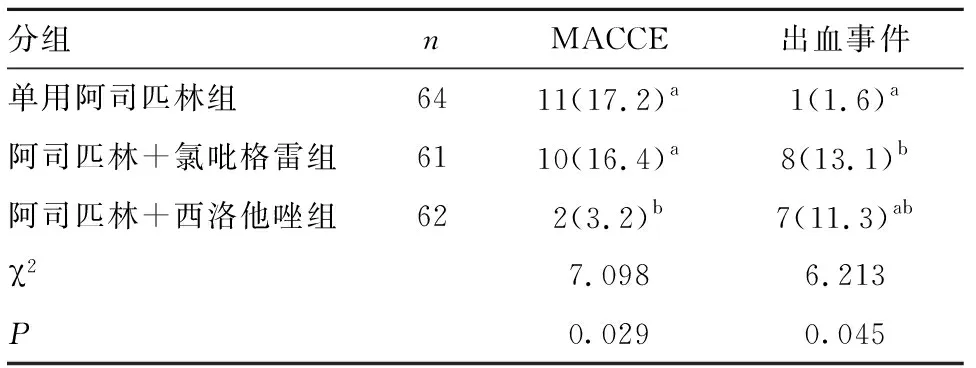
表2 3组MACCE发生率和出血事件发生率比较[n(%)]
3 讨论
3.1 氯吡格雷抵抗的原因 氯吡格雷是噻吩吡啶类抗血小板药,在小肠经药物转运体协调下吸收入血,后经肝脏CYP450药物代谢酶处理成为活性代谢产物,并与血小板膜中的P2Y12 受体相结合,使得P2Y12 受体与二磷酸腺苷(adenosine diphosphate,ADP)的结合受阻,从而使得ADP 介导的纤维蛋白原与血小板糖蛋白GPⅡb /Ⅲa 受体结合减少,影响血小板的激活和聚集。故从整个药物作用过程中看,产生氯吡格雷抵抗的环节可能有:①药物吸收影响。如P 糖蛋白、ABCB1[7]、ABCC3等药物转运体基因影响。②肝脏药物代谢过程的影响。如肝药酶基因(CYP1A2、CYP2C9、CYP2C19、CYP2B6、CYP3A4[8]、CYP3A5[9-10]、PONl[11]酶等)的多态性及其他药物对肝药酶结合位点的竞争作用。③药物与P2Y12 受体结合过程的影响。如P2Y12 受体[12]、ADP 受体基因的多态性等原因等。总的来说,氯吡格雷抵抗是受多基因共同影响的结果[13]。
从肝脏对氯吡格雷代谢过程来看,氯吡格雷首先在肝脏被CYP1A2、CYP2C19 及 CYP2B6 等肝药酶代谢成中间体,后又被CYP2C9、CYP2C19、CYP3A4、CYP3A5 等肝药酶代谢成活性产物 R-130964。CYP2C19基因是细胞色素P450药物代谢酶系中的关键酶,参与了以上两个代谢过程。多个试验已证实CYP2C19基因变异对氯吡格雷抗血小板作用产生较大的影响,使得IM、PM型患者药物使用过程中临床不良事件增多[4,14]。
3.2 药物效果评价标准的选用 本研究对CYP2C19基因变异患者进行三种临床常用抗血小板治疗方案药效比较。由于不同种类抗血小板药物,其药物代谢途径及作用途径不同,如阿司匹林主要通过与环氧化酶(cyclooxygenase,COX)中的COX-1活性部位发生不可逆的乙酰化,导致COX失活,继而阻断了花生四烯酸(arachidonic acid,AA)转化为血栓烷A2(thromboxane A2,TXA2)的途径,抑制血小板聚集;西洛他唑主要通过抑制由ADP、胶原、AA、肾上腺素、凝血酶导致的血小板聚集;氯吡格雷的抗血小板作用主要通过ADP途径介导。而临床上大部分实验室检测血小板聚集方法,受到诱导剂的限制,且实验环境与体内环境差别较大,故本研究选择MACCE的发生率作为药物作用的评价标准。
3.3 三种抗血小板治疗方案的药效及出血风险比较
3.3.1 单用阿司匹林组与阿司匹林+氯吡格雷组比较 这是临床上最为常用的两种抗血小板聚集的用药方案,通过试验对比发现,CYP2C19基因变异患者单用阿司匹林组与阿司匹林+氯吡格雷联用组MACCE发生率无统计学差异,而阿司匹林+氯吡格雷联用出血事件更多。故对于CYP2C19基因变异患者,氯吡格雷的使用并未增加药物效果,该类患者可能无法从阿司匹林+氯吡格雷联合使用中获益,故临床应谨慎使用。
3.3.2 阿司匹林+氯吡格雷组与阿司匹林+西洛他唑组比较 对于CYP2C19基因变异患者,阿司匹林+西洛他唑药物组MACCE发生率较阿司匹林+氯吡格雷组低,两组出血事件发生率差异无统计学意义。故考虑阿司匹林+西洛他唑药物组药效可能更好。从药理作用上看,西洛他唑主要被肝微粒体中细胞色素P450的同功酶CYP3A4代谢、其次被CYP2D6、CYP2C19所代谢,通过抑制ADP、肾上腺素、胶原及AA诱导的血小板初期、二期聚集和释放反应而起到抗血小板聚集作用。由于西洛他唑抗血小板聚集作用途径较为多样化,且CYP2C19并非其主要的代谢作用酶,故可能对CYP2C19基因变异患者起到更好的抗血小板聚集作用。西洛他唑在一定程度上可以改善氯吡格抵抗患者临床预后,这亦在多个试验中证实[15-17]。
2010年,美国食品药品监督管理局(FDA)就CYP2C19基因变异对氯吡格雷的作用效果的影响提出过黑框警告。但对于这类患者如何选用治疗方案,仍缺乏指南指导及专家共识。本研究拟对这类患者的个体化用药进行探索,但由于研究时间较短,样本量有限,故还需要大型多中心临床试验进行验证。
近年来医学已由原来的“概率论”到现在越来越关注到个体的基因差异,针对不同种族差异及个体差异的患者采用不同方案的个体化治疗或将成为未来的研究热点和发展趋势。

