培美曲塞-顺铂或多西他赛-顺铂联合放疗对晚期肺腺癌的临床研究
魏 方,蔡树华,吕东来,钱立庭
(1.中国人民解放军 联勤保障部队第901医院 肿瘤五科,安徽 合肥 230031;2.中国科技大学附属第一医院 安徽省立医院 放疗科,安徽 合肥 230031)
研究表明约60%的非小细胞肺癌(nonsmall-celllung cancer,NSCLC)的患者有远处转移。铂类化疗的有效率约为30%,其中位生存时间8~10个月,不同化疗方案具有相似的疗效。近年来的研究表明,原发性肿瘤的状态与总生存率(overall survival,OS)有关[1],晚期肺癌联合放疗其总生存率提高[2-3],研究表明培美曲塞-顺铂与多西他赛-顺铂治疗非同质性NSCLC两组疗效相似[4]。然而,目前还没有同时使用胸部放疗(Intensity-modulated radiation therapy,IMRT)与培美曲塞联合顺铂或多西他赛联合顺铂治疗晚期肺腺癌患者的研究。胸部放射治疗可降低重症肺炎和心脏病的发生率[5]。因此,本研究进行胸部放疗与培美曲塞-顺铂或多西他赛-顺铂治疗晚期肺腺癌患者,观察其疗效及不良反应,现报道如下。
1 资料与方法
1.1 一般资料 选取中国人民解放军联勤保障部队第901医院2016年1月~2018年1月收治的60例经病理学确诊为晚期非小细胞肺腺癌患者,随机分为培美曲塞-顺铂组(AP组,n=30)和多西他赛-顺铂组(DP组,n=30)。纳入标准:①组织学或细胞学证实的肺腺癌;②新诊断的晚期肺腺癌;③既往无抗癌治疗;④Kaofsky评分(KPS)≥70分;⑤无放疗或化疗禁忌证;⑥转移性疾病≤3个器官;⑦EGFR突变未知或野生型。主要排除标准:①胸部手术史;②妊娠或哺乳期;③既往恶性肿瘤或其他恶性疾病;④胸腔及心包积液者。本研究经本院伦理审查委员会审查通过,并获得所有患者的知情同意。
1.2 预处理评估 患者均行纤维支气管镜检查和胸部CT增强扫描,评估原发肿瘤范围和局部淋巴结状况。采用骨显像、腹部增强CT和头部磁共振成像(MRI)检测远处转移;治疗开始前2周内完成评估。
1.3 治疗方案 患者被随机分为AP(Pem-Cis)组与DP(Doc-Cis)组。AP组:第1天静脉滴注培美曲塞500 mg/m2,第2天静脉滴注顺铂75 mg/m2;DP组:第1天静脉注射多西他赛65 mg/m2,第2天静脉滴注顺铂75 mg/m2。每3周给药1次,最多6个周期。
通过IMRT技术实现对原发肿瘤的辐射,肿瘤总体积(GTV)包括胸部原发肿瘤+阳性淋巴结(短轴>1 cm,PET/CT标准摄取值≥2.5);临床靶体积(CTV)定义为GTV加上0.8 cm的边缘;计划靶体积(PTV)定义为CTV加上0.5~1.0 cm的边缘。总的肺容量接受20 Gy的百分比保持在32%,最大点剂量至50 Gy,平均食管剂量为35 Gy的个体治疗计划。对原发性肿瘤采用后程加速超分割放射治疗:第1个疗程为2.0 Gy,每周5 d,总剂量40 Gy;然后每天两次,每次1.50 Gy。PTV的规定剂量60~70 Gy。每两个化疗周期评估疗效,治疗结束后1个月,进行胸部和腹部CT扫描及头部MRI检查,评估肿瘤情况。3、6、12个月各复查1次,共2年。6、12个月分别行骨显像1次,持续2年。
1.4 观察指标 治疗相关的急性毒性按照美国国家癌症研究所3.0版的不良事件的通用术语标准进行评分。观察近期疗效:完全缓解(CR)、部分缓解(PR)、稳定疾病(SD)和进行性疾病(PD),根据RECIST系统的反应评估观察两组的中位生存时间(median survival time,MST)、总生存率(OS)。
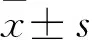
2 结果
2.1 临床资料比较 两组患者临床资料比较差异无统计学意义(P>0.05)。见表1。
2.2 近期疗效比较 AP组完全缓解3.3%(1/30),部分缓解63.3%(19/30),稳定23.4%(7/30),进展10.0%(3/30);DP组分别为3.3%(1/30)、66.7%(20/30)、20%(6/30)和10.0%(3/30);两组近期疗效资料比较,差异无统计学意义(Z=0.219,P=0.827)。
2.3 长期疗效比较 AP组中位生存时间(MST)为20个月(95%CI:14~25月),DP组为12个月(95%CI:10.5~13.5月)。AP组的OS长于DP组,差异有统计学意义(P<0.05)。见表2和图1。
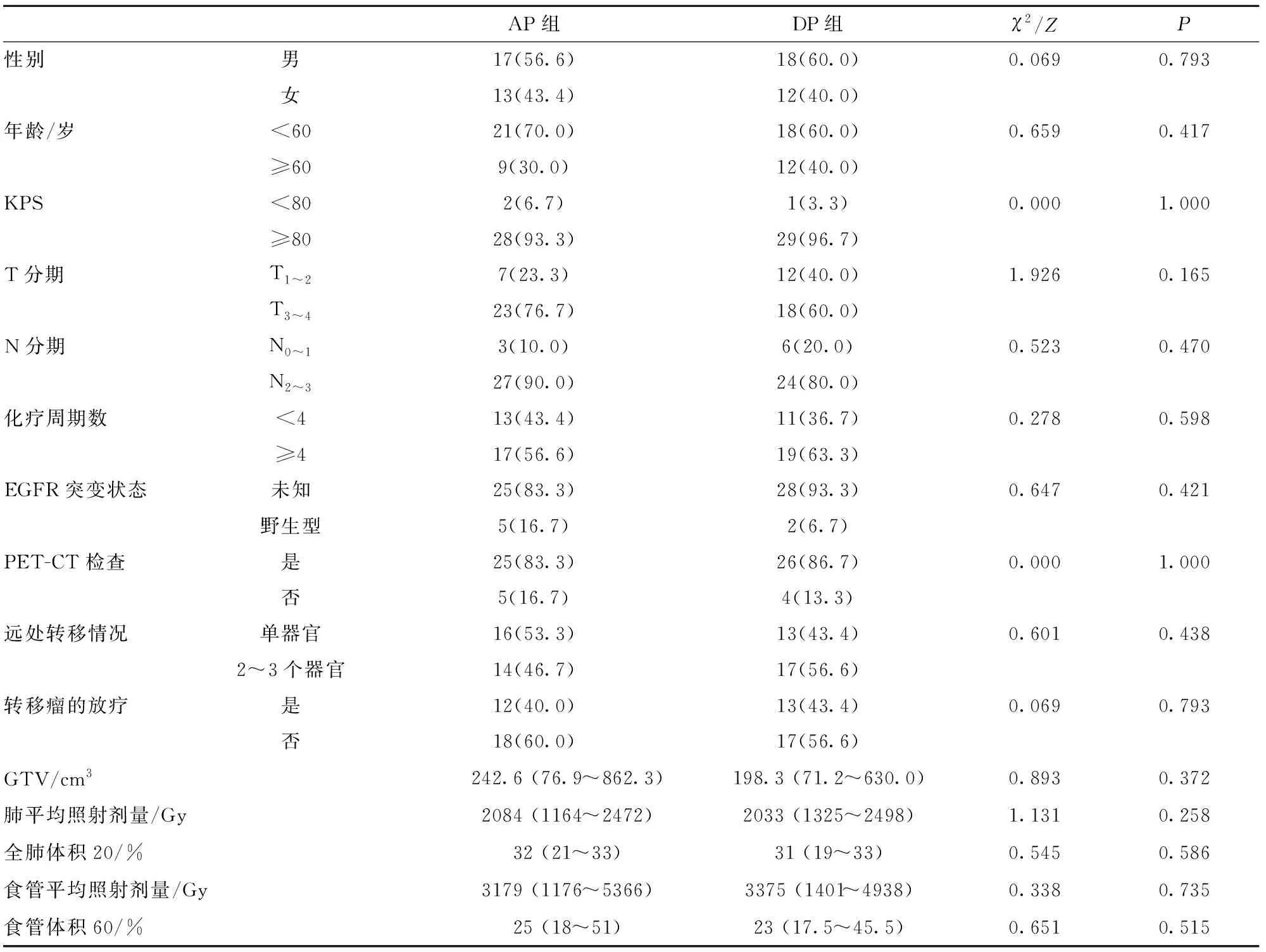
表1 两组患者临床资料比较[n(%),M(P25~P75)]

表2 两组患者长期疗效比较
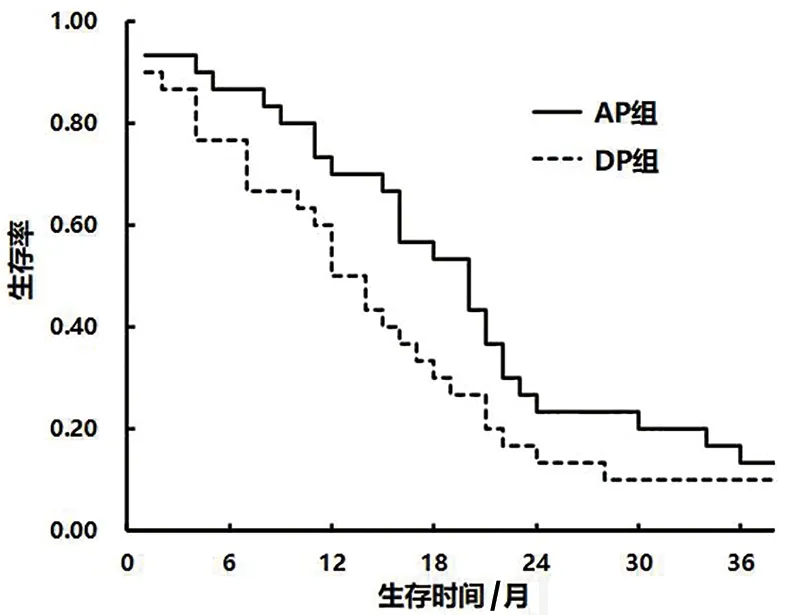
图1 两组患者OS生存曲线
2.4 预后影响因素分析-单因素分析 结果显示,性别、远处转移情况、Hb水平3个指标均与预后有密切关联(P<0.05)。年龄、KPS、T、N、WBC、PLT、转移灶放射治疗、肿瘤体积、方案等指标差异无统计学意义(P>0.05)。见表3。
2.5 预后影响因素分析-多因素分析 以预后为应变量(赋值1=死亡,0=生存,t=生存期),以前述单因素分析(表3)中P<0.10的指标/因素为自变量建立COX比例风险回归模型(后退法)。结果显示,女性(HR=0.510,95%CI:0.287~0.906)、AP方案(HR=0.866,95%CI:0.759~0.988)和高Hb水平(HR=0.507,95%CI:0.318~0.807)是晚期肺腺癌患者预后的有利影响因素(P<0.05)。见表4。
2.6 并发症情况比较 与DP组比较,AP组3~4级白细胞减少症发生率更高,AP组3~4级的贫血发生率、血小板减少症发生率均更低,差异有统计学意义(P<0.05)。其他不良反应两组间比较差异无统计学意义(P>0.05)。见表5。

表3 3年总生存率的单因素分析结果

表4 所有患者总生存率预测因素的多元分析
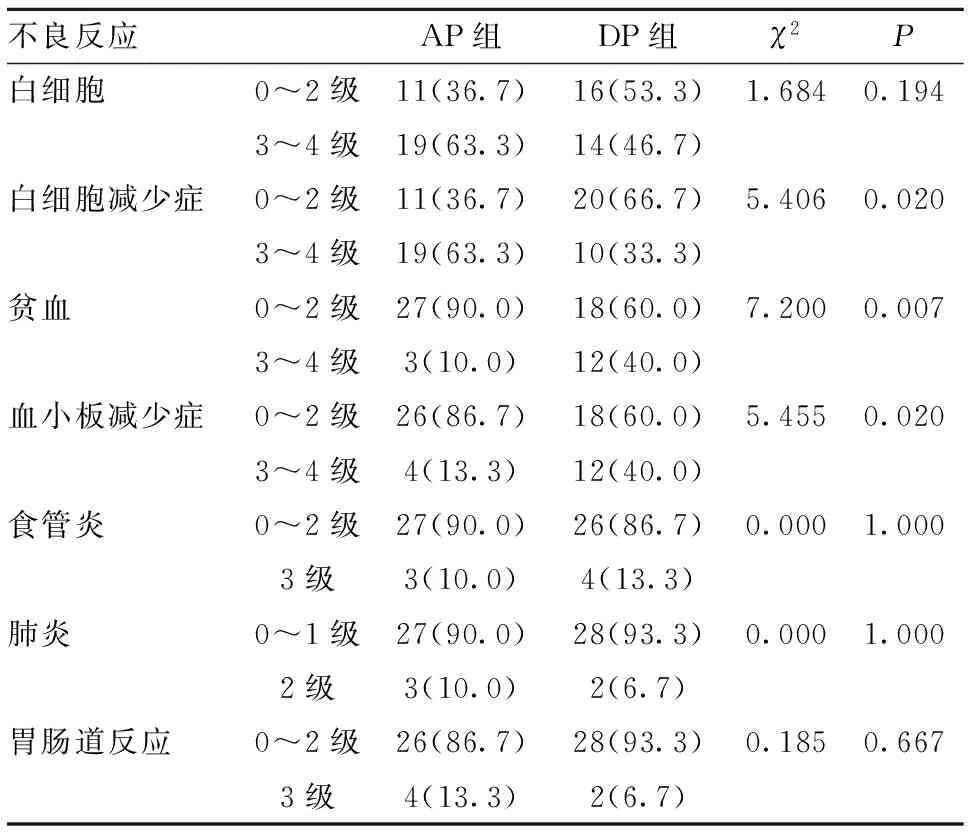
表5 两组患者的不良反应发生率[n(%)]
3 讨论
本研究共纳入70例,排除10例(AP组有5例因个人原因或疾病进展退出;DP组有5例因4级血液毒性或远处转移而退出),完成的共60例,每组各完成30例。
既往研究表明对晚期非小细胞肺癌进行放化疗治疗患者效果较好[6]。本研究结果表明,Pem-Cis和Doc-Cis方案产生相似治疗效果,但采用Pem-Cis的OS和PFS更长。有学者对晚期NSCLC研究显示,Pem-Cis治疗其1年生存率约50%;本研究中,Pem-Cis和Doc-Cis对晚期肺腺癌近期疗效没有差异,两组患者均达到了预期1年生存率70%和50%的标准,AP组患者的生存率较DP组显著提高,可能是本研究对原发性肿瘤联合使用放疗,同时EGFR突变的肺腺癌患者接受培美曲塞治疗有更好的应答率和更长的OS。对无EGFR或ALK突变且PD-L1肿瘤比例评分≥50%的晚期NSCLC患者,与单纯化疗相比,培美曲塞联Pembrolizumab单抗,可在无EGFR或ALK突变的转移性非均质NSCLC患者中产生良好的OS和PFS[7-8]。多因素COX分析显示,女性患者及Hb高水平对OS的预测更好,是预后的有利影响因素。可能是女性NSCLC患者的预后优势主要是由于吸烟状况在性别中分布不均所致[9];Hb水平决定了患者对放疗的灵敏度,低Hb水平可能会影响组织的氧合,导致放疗灵敏度降低。
在本研究中,急性放射性肺炎和食管炎的发病率两组间相似,无3~5级放射性肺炎,2级发生率不到10%。在血液毒性方面,与DP组比较,AP组3~4级白细胞减少症发生率更高,但3~4级贫血及3~4级血小板减少症发生率更低,两组的血液毒性反应都在可接受范围内。结果与以往学者的研究基本相似[10-11]。
本研究的不足之处是样本量较小,研究结果具有局限性;未进行培美曲塞维持治疗,因其不是标准的治疗。因此,需要大样本量进一步继续研究。
综上所述,培美曲塞-顺铂联合胸部同步放疗对晚期肺腺癌是一种潜在的治疗选择,具有可接受的毒性和较高的总生存率。

