双氢青蒿素调控宫颈癌hela细胞的增殖迁移及其分子机制
李苒苒,陆文睿,陶 敏,丁文洁,王李卓,李 硕,何莲芝
(1.皖南医学院 研究生学院,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 妇产科,安徽 芜湖 241001;3.皖南医学院 生物化学教研室,安徽 芜湖 241002)
宫颈癌是全世界女性发病的第四大常见癌症[1],现已成为严重威胁女性生命健康的疾病之一,目前宫颈癌的治疗以手术为主,放化疗为辅。晚期宫颈癌的治疗效果较差,多以放化疗为主要手段;但是,抗癌药物带来的如骨髓抑制、胃肠道毒性和肾脏损害等副作用仍然是目前需要解决的关键问题。因此,开发研究植物类抗癌药物成为目前的研究热点。传承数千年的药用植物因其副作用少成为临床药物开发的首选。青蒿素[2]是一种有效的抗疟药,是从传统中草药青蒿中分离来的,而双氢青蒿素(dihydroartemisinin,DHA)是青蒿素衍生物的主要活性代谢物,展示出青蒿素衍生物中最强的抗癌作用[3-4],研究表明DHA可以抑制肿瘤细胞的增殖,促进其凋亡[5],在本研究中,我们发现DHA影响了hela细胞的增殖和迁移,并初步探讨其对TNF-α/NF-κB信号通路的影响。
1 材料和方法
1.1 材料 hela细胞:中国科学院上海细胞生物研究所; DHA、Cell Counting Kit-8(CCK8)、100 U/mL青霉素-0.1 mg/mL链霉素(美国Solarbio);DMEM培养液、胎牛血清(韩国Biosharp); Cell-Light EdU Apollo567 In Vitro Ki(广州锐博);TNF-α、TNFR1及TNFR2(Proteintech);β-actin(Sigma);NF-κB p65(Cell Signaling Technology)。
1.2 方法
1.2.1 细胞培养 hela细胞在添加10%胎牛血清、100 U/mL青霉素-0.1 mg/mL 链霉素的DMEM培养基中,置于37℃、5% CO2条件培养箱中促进生殖传代,待细胞生长至约90%时,用0.25%胰酶消化传代后继续培养,取对数生长期的细胞进行实验。
1.2.2 CCK8法检测细胞活力 取对数生长期的hela细胞密度为3×104/mL接种于96孔板培养, DHA用DMEM培养液稀释成浓度为0、10、20、30、40、60 μmol/L,分成6组处理细胞,每组4个复孔,分别于培养12、24、36 h时加入10%的CCK8试剂,后继续培养2 h,酶标仪检测450 nm处的吸光度,计算半抑制浓度IC50。
1.2.3 细胞划痕实验 以每孔2×105/mL的密度将hela接种于六孔板中,当细胞密度达到100%时,以消毒的200 μL枪头对准无菌直尺于六孔板中垂直划数条泳道,用PBS清洗3次,分为对照组(DMEM培养液)和实验组(20 μmol/L DHA),分别于培养12、24、36 h时拍照,每组取3处测量划痕位置的宽度(即划痕面积),计算细胞的迁移率=(0 h划痕面积-某时间点划痕面积)/0 h划痕面积×100%。
1.2.4 蛋白质免疫印迹法 分为对照组、实验组(20及30 μmol/L DHA),分别干预细胞36 h后提取细胞蛋白:经药物处理后的贴壁细胞,弃培养液,PBS 洗涤3次,加入适量的蛋白裂解液裂解,后收集裂解的细胞至1.5 mL EP 管,使用细胞破碎仪破碎细胞,继续置于冰上静置30 min,随后4℃、12 000 r/min离心15 min,取上清,即为细胞总蛋白。按照蛋白80 μg/孔上样,电泳,转膜,封闭,孵育一抗于4℃冰箱过夜,次日1×TBST洗涤一抗,共3次,每次10 min,后二抗室温孵育2 h,1×TBST洗涤,每次10 min,共3次,曝光,Image J 分析灰度值。
1.2.5 EdU细胞增殖检测 细胞干预36 h后,将hela细胞于EdU培养基(50 μmol/L)中孵育2 h,然后根据Ribobio的Cell-Light EdU细胞增殖试剂盒的实验说明书,将细胞在4%多聚甲醛中固定10 min,用0.5%Triton-X-100增强稳定性,并用Apollo®荧光染料染色。然后即可在荧光倒置显微镜上观察拍照。
1.2.6 统计学处理 用SPSS 19.0软件处理数据进行统计学分析,作图使用Graphpad软件,计量资料用均数±标准差表示,两组间比较用t检验,多组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CCK8检测DHA对hela细胞活力的影响 干预12、24和36 h后,不同浓度DHA处理的hela细胞存活率呈逐渐降低趋势,在12 h时变化趋势相对不明显,而处理24和36 h的细胞活力随着DHA浓度的增加而降低(表1)。该结果表明DHA对hela细胞的作用呈现出剂量和时间依赖性,计算出细胞处理24及36 h的半抑制浓度(IC50)分别为:28.48 μmol/L (95%CI:25.17 ~32.24 μmol/L);22.44 μmol/L(95%CI:14.18 ~ 35.52 μmol/L)。根据结果我们选择20 μmol/L DHA处理细胞36 h进行后续EdU实验。

表1 不同浓度组DHA对hela细胞活力的影响
2.2 EdU实验检测DHA对hela细胞增殖的影响 EdU实验结果显示,与对照组相比,DHA处理后可见hela细胞明显的核皱缩,细胞核轮廓不清(图1),细胞增殖率差异具有统计学意义(P=0.0058,<0.01)。
2.3 DHA抑制hela细胞的迁移 选取20 μmol/L DHA处理hela细胞进行细胞划痕实验(图2),结果表明,DHA处理后的hela细胞较对照组的创口愈合速度更慢(表2),表明DHA可以抑制hela细胞的迁移。

NC组:正常培养的hela细胞;DHA组:使用20 μmol/L的DHA处理36 h,使用荧光显微镜观察细胞增殖(20×)。

图2 细胞划痕实验检测DHA对hela细胞迁移能力的影响

表2 两组hela细胞的迁移情况(n=3)
2.4 蛋白质免疫印迹法检测DHA对hela细胞TNF-α/NF-κB信号通路相关蛋白的影响 以20 μmol/L和30 μmol/L DHA刺激hela细胞36 h,结果显示,细胞中炎症因子TNF-α、TNFR1、TNFR2在药物处理组表达降低,与此同时NF-κB的表达在药物处理后也降低(图3),差异均有统计学意义(表3)。

图3 蛋白质免疫印迹法检测DHA对hela细胞的影响
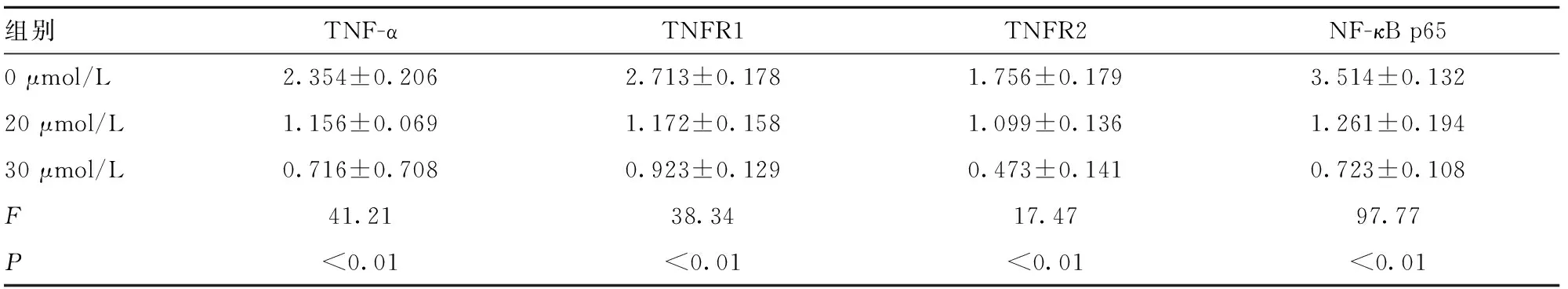
表3 DHA对细胞中炎症相关因子的影响(n=4)
3 讨论
宫颈癌是一种高发的恶性肿瘤,是严重威胁女性健康的重要疾病[6]。宫颈癌细胞侵袭能力强,发生扩散和转移的中晚期患者手术效果差,顺铂、卡铂、紫杉醇等常用化疗药物的药物毒性大,副作用严重。近年来,中医药所带来的抗肿瘤效果受到了广泛的关注,作为FDA批准的青蒿素衍生物的抗疟药,DHA可以通过调节氧化还原稳态而成为一种有效的抗癌药物[7]。目前已有的关于DHA的抗癌治疗研究包括肝癌[8]、胆囊癌[9]、乳腺癌[10]等。有研究表明,DHA可用于治疗人乳头瘤病毒感染导致的上皮内病变,包括一系列发展成赘生物的病变[11],作用机制包括诱导细胞凋亡[5],抑制血管生成并增强了对放射线和抗癌药的敏感性[12]。但对于DHA在治疗宫颈癌中的具体机制尚无定论性的研究。本研究中,我们研究了DHA对hela细胞的影响及其可能机制,首先通过CCK8实验发现随着DHA浓度升高,细胞存活率不断下降,延长DHA的作用时间后存活细胞也不断减少,说明DHA抑制了hela细胞的增殖并呈剂量和时间依赖性,随后EdU实验发现DHA处理后细胞核发生皱缩,增殖细胞数量明显减少,实验结果进一步验证了DHA明显抑制了hela细胞的增殖,划痕实验结果表明DHA抑制了hela细胞的迁移。
宫颈癌的发生发展主要与宫颈人乳头瘤病毒感染导致慢性炎症从而诱导强烈的免疫机制有关[13],包括吞噬作用、淋巴细胞浸润、感染的角质形成细胞触发多种促炎细胞因子所产生[14], TNF-α是参与调节肿瘤微环境的多效性细胞因子,主要通过与两个不同的受体TNF-α受体Ⅰ(TNFR1)和TNF-α受体Ⅱ(TNFR2)的结合而发挥生物学功能诱导细胞凋亡或细胞死亡。TNFR1具有细胞内死亡结构域,大多数信号是由TNFR1传递的[15],TNFR2则通过调节性T细胞发挥作用参与宫颈癌的发生及进展[16]。TNF-α通过多种途径与其受体相互作用,包括通过以核因子κB(NF-κB)依赖的方式诱导编码抗凋亡分子的基因表达从而促进恶性细胞的增殖[17]。本实验发现TNF-α、TNFR1、TNFR2、NF-κB在实验组表达均降低,且差异均具有统计学意义,因此认为DHA抑制细胞的增殖与TNF-α/NF-κB有关,NF-κB是一种重要的核转录调节因子,主要以p65和p50两个亚基组成的异源二聚体形式存在,当细胞受到炎性因子如TNF-α刺激时,二聚体进入细胞核内并与相应靶基因上特定的序列结合,参与转录调控,对炎症反应起到放大作用[18]。闫锡钊等[19]研究指出宫颈组织癌变过程中TNF-α和TNFR1表达增强,而其作为激活经典炎症途径NF-κB的上游信号,可导致宫颈局部组织的持续性炎症微环境,并促进癌细胞的增殖。因此,结合本实验结果,推测TNF-α/NF-κB信号通路影响了DHA对宫颈癌的作用,炎症机制可能为其主要参与途径,进一步深入研究在宫颈癌细胞中DHA对TNF-α/NF-κB信号通路的影响可能为宫颈癌的防治带来新的方向。

