糖尿病伴牙周炎患者下颌前磨牙剩余牙槽骨内牙根三维模型的建立
牙周炎已被列为糖尿病的主要并发症之一,是引起糖尿病患者牙齿松动、脱落的直接原因。研究表明,糖尿病可加重牙周组织破坏,牙槽骨丧失明显增加[1-2]。相对于常规型牙周炎,当糖尿病伴牙周炎患者的牙周组织受到炎症侵袭及创伤刺激时,牙槽骨吸收形态更加复杂,吸收程度更重,更易导致牙齿的松动甚至脱落[3]。传统二维图像很难对其牙槽骨丧失情况进行准确判断,随着锥束计算机体层摄影术(cone beam computed tomography,CBCT)被广泛的应用于口腔疾病的诊断与分析中,并与数字化软件的图像分割技术相结合,使得活体个性化牙根三维模型的建立成为可能[4]。建立剩余牙槽骨内的牙根三维模型,对精准测量糖尿病伴牙周炎患者的剩余牙槽骨和牙槽骨的丧失程度,制定精准治疗方案具有重要意义。本研究旨在通过CBCT图像数据建立糖尿病伴牙周炎患者下颌前磨牙剩余牙槽骨内的牙根三维模型,以期为剩余牙槽骨量的三维准确测量研究提供基础模型。
1 材料和方法
1.1 材料来源 选择2019年2月在空军特色医学中心口腔科就诊的糖尿病伴牙周炎志愿者1例,男,60岁,对患者分别进行血糖控制和牙周基础治疗。空腹血糖控制在8.88 mmol/L以下,牙周基础治疗包括口腔卫生宣教、自我控制菌斑、正确有效的刷牙、龈上洁治术、咬合调整消除咬合性创伤,牙周局部上2%碘甘油,4次/d等,疗程14 d。患者对本研究知情,并签署知情同意书。
1.2 实验设备和软件 CBCT(KaVo 3D eXam,卡瓦公司,德国),电压84 kV,电流450 uA,层厚25 um;医学影像学软件Mimics18.0(Materialise公司,比利时);计算机主机,配置:Intel(R)Core(TM),i5-6500 CPU@3.2GHz,4.0 GB内存,Windows7操作系统。
1.3 方法
1.3.1 CBCT图像的获得 CBCT扫描参数为:管电压84 kV,管电流450 μA,层厚25 μm,曝光时间26.9 s,显示矩阵像素0.25 mm,患者坐位,眶耳平面和地平面平行,头部置于CBCT扫描架中,牙列正中咬合,进行CBCT大视野扫描,以0.25 mm体素分辨率保存为DICOM格式体层数据。
1.3.2 分割提取活体牙根 应用医学影像软件Mimics 18.0中的Import Image命令导入患者的DICOM格式的体层数据,增强导入的CBCT图像(图1)。由于不同组织灰度值不同,因此通过阈值来提取研究所需的目标组织,故阈值的设定是否准确是提取牙体组织的关键。经多次调整CBCT断层图像的阈值参数后,定为Min800~1 200 HU,Max3 071 HU,分别在最小阈值800 HU和1 200 HU时建立下颌各个蒙版(Mask)层,然后将2个最小阈值建立起来的Mask层重叠,运用Edit Mask中的Erase工具对除了右侧下颌第一前磨牙以外的器官进行擦除,以此区分开颌骨及牙齿,从而获得右侧下颌第一前磨牙的三维数字模型(图2)。在CBCT扫描的过程中,出现的噪声可能导致牙体组织部分信息丢失,进而在获得的模型中形成空洞,本研究运用Draw工具进行空洞填补,使得模型更加平滑,也更接近牙齿真实的解剖形态(图3)。
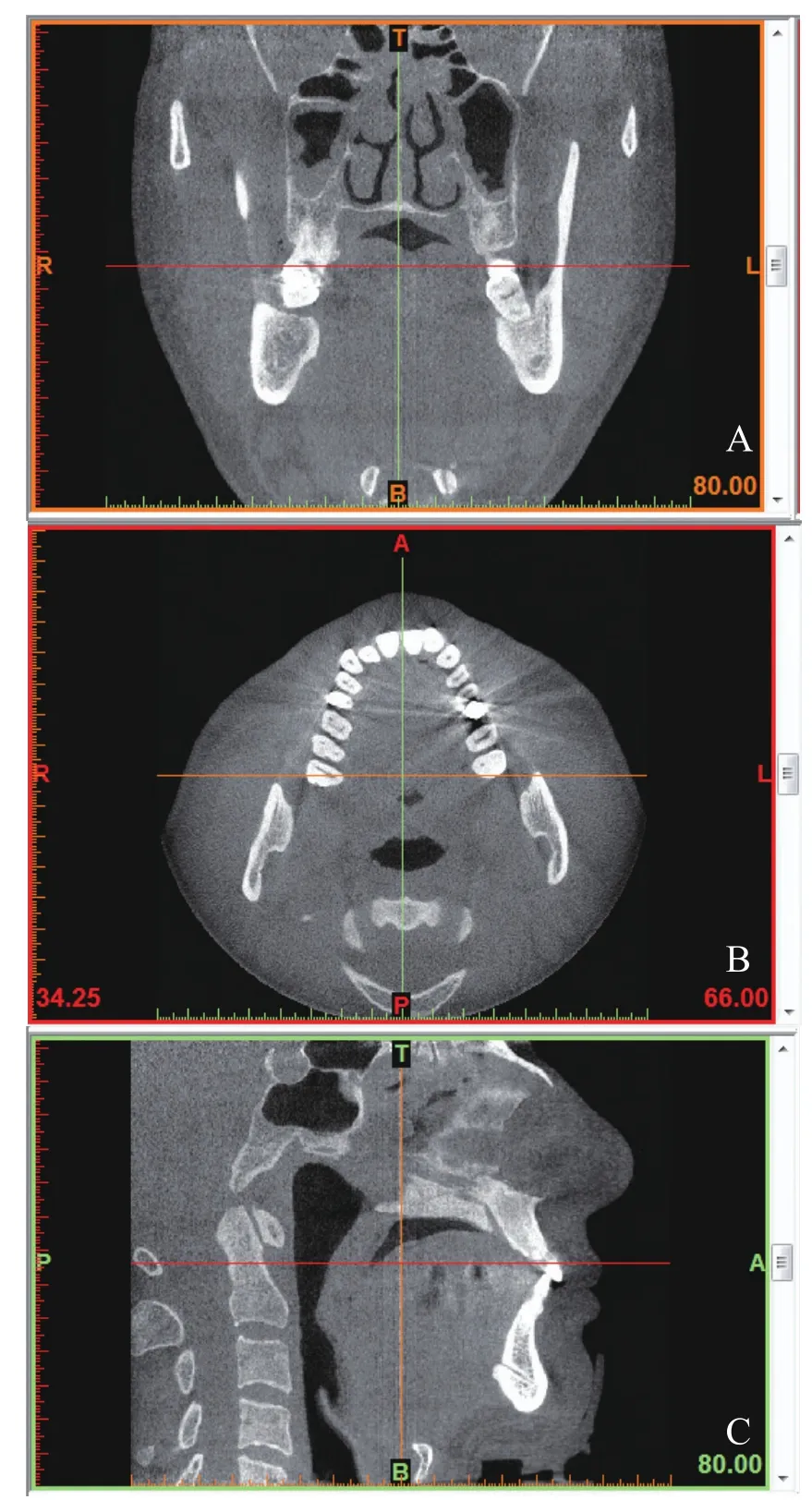
图1 Mimics下导入DICOM格式图像

图2 右侧下颌第一前磨牙三维模型侧面图

图3 空洞填充前后同一切面图
1.3.3 确定剩余牙槽骨吸收边界 在获得的CBCT断层图像中,包含右侧下颌第一前磨牙的断层图像共28张。运用Point工具从右侧下颌第一前磨牙的远中面中1/3与剩余牙槽嵴交点处取点,沿着剩余牙槽嵴每两张断层图像取一次点,共取得14个点。将取得的14个点连起来,得到剩余牙槽骨的边界曲线(图4)。
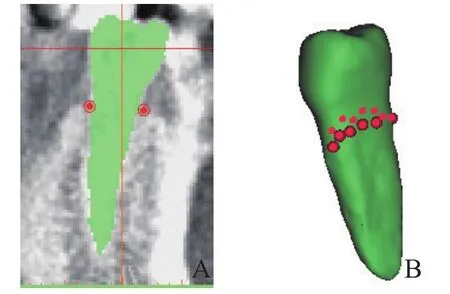
图4 牙槽嵴取点示意图
1.3.4 剩余牙槽骨内的牙根三维模型的建立 运用曲线切割的原理,用取点连线的方法定义出剩余牙槽骨边界的切割曲线,此曲线切割面垂直于视平面,采用Cut命令将右侧下颌第一前磨牙这个对象分成彼此独立的2个3D对象,仅留下剩余牙槽骨内的牙根三维模型,切割轨迹将在3D中实时显示,如果切割深度没有切透,将被视为无效切割,故应对切割深度予以重视,以免影响模型的精度及研究效率。
2 结果
成功建立了糖尿病伴牙周炎患者下颌前磨牙剩余牙槽骨内的牙根三维模型,该模型清晰完整,可从不同角度观察和精准测量剩余牙槽骨内的牙根三维形态和参数(图5)。本例右侧下颌第一前磨牙的牙根总长度为16.80 mm,牙根总表面积为212.65 mm2,牙根总体积为219.68 mm3,剩余牙槽骨内的牙根长度为13.24 mm,牙根表面积为164.85 mm2,牙根体积为160.45 mm3。
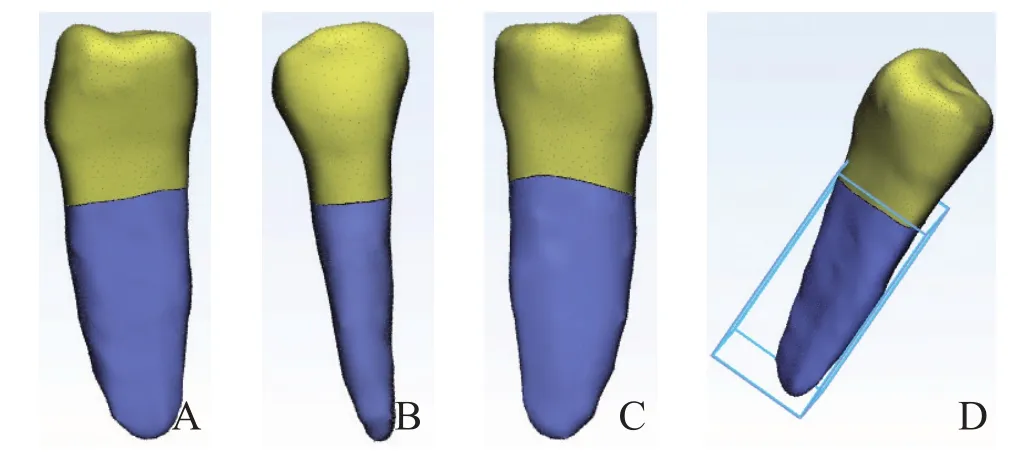
图5 剩余牙槽骨内牙根三维视图
3 讨论
3.1 图像数据的获取 原始图像数据的获取是三维模型建立的基础,其获取方法多样,各具特点。激光三维扫描技术应用于口腔领域,可快速获取牙颌图像数据,在口外对石膏牙模型的扫描精度可达到0.01 mm以上,采集点云图像后重建出的三维模型像素清晰,足以达到临床要求[5-6],但成本相对较高,若在口内进行扫描,时常出现盲点,加上激光扫描存在反射,故重建出的三维模型往往需要重构[7]。此外,用激光扫描技术只能对牙冠等可见部分成像,而CT设备可对牙齿、牙槽骨等硬组织进行影像显影,三维重建后可间接获得牙根的三维形态信息。多层螺旋CT(Muti Slice CT,MSCT)虽与以往的单层螺旋CT比较,在数据处理系统和探测器结构方面均有了根本性的改进,使其分辨率提高,扫描速度加快,后处理图像的质量也有很大改善[8],Hashimoto等[9]分别使用Morita 3DX牙颌面锥束与Toshiba Asterion Super 4层螺旋CT扫描厚度约2 mm的人颌骨锯层标本,对图像质量进行对比研究。方冬[8]也针对Implagraphy CBCT与MSCT的图像质量做了比较,结果在显示牙槽骨、牙及牙周组织等细小解剖结构时,无论从图像的解剖形态方面,还是在图像的细腻程度、锐利度方面,CBCT的能力均高于MSCT。本研究本着CBCT辐射剂量小、获得信息全面、扫描无创伤和破坏性、操作方便等优点,对患者颅颌面进行CBCT扫描,获得三维模型的原始数据,以满足后期对数字化牙颌模型牙根分割的需要。
3.2 牙根的分割提取 牙根的三维解剖形态是临床上影响口腔修复效果的重要因素,其中下颌前磨牙是重点研究的对象之一[10]。Mimics是Materiaise公司交互式的医学影像控制系统,是一套高度整合而且易用的3D图像生成及编辑处理软件,它将输入的CBCT扫描数据生成牙颌三维模型,再运用软件提供的灰度阈值、区域增长、形态学操作即布尔运算等分割工具,帮助口腔医师快速方便的突出感兴趣的区域,即下颌前磨牙的牙根所在区域。本研究首先遇到的难题就是牙根的分割,原因一是整个牙体组织密度不均匀,从牙冠到牙根密度逐渐降低,这使得CBCT序列切片图像中不同位置牙体组织的灰度值不同,在Mimics软件中针对牙根的分割很难划分统一的灰度阈值;二是牙根与牙槽骨物理位置接近,约0.15~0.38 mm,且二者密度相似,因CBCT放射剂量较小,在CBCT影像中两者灰度值较接近,故边界难以被清晰识别[2];三是由于牙根某些部位存在不规则性,在CBCT序列切片图像个别区域会出现伪边界或边界缺失。准确的设置阈值是提取目标牙根组织的关键,本研究采用半自动分割的方法来提取牙根,期间多次改变灰度阈值的左象限,通过查看图片检查提取的组织是否合适,发现阈值左象限设置的太低,会提取许多噪点,阈值左象限设置的太高,会出现目标牙根组织丢失,故本研究利用Mimics将提取的2种不同的像素放在一个蒙罩中,同时运用Mimics提供的一系列工具编辑修改蒙罩,从而提取研究所需的目标牙根组织,编辑好的蒙罩可用来生成3D模型,实现了2D断层扫描图片到三维实体模型的转换。此方法在口腔医生专业经验的基础上,对牙根的灰度图像进行逐层编辑修改,大大提高了牙根三维模型的精度,但费时费力,效率还待进一步提高。
3.3 剩余牙槽骨内的牙根三维模型的建立 糖尿病伴牙周炎患者牙槽骨丧失的三维形态复杂,且病程发展迅速,口腔医师需要在短时间内准确评估此类患者牙齿的功能状态,除了冠根比这一传统意义上的指标外,更看重牙根的牙槽骨支持面积及体积,因此,需要寻找一种简单易行的方法,确定牙槽骨吸收边界,对于此边界的确定,先前鲜有报道。本研究运用Mimics软件通过沿剩余牙槽嵴取点连线的方法定义剩余牙槽骨吸收边界,曲线切割后建立起的牙根三维模型往往没有经过任何优化,必须经过平滑步骤后,才能得到优化的三角片模型。本研究运用了Mimics软件中的平滑操作,用来平滑牙根模型几何体表面。平滑中有两个重要的参数:平滑因子和迭代次数,平滑因子是0~1之间的一个系数,在遍历并对每个单元重新赋值的时候,要考虑与该单元相邻单元的拓扑形状,使得牙根三维模型在形状上不会太“突出”,不会太“离谱”,这样才能达到平滑效果,迭代次数代表着平滑运算的次数,次数越高,平滑效果越好,计算也越慢,但平滑效果好不一定代表模型越真实,故本研究在获得的三维模型能准确代表剩余牙槽骨内的牙根客观实体的基础上,尽量增加迭代次数,得到一个平滑美观但相对准确的牙根三维模型。
临床上想要估算出糖尿病伴牙周炎患者牙槽骨吸收的严重程度,仍需准确测量出剩余牙槽骨内的牙根长度、表面积及体积,进而计算出与牙根总长度、总表面积及总体积的比值,但如何通过这一系列数值准确反映出基牙牙根的形态与功能,尚有待进一步研究。
综上所述,CBCT图像结合数字化软件图像分割技术准确地建立了糖尿病伴牙周炎患者下颌前磨牙剩余牙槽骨内的牙根三维模型,为研究糖尿病伴牙周炎患者牙槽骨丧失的三维精准测量奠定了基础,为临床上多参数、全面评价糖尿病伴牙周炎患者基牙牙根的形态和功能提供了新方法。

